1 Megszilrduls kristlyosods Fzistalakuls olvadk szilrd lsd H













- Slides: 25

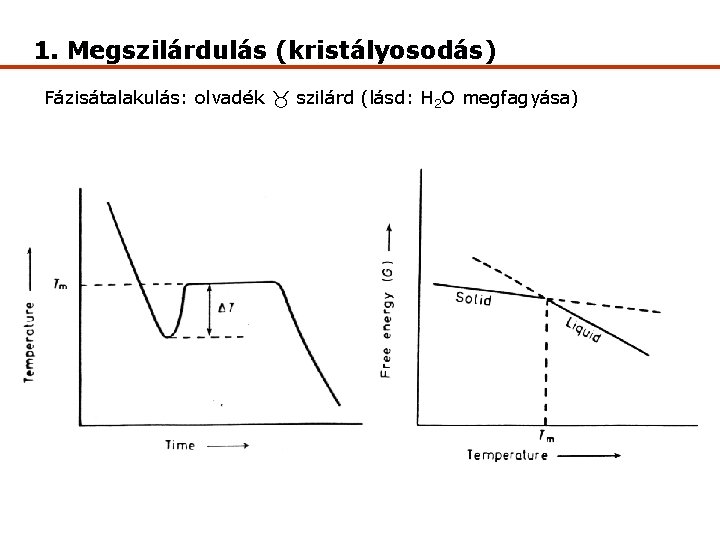
1. Megszilárdulás (kristályosodás) Fázisátalakulás: olvadék szilárd (lásd: H 2 O megfagyása)

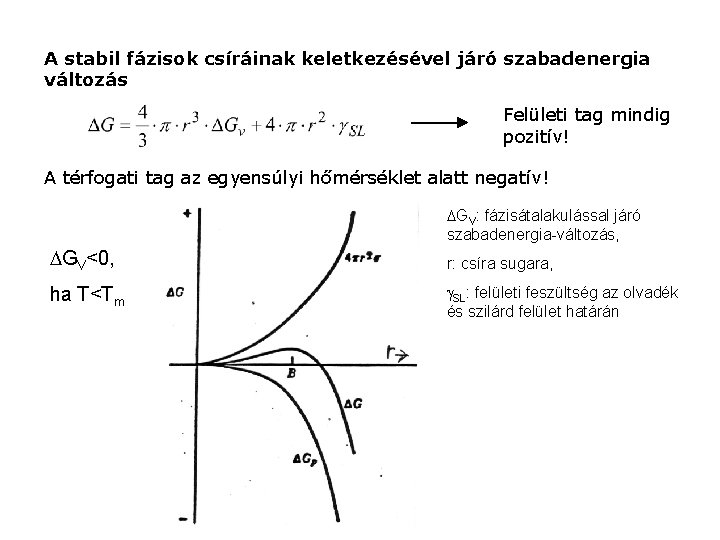
A stabil fázisok csíráinak keletkezésével járó szabadenergia változás Felületi tag mindig pozitív! A térfogati tag az egyensúlyi hőmérséklet alatt negatív! GV: fázisátalakulással járó szabadenergia-változás, GV<0, r: csíra sugara, ha T<Tm SL: felületi feszültség az olvadék és szilárd felület határán

Ha az átalakulást, mint a túlhűlés mértékét (vagy mint időbeni eseményt) nézem, A kritikus csíra mérete: r*: kritikus csíra sugara, TE: átalakulás egyensúlyi hőmérséklete (olvadáspont), L: olvadáshő, ΔT: túlhűtés mértéke

2. Ötvözetek képződése Ötvözet • fémes tulajdonság • két vagy több fémből illetve metalloid elemből áll (C, N, O, Si, B, P, H). Előállítás • komponensek direkt bemérése olvasztás • elektrokémiai módszer együtt leválasztás • mechanikai ötvözés őrlés golyósmalomban • kémiai reakció: Fém – H A komponensek kapcsolatai • szilárd oldat képződése • fémes vegyület képződése • nincs oldódás, sem vegyületképződés

2. Ötvözetek képződése A kémiai összetétel hatása a termodinamikai állapotfüggvényekre – Elegyedési entalpia H= Hi + He elegyedési entalpia Hi= x. AHA + (1 -x. A)HB összetevők entalpiájának súlyozott összege koncentráció

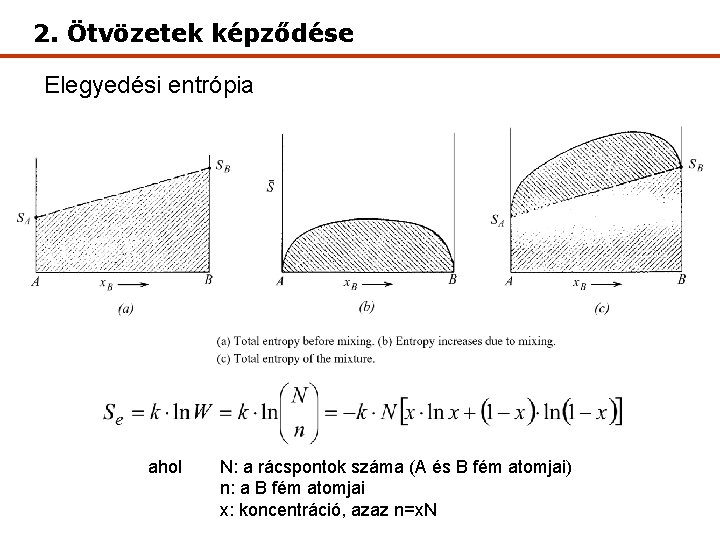
2. Ötvözetek képződése Elegyedési entrópia ahol N: a rácspontok száma (A és B fém atomjai) n: a B fém atomjai x: koncentráció, azaz n=x. N

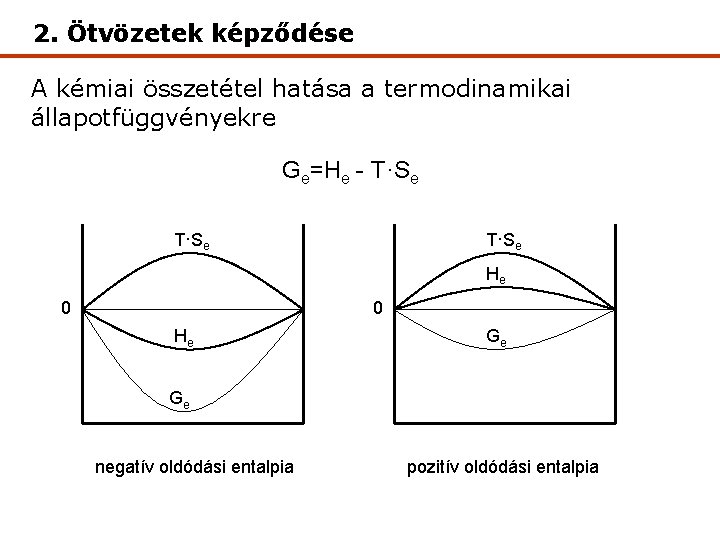
2. Ötvözetek képződése A kémiai összetétel hatása a termodinamikai állapotfüggvényekre Ge=He - T·Se He 0 0 He Ge Ge negatív oldódási entalpia pozitív oldódási entalpia

3. Kétalkotós ötvözetek és kristályosodásuk Az egyensúlyi fázisdiagramok Hőmérséklet-összetétel diagramok: Tammann ábrák Miről szólnak? Adott hőmérsékleten és összetételnél milyen fázisok vannak egymással egyensúlyban.

A Gibbs fázisszabály F + Sz = K + 2 F: fázisok száma Sz: szabadsági fokok száma (szabadon változtatható állapothatározók száma) K: komponensek száma Ha a nyomás változásának lehetőségétől eltekintünk, azaz p = konst. F + Sz = K + 1 Sz = K – F + 1 (3 - F két komp. esetén, 2 - 1 egy komp. esetén)

Milyen legfontosabb típusaik vannak? 1. Szilárd oldatok Amelyekben az elegyedés korlátlan. Feltételei a Hume-Rothary szabályok teljesülése, minden összetételnél azonos fázis van azonos kristályszerkezettel. 2. Eutektikus rendszerek két alcsoport: • szilárd állapotban egyáltalán nincs oldódás • szilárd állapotban korlátos oldódás van 3. Vegyületképző rendszerek 4. Peritektikus rendszerek 5. Monotektikus rendszerek

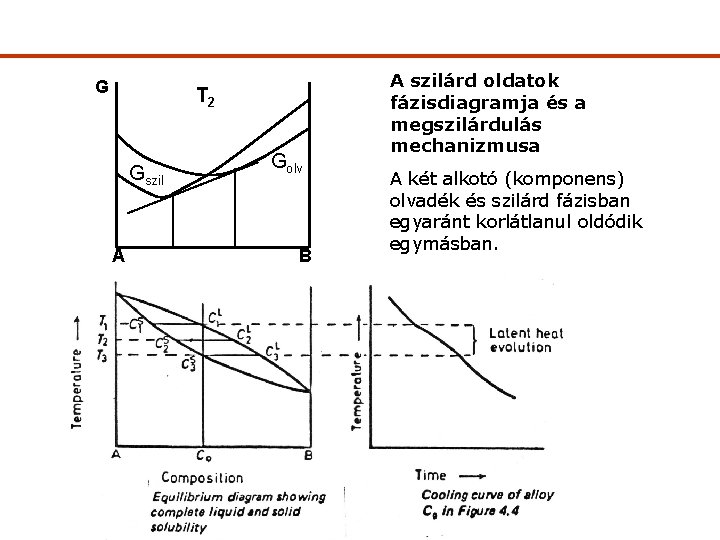
A szilárd oldatok fázisdiagramja és a megszilárdulás mechanizmusa A két alkotó (komponens) olvadék és szilárd fázisban egyaránt korlátlanul oldódik egymásban. T T olvadék olv. likvidusz szolidusz + sz il. szilárd oldat A B

Szilárd oldatok képződésének feltételei (Hume-Rothary) A korlátlan elegyedés feltételei • atomi átmérők különbsége: maximum 15% • azonos vegyérték • elektronegativitásuk közel azonos • azonos rácsszerkezet Szilárd oldat • helyettesítéses (szubsztitúciós) • rácsközi (interstíciós) • rendezett • rendezetlen

G T 2 Gszil A Golv B A szilárd oldatok fázisdiagramja és a megszilárdulás mechanizmusa A két alkotó (komponens) olvadék és szilárd fázisban egyaránt korlátlanul oldódik egymásban.

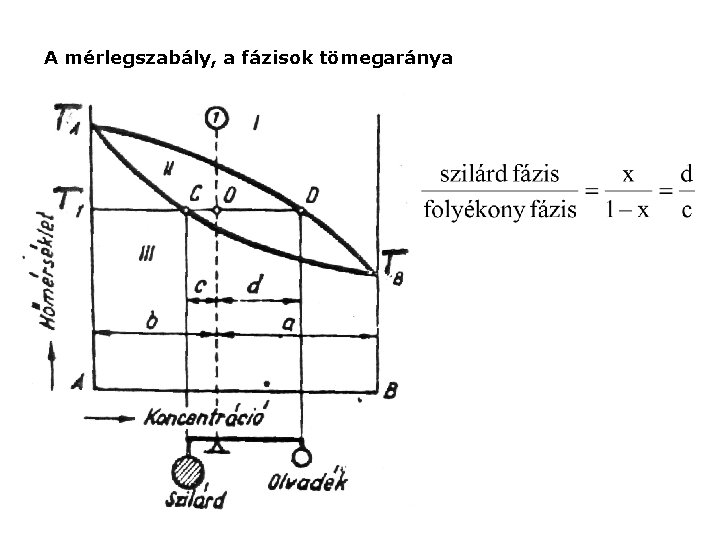
A mérlegszabály, a fázisok tömegaránya

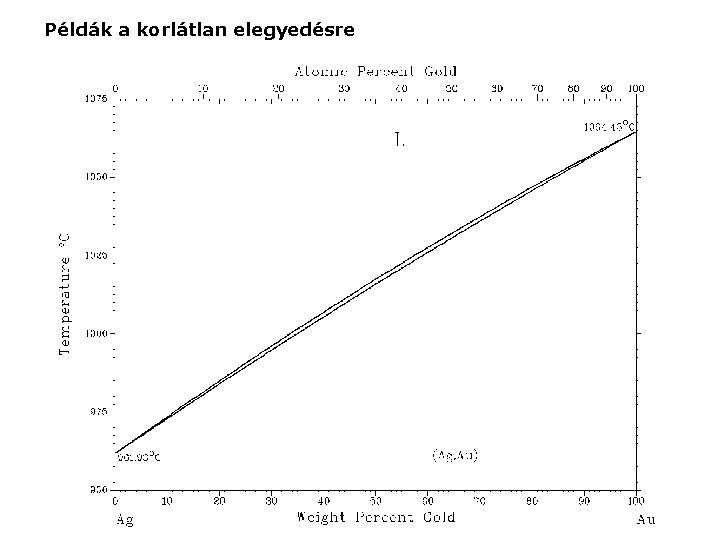
Példák a korlátlan elegyedésre

Példák a korlátlan elegyedésre rendezetlen (magas T) rendezett (alacsony T)

Az eutektikus összetétel, az eutektikus kristályosodás Eutektikus: könnyen olvadó. Kiemelkedő jelentőségűek: • szerkezeti anyagok; • kompozitok; • acélokban lejátszódó folyamatok megértése szempontjából. Lényege: kémiailag homogén fázisból egyidejűen egymástól és a kiinduló fázis összetételétől is eltérő összetételű (és kristályszerkezetű) fázis keletkezik. „Csatolt kristályövekedés. ”

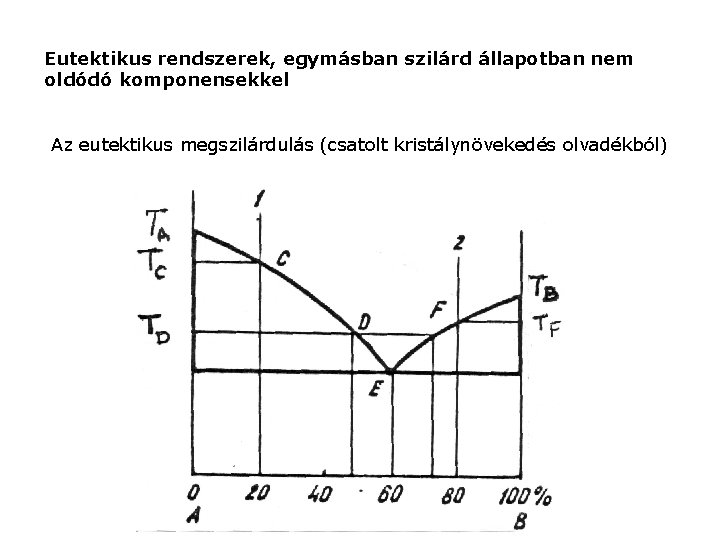
Eutektikus rendszerek, egymásban szilárd állapotban nem oldódó komponensekkel Az eutektikus megszilárdulás (csatolt kristálynövekedés olvadékból)

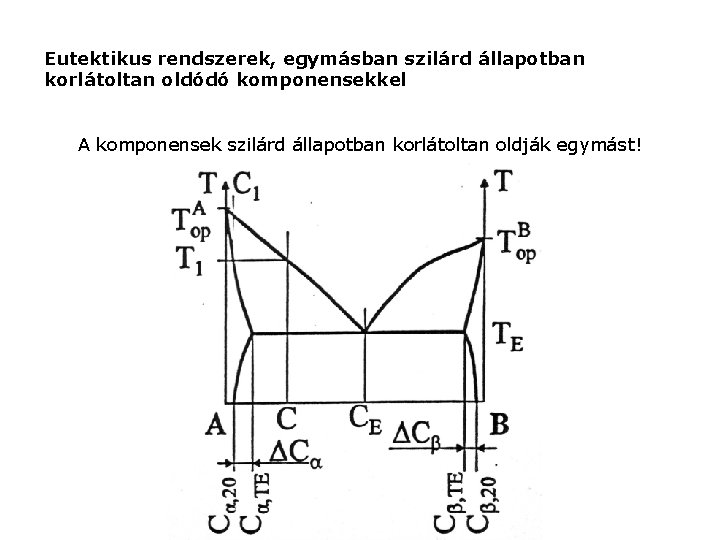
Eutektikus rendszerek, egymásban szilárd állapotban korlátoltan oldódó komponensekkel A komponensek szilárd állapotban korlátoltan oldják egymást!

Eutektikus rendszerek, egymásban szilárd állapotban korlátoltan oldódó komponensekkel A komponensek szilárd állapotban korlátoltan oldják egymást!

Eutektikus rendszerek, egymásban szilárd állapotban korlátoltan oldódó komponensekkel A komponensek szilárd állapotban korlátoltan oldják egymást!

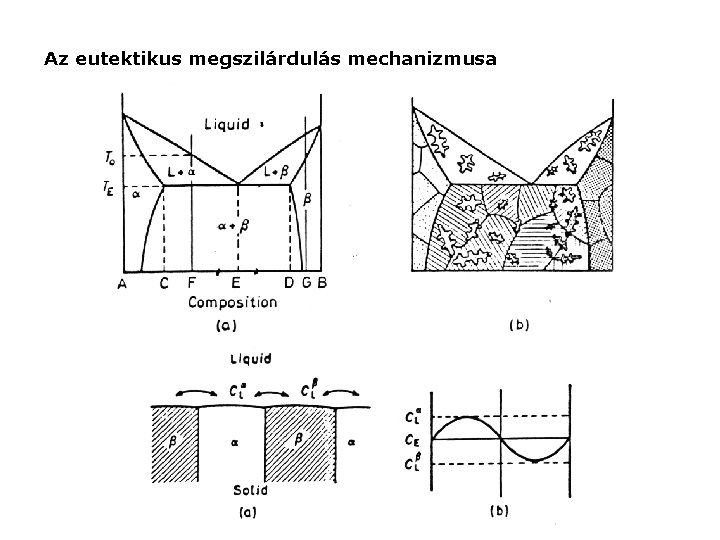
Az eutektikus megszilárdulás mechanizmusa

Eutektikus rendszer, amelyben a komponensek korlátoltan oldódnak egymásban

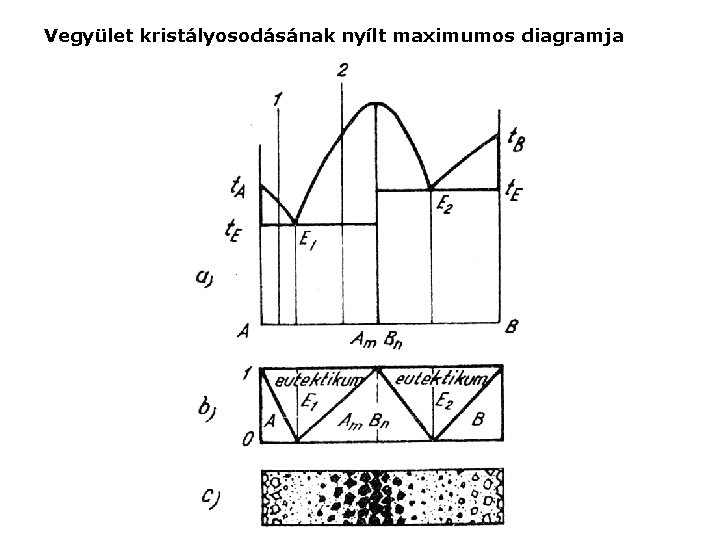
Vegyület kristályosodásának nyílt maximumos diagramja

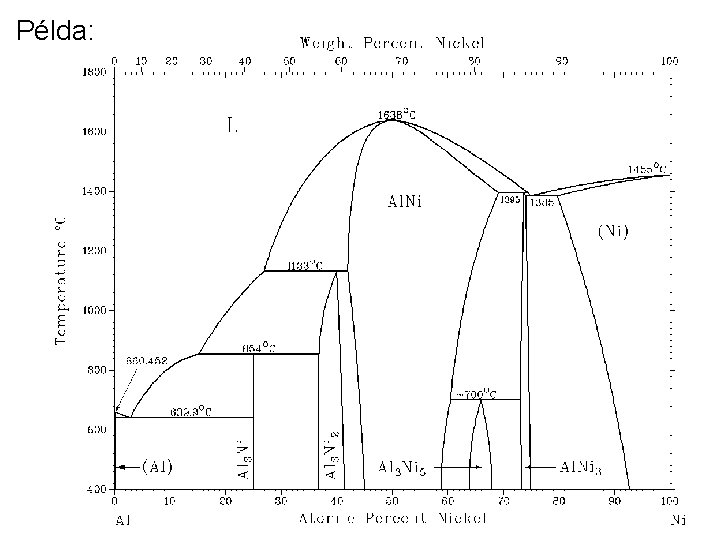
Példa: