1 LTOM Unitat 4 2 CONTINGUTS Antecedents histrics


































- Slides: 46

1 L’ÀTOM Unitat 4

2 CONTINGUTS • • Antecedents històrics. Partícules subatòmiques. • Model atòmic de Thomsom. • Els rajos X. • La radioactivitat. • Model atòmic de ‘Rutherford'. • Radiació electromagnètica. • Espectres atòmics. • Nombre atòmic i nombre màssic. • Càlcul de masses atòmiques a partir de % de cada isòtop. (Ë) • Càlcul del % de cada isòtop a partir de la massa atòmica. (Ë

3 ANTECEDENTS HISTÒRICS ü Leucip i Demòcrit. ü Proposen la “Discontinuïtat de la matèria ü Dalton. ü Formula la primera “Teoria atòmica ü Volta, Davy, Faraday, Berzelius. ü Descobreixen la “Naturalesa elèctrica de la matèria”. . ü Thomsom/Millikan ü Descobreixen l'electró.

4 MODELS ATÒMICS • Dalton. (No és pròpiament un model ) • Thomsom. – Proposa “càrregues negatives” incrustades en un nucli positiu. • Rutherford. – L'àtom està buit. La massa i la càrrega positiva està concentrada en el nucli. Fora estan els electrons negatius. . • Bohr. - Els electrons es situen per nivells

Descobriment de l'electró (1897). 5 • Al sotmetre a un gas a baixa pressió a un voltatge elevat, este emetia unes radiacions que es van conèixer com a raigs catòdics. • Es tractava de partícules que seguien una trajectòria rectilínia des del càtode fins l’ànode. Si s’hi aplicava un camp elèctric extern es desviaven cap a la zona positiva; per tant, es tractava de partícules negatives amb gran energia cinètica . • La relació càrrega/massa dels rajos catòdics és la mateixa independentment del gas que ompli el tub. • Es va suposar que estes partícules haurien d'estar en tots els àtoms. Thomson les va anomenar “electrons”.

Descobriment del protó (1914). 6 • Utilitzant càtodes perforats, en tubs de descàrrega a més dels rajos catòdics, Goldstein va descobrir uns rajos positius procedents de l'ànode que va anomenar rajos anòdics o canals. . • La relació càrrega/massa dels rajos canals no és la mateixa sinó que depèn del gas de què procedisca. En tot cas, la massa era molt superior a la dels electrons. • Es va anomenar “protó” a la partícula positiva procedent del gas més lleuger (hidrogen), la càrrega de la qual coincidia exactament amb la de l'electró. • Les càrregues d'altres rajos canals eren múltiples de la del protó, per la qual cosa va suposar que haurien de ser partícules amb uns quants protons units.

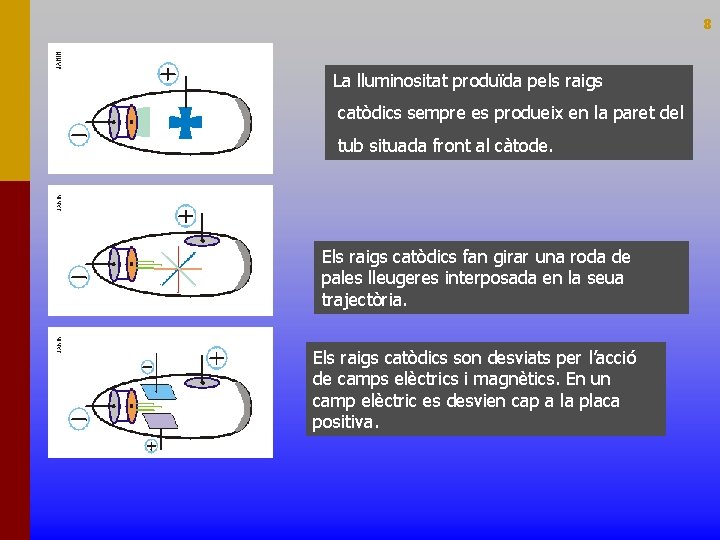
8 La lluminositat produïda pels raigs catòdics sempre es produeix en la paret del tub situada front al càtode. Els raigs catòdics fan girar una roda de pales lleugeres interposada en la seua trajectòria. Els raigs catòdics son desviats per l’acció de camps elèctrics i magnètics. En un camp elèctric es desvien cap a la placa positiva.

RAIGS CATÒDICS 9 Els raigs catòdics tenen les mateixes característiques independentment de la substancia gasosa que es trobi en el tub o del metall que forme els elèctrodes. Amb els seus experiments, Thomson demostrà que els raigs catòdics estaven formats per partícules negatives que haurien de formar part de tots els àtoms, àtoms que per tant no eren indivisibles com proposava el model de Dalton. Hui anomenem electrons a estes partícules negatives.

Descobriment del neutró (1932). 11 • Rutheford va observar que la suma de les masses dels protons i la dels electrons d'un determinat àtom no coincidia amb la massa atòmica pel que postulà l'existència d'una altra partícula que: • No tinguera càrrega elèctrica. • Posseïra una massa semblant a la del protó. • Estiguera situada en el nucli. • En les primeres reaccions nuclears Chadwick va detectar esta partícula i la va denominar “neutró”.

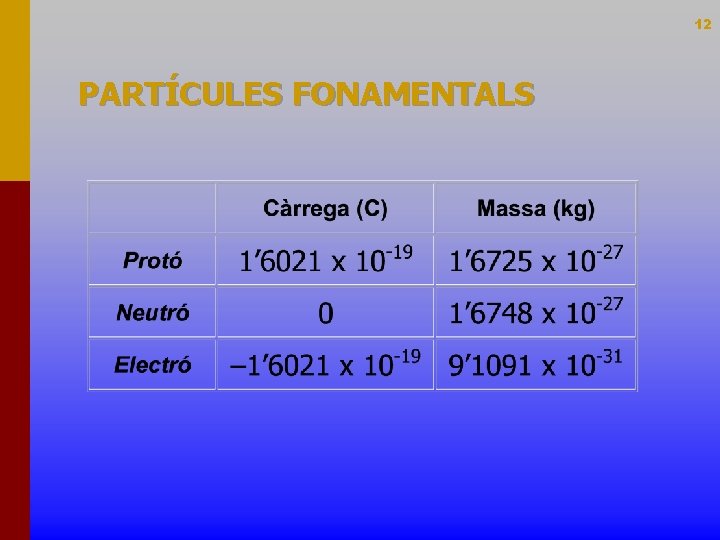
12 PARTÍCULES FONAMENTALS

13 Raigs X (Roëntgen 1895) • Es produïxen junt amb els rajos catòdics. • No posseïxen càrrega ja que no es desvien al passar per camps magnètics. • Tenen gran poder penetrant (travessen amb facilitat les vísceres, no així els ossos) i impressionen plaques fotogràfiques. • Viatgen a la velocitat de la llum. • Ionitzen els gasos.

14 RADIOACTIVITAT (Becquerel 1896) • Són molt ionitzants i penetrants. • Poden ser de diversos tipus: massa Són radiacions semblants als rajos X però emeses espontàniament per algunes substàncies (urani). – Rajos a (nuclis d'He: càrrega = +2; massa = 4 u) – Rajos b (són càrregues negatives procedents del nucli per descomposició d'un neutró en protó + electró). – Rajos g (radiacions electromagnètiques d'alta freqüència) penetració •

15 RADIACIÓ ELECTROMAGNÈTICA (Maxwell 1864). • L'energia despresa dels àtoms es transmet com a ones electromagnètiques (valors fluctuants del valor del camp elèctric i camp magnètic). • Es caracteritzen per una determinada longitud d'ona “ ” o per la seua freqüència “ ”. La relació entre ambdós ve donada per o bé com on c és la constant velocitat de la llum (c = 3· 108 m·s– 1). • La freqüència es mesura, per tant, en s– 1 (Herz) • No necessiten per a propagar-se medi material.

16 Tipus de radiacions electromagnètiques segons l. • Raigs g • Raigs X • Raigs UV • Radiació visible. • Raigs IR • Microones • Ones de ràdio: • Ones de radar • - Ones de TV. • - Ona ultracurta • - Ona curta. • - Ona mitjana. • - Ona llarga

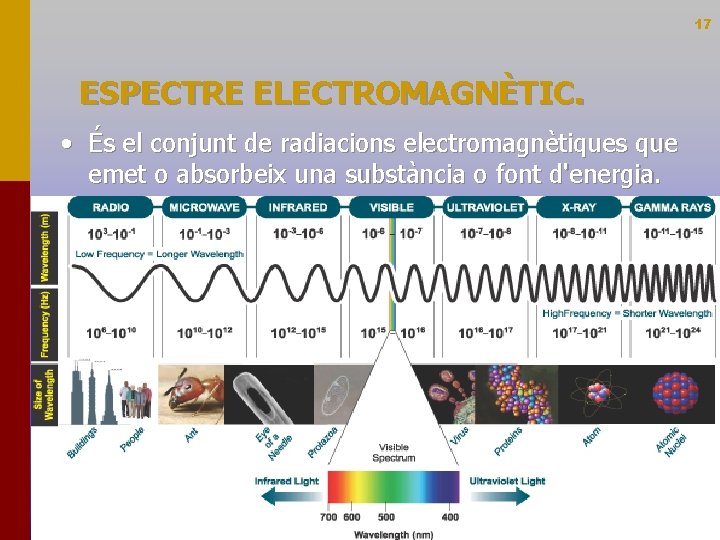
17 ESPECTRE ELECTROMAGNÈTIC. • És el conjunt de radiacions electromagnètiques que emet o absorbeix una substància o font d'energia.

Radiació electromagnètica (continuació). 18 • L'emissió d'energia augmenta amb la Temperatura. • L'energia està quantizada (com la matèria) (fórmula Planck) on “h” pren el valor: h = 6, 625 · 10– 34 J ·s. • La matèria també absorbeix quants d'energia (fotons). • La llum es comporta a vegades com onda (reflexió) i a vegades com a corpuscle (efecte fotoelèctric). • De Broglie estableix la dualitat ona-corpuscle.

19 Freqüència llindar • La freqüència mínima per a extraure un electró d'un à • Si es subministra una radiació de major freqüència, la

Exemple: Calcula l'energia de fotons de rajos X la longitud d'onda del qual és de 0, 6 nm. (h = 6, 625· 10– 34 J · s) c 3 · 108 m/s 17 s– 1 = ——————— = 5 · 10 0, 6 · 10– 9 m E = h · = = 6, 625 · 10– 34 J s · 5 · 1017 s– 1 = 33, 125 · 10– 17 J = 3´ 3125 · 10– 16 J 20

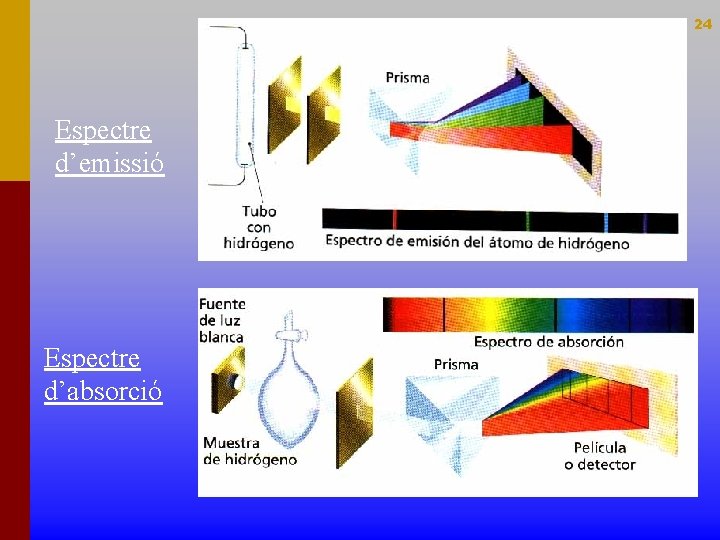
21 ESPECTRES ATÒMICS • És la imatge després de ser dispersada per un prisma del conjunt de radiacions que emet una substància. • L'espectre és característic d'una determinada substància i normalment serveix per identificar-la. • S'obté per mitjà de l'espectroscopi. • Pot ser: d'emissió i d'absorció

24 Espectre d’emissió Espectre d’absorció

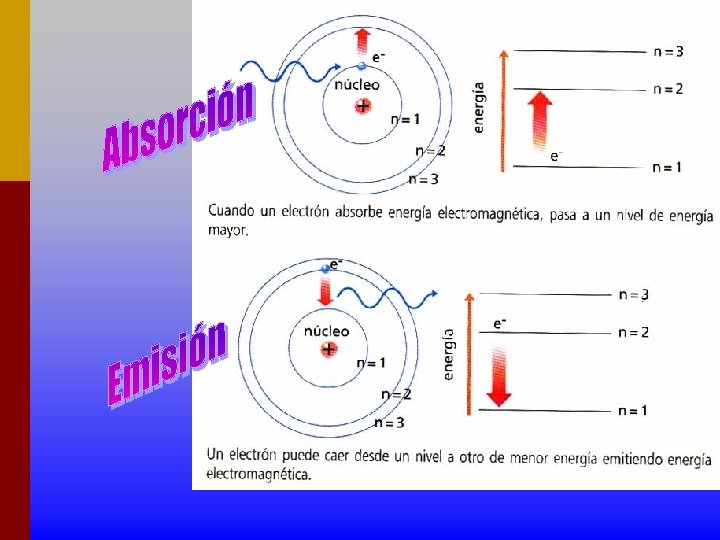
25 MODEL DE BOHR • Les òrbites que descriuen els electrons al volant del nucli són estacionàries, és a dir, l'electró hi gira sense emetre ni absorbir energia. A cada òrbita correspon una energia definida i igual a la que té l'electró quan hi és present. • L'emissió o l'absorció de radiació per un àtom va acompanyada de salts electrònics d'una òrbita a un altra d'energia diferent. La radiació emesa o absorbida té una freqüència f que verifica l'equació: E 2 - E 1 = hn On E 2 i E 1 representen les energies corresponents a les òrbites entre les quals es produeix la transmissió, i h és la constant de Planck. (h=6. 626· 10 -34 J·s) • Les lleis de la mecànica clàssica expliquen el caràcter circular de les òrbites electròniques, però no les transicions d'una òrbita a una altra. • 4. - No totes les òrbites circulars són permeses per un electró. Només ho són aquelles que compleixen la condició següents: • me·v·r = n· (h/2 p)

26

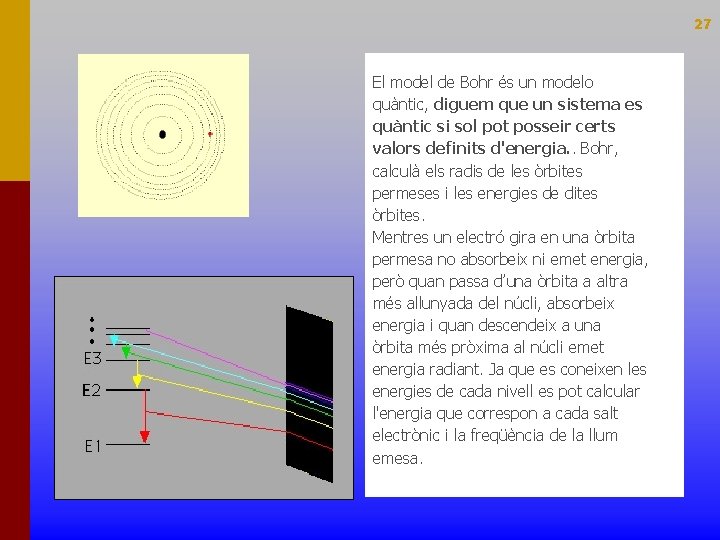
27 El model de Bohr és un modelo quàntic, diguem que un sistema es quàntic si sol pot posseir certs valors definits d'energia. . Bohr, calculà els radis de les òrbites permeses i les energies de dites òrbites. Mentres un electró gira en una òrbita permesa no absorbeix ni emet energia, però quan passa d’una òrbita a altra més allunyada del núcli, absorbeix energia i quan descendeix a una òrbita més pròxima al núcli emet energia radiant. Ja que es coneixen les energies de cada nivell es pot calcular l'energia que correspon a cada salt electrònic i la freqüència de la llum emesa.

28 Limitacions El model atòmic de Bohr explicava l’espectre atòmic del hidrogen ja que les freqüències teòriques calculades amb el model de Bohr coincidien amb les determinades experimentalment, però el model de Bohr fallava al intentar explicar els espectres dels àtoms polielectrònics i també amb el espectre de l’ hidrogen quan s’ utilitzaren espectroscopis més potents. Els postulats de Bohr a més suposaven una mescla un tant confusa de mecànica clàssica i mecànica quàntica. http: //www. maloka. org/f 2000/applets/a 2. html

Principi de incertesa (Heisenberg). 29 • “Es impossible conèixer simultàniament la posició i la quantitat de moviment d’una partícula” • Així: on x és la incertesa en la posició i p la incertesa en la quantitat de moviment. • Es substitueix la idea d'òrbita per la d’orbital, com zona on la probabilitat de trobar a l’electró és màxima.

Model quàntic ondulatori actual 30 . Les equacions del model mecano - quàntic descriuen el comportament dels electrons dins de l'àtom, i recullen el seu caràcter ondulatori i la impossibilitat de predir les trajectòries exactes Així establiren el concepte de orbital regió de l'espai de l'àtom on la probabilitat de trobar un electró es molt gran. Característiques dels orbitals: • L'energia està quantizada. • El que marca la diferencia amb el model de Böhr és que este model no determina la posició exacta de l’electró, sinó la major o menor probabilitat. • Dins de l'àtom, l’electró es interpreta com un núvol de carrega negativa, i dins d’este núvol, en el lloc en el que la densitat siga major, la probabilitat de trobar un electró també serà major. Aspectes característics: • Dualitat ona-partícula: Broglie proposà que les partícules materials tenen propietats ondulatòries, i que tota partícula en moviment porta una ona associada. • Principi de indeterminació: Heisenberg digué que era impossible situar a un electró en un punt exacte de l’espai.

31 Model mecano-quàntic ( àtom d'Hidrogen) • El model de Bohr indicava posició i velocitat dels electrons (incompatible amb principi de incertesa de la mecànica quàntica). • Schrödinger (1926) proposà una equació d’ona per l’electró de H, en les solucions de la mateixa (valores energètics permesos) apareixien precisament els nombres quàntics n, l i m.

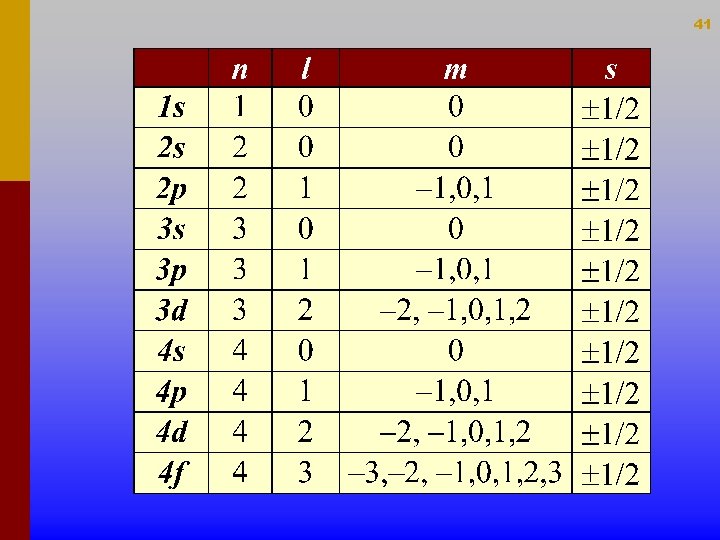
Actual teoria atòmica Nombres quàntics i Nivells d'energia. Un electró que es mou al voltant del nucli pot considerar-se lligat a ell i podem descriure el seu moviment ondulatori amb una equació d’ona. Amb esta idea, Schrödinger realitzà un estudi matemàtic del comportament de l’electró en l'àtom i obtingué una expressió, coneguda com equació de Schrödinger. Per a que l'equació de Schrödinger tinga significat físic és necessari imposar-li unes restriccions que són conegudes com nombres quàntics, que es simbolitzen de la mateixa forma que els utilitzats en el model atòmic de Bohr 32

33 n : nombre quàntic principal indica el nivell energètic l : nombre quàntic del moment angular orbital indica la forma m : nombre quàntic magnètic indica l’orientació s : nombre quàntic spin electrònic indica el sentit de gir del e- Estos nombres quàntics sols poden tenir certs valors permesos: Per a n : nombres enters 1, 2, 3, … Per a l : nombres enters de 0 fins (n-1) Per a m : tots els nombres enters entre +l i -l inclòs el 0 Per a s : sols els nombres fraccionaris -1/2 y +1/2

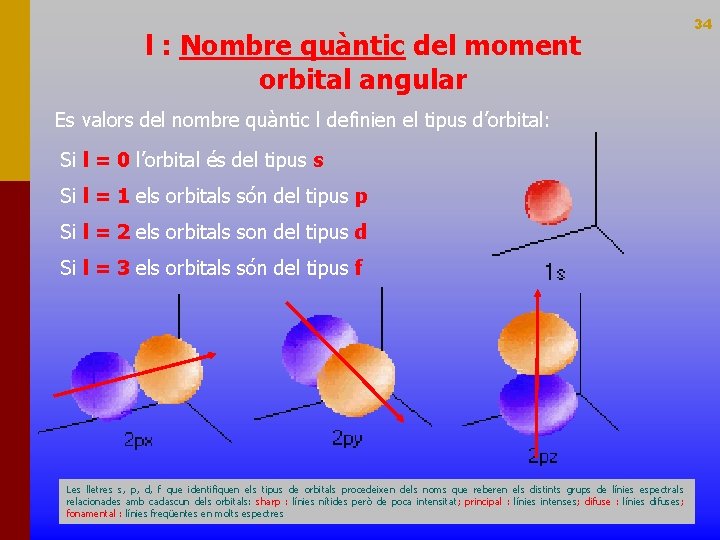
l : Nombre quàntic del moment orbital angular Es valors del nombre quàntic l definien el tipus d’orbital: Si l = 0 l’orbital és del tipus s Si l = 1 els orbitals són del tipus p Si l = 2 els orbitals son del tipus d Si l = 3 els orbitals són del tipus f Les lletres s, p, d, f que identifiquen els tipus de orbitals procedeixen dels noms que reberen els distints grups de línies espectrals relacionades amb cadascun dels orbitals: sharp : línies nítides però de poca intensitat; principal : línies intenses; difuse : línies difuses; fonamental : línies freqüentes en molts espectres 34

35 Orbitals atòmics. • Els electrons es situen en orbitals, que poden estar ocupats por dos d’ells: • 1ª capa: 1 orb. “s” (2 e–) • 2ª capa: 1 orb. “s” (2 e–) + 3 orb. “p” (6 e–) • 3ª capa: 1 orb. “s” (2 e–) + 3 orb. “p” (6 e–) 5 orb. “d” (10 e–) • 4ª capa: 1 orb. “s” (2 e–) + 3 orb. “p” (6 e–) 5 orb. “d” (10 e–) + 7 orb. “f” (14 e–) • Y així successivament…

Orbitals tipus s Els valors del nombre quàntic n indiquen el tamany de l’orbital, es a dir la seua proximitat al nucli, i el nivell energètic. Si n = 1 el nombre quàntic l sols pot tenir el valor 0 és a dir sols és possible trobar un orbital en el primer nivell energètic en el que pot haver-hi fins dos electrons (un amb spin +1/2 i l’altre amb spin -1/2). Este orbital, d’aparença esfèrica, rep el nom de 1 s 36

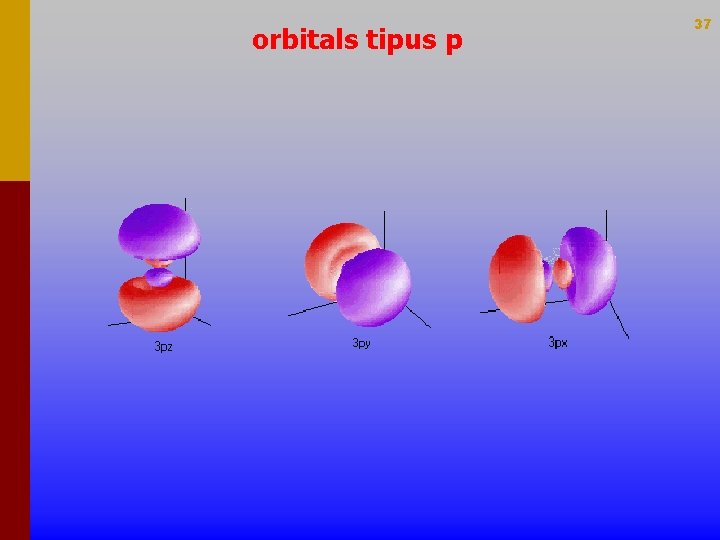
orbitals tipus p 37

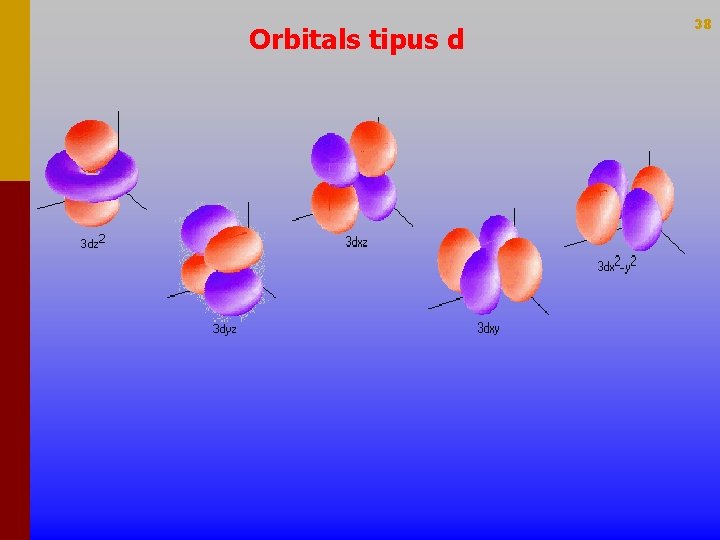
Orbitals tipus d 38

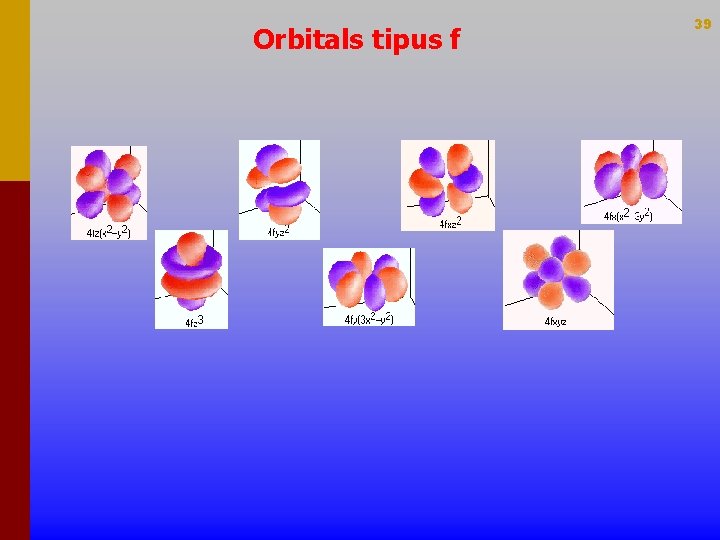
Orbitals tipus f 39

40 Nombres quàntics. • Cada electró ve determinat per 4 nombres quàntics: n, l, m i s (els tres primers determinen cada orbital, i el quart “s” serveix per diferenciar a cada un dels dos e– que el composen). • Els valors d'estos son els següents: vn = 1, 2, 3, 4, . . . (nº de capa) vl = 0, 1, 2, . . . (n – 1) (tipus d’orbital) vm = – l, . . . , 0, . . . +l (orientació orbital) vs = – ½ , + ½ (spín)

41

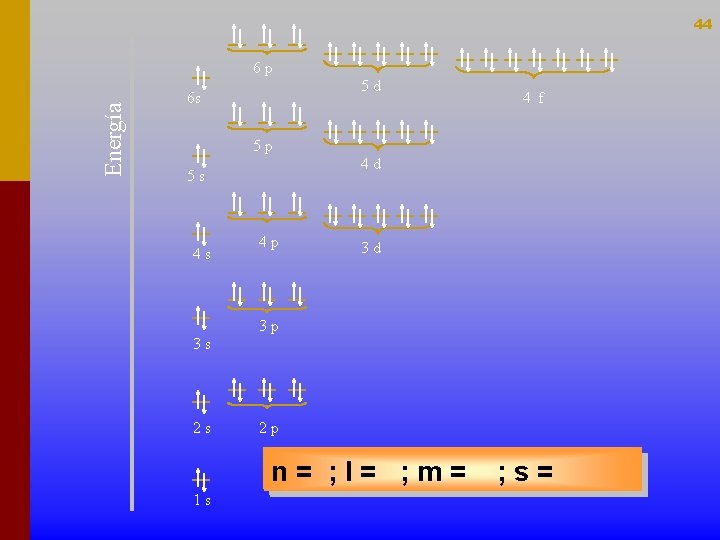
42 Col·locació d’electrons en un diagrama d’energia. Es segueixen los següents principis: • Principi de mínima energia (Aufbau) • Principi de màxima multiplicitat (regla de Hund) • Una vegada col·locats es compleix el principi d’exclusió de Pauli.

43 S’anomena CONFIGURACIÓ ELECTRÒNICA d’un àtom a la distribució dels electrons en els diferents orbitals , tenint en compte que es van omplint en ordre creixent d'energia i situant 2 electrons com a màxim en cada orbital. 1 s 2 s 2 p 3 s 3 p 3 d 4 s 4 d 4 p 4 f 5 s 5 p 5 d 5 f 6 s 6 p 6 d 7 s 7 p LA TAULA PERIÒDICA S’ORDENA SEGONS EL NOMBRE ATÒMIC, com és el nombre de protons però coincideix amb el de electrons quan l'àtom és neutre, la taula periòdica queda ordenada segons les configuracions electròniques dels diferents elements.

44 Energía 6 p 5 d 6 s 4 f 5 p 4 d 5 s 4 s 4 p 3 d 3 p 3 s 2 s 2 p n = 3; m== – 1; 2; 4; ; ll== 2; 0; 1; ; m 0; ; 2; + 1; ss == –+ + –½ ½ 1 s

45 Nombre atòmic i nombre màssic. • Nombre atómic (Z): és el nombre de protons que té un àtom. Es distint per cada element. • Isòtops: són àtoms del mateix element que difereixen en el nº de neutrons (n). • Nombre màssic (A): és la suma de protons i neutrons d’un nucli atòmic. (A = Z + n) A 37 Símbol. Exemple: Cl Z 17

46 Massa atòmica • És la mitjana ponderada (tenint en compte el % que hi ha de cadascun) de la massa de cadascun dels isòtops d’un element. • Es mesura en UMAs (u) (dotzeava part de la massa del 12 C. • 1 u = 1, 66 · 10– 24 g (1/6, 023 · 1023) = 1, 66 · 10– 27 kg

Example: El neó és un element químic de 47 Z=10. En la naturalesa es troben tres isòtops de masses atòmiques 19, 99, 20, 99 i 21, 99 u. Si les proporcions respectives són del 90, 92 %. 0, 26 % i 8, 82 % calcula la massa atòmica en UMAs i kg. (90, 92 · 19, 99 +0, 26 · 20, 99 + 8, 82 · 21, 99)u ———————————— = 100 = 20, 17 u · 1, 66 · 10– 27 kg/u = = 3, 348 · 10– 26 kg

Exemple: La massa atòmica del clor és 35, 45 u. Si té dos isòtops, 35 Cl i 37 Cl, de masses 34, 97 i 36, 93 u. Calcula el % de cadascun d’ells. 34, 97 u x +36, 93 · (100 – x) 35, 45 u = ———————— = 100 Aïllant X = 75, 51 % del isòtop 35 Cl 24, 49 % del isòtop 37 Cl 48

Massa molecular 49 • És la suma de les masses atòmiques. Exemple: Calcula la massa molecular del carbonat de calci (Ca. CO 3 ). Expressa la massa molecular en unitats de massa atòmica i en unitats S. I. ¿En què unitats s'expressa la massa molecular relativa? Ar(Ca) =40, 08 u. Ar(C) =12, 011 u. Ar(O)=15, 9994 u. 1 u = 1, 6605 · 10– 27 kg. • Mr (Ca. CO 3)= 1 · Ar (Ca) + 1 · Ar (C) + 3 · Ar (O) = = 40, 08 u +12, 011 u + 3 · 15, 9994 u = • = 100, 09 u • 100, 09 u ·(1, 6605 · 10– 27 kg/u) = kg/u) 1, 6612 · 10– 25 kg

Exercici: ¿ Quantes molècules de Cl 2 hi ha en 50 12 g de clor molecular? . Si totes les molècules de Cl 2 es dissociaren per donar àtoms de clor, ¿ quants àtoms de clor atòmic s'obtindran? La massa molecular de Cl 2 és 35, 45 u · 2 =70, 9 u. Doncs un mol de Cl 2 són 70, 9 g. En els 12 g de Cl 2 hi han: m 12 g n = = = 0, 169 mols de Cl 2 70, 9 g/mol M Tenint en compte que en un mol hi ha 6, 02 · 1023 molèc. 0, 169 moles contenen: 0, 169 moles · 6, 02 · 1023 molècules/mol = = 1, 017 · 1023 molècules Cl 2 2 át. Cl 1, 017· 1023 molèc. Cl 2 · = 2, 034· 1023 át. Cl molèc. Cl 2