VY32INOVACE05 16 CHEMICK ROVNOVHA U ZVRATNCH REAKC I








- Slides: 9

VY_32_INOVACE_05 -16 CHEMICKÁ ROVNOVÁHA U ZVRATNÝCH REAKCÍ I Zvratná reakce, uzavřená soustava, definice chemické rovnováhy, rovnovážná konstanta.

TYPY CHEMICKÝCH ROVNOVÁH o acidobazické rovnováhy – chemická rovnováha se ustavuje v acidobazické zvratné reakci o redoxní rovnováhy – chemická rovnováha se ustavuje v redoxní reakci o srážecí rovnováhy – chemická rovnováha se ustavuje v srážecí reakci o komplexotvorné rovnováhy – chemická rovnováha se ustavuje v komplexotvorné reakci

CHEMICKÁ ROVNOVÁHA VE ZVRATNÉ REAKCI o chemické reakce podle směru dělíme na přímé a zvratné (skládá se z přímé a zpětné reakce) o máme zvratnou reakci: a. A + b. B 3 H 2 + N 2 c. C + 2 NH 3 d. D

rychlost ustavení chemické rovnováhy závisí na podmínkách (koncentrace látek, teplota, tlak) v uzavřené soustavě probíhá přímá reakce, má reakční rychlost v 1, která se mění, v soustavě také probíhá zpětná reakce, má reakční rychlost v 2, která se mění

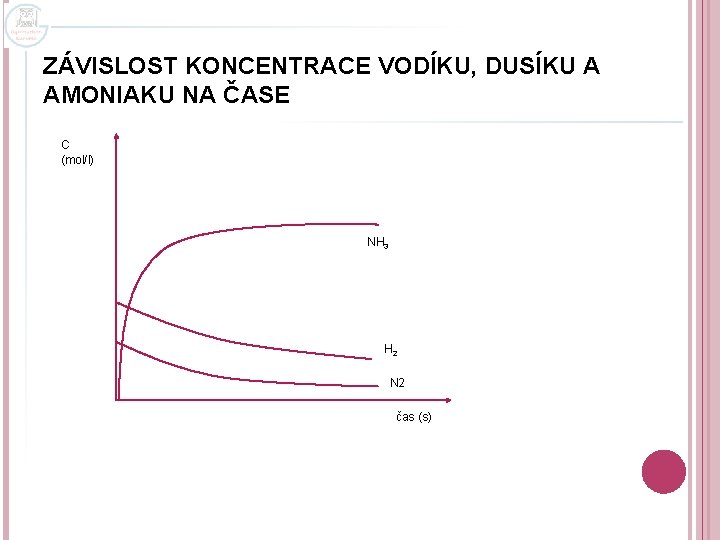
VZNIK CHEMICKÉ ROVNOVÁHY o po určité době se rychlosti obou reakcí vyrovnají, reakce budou probíhat dál, ale molární koncentrace reaktantů a produktů (vodíku, dusíku i amoniaku) se nebude měnit o v soustavě vznikne chemická rovnováha, kterou charakterizují: o o rovnovážná konstanta Kc rovnovážné molární koncentrace reaktantů a produktů

ZÁVISLOST KONCENTRACE VODÍKU, DUSÍKU A AMONIAKU NA ČASE C (mol/l) NH 3 H 2 N 2 čas (s)

VZTAH PRO ROVNOVÁŽNOU KONSTANTU KC o o Kc = C c. D d / A a. B b C , D - rovnovážné molární koncentrace produktů A , B - rovnovážné molární koncentrace reaktantů a, b, c, d – stechiometrické koeficienty reaktantů a produktů

o hodnota rovnovážné konstanty Kc je konstantní při určité teplotě o rovnovážnou konstantu Kc pro různé zvratné reakce nalezneme v tabulkách a lze ji vypočítat

DĚKUJI ZA POZORNOST. Autor DUM: Mgr. Kateřina Kleslová