Tudomnyos kutatsmdszertani elemzsi s kzlsi ismeretek modul Gazdlkodsi












- Slides: 15

Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI MÉRNÖKI MSc TERMÉSZETVÉDELMI MÉRNÖKI MSc KÖRNYEZETGAZDÁLKODÁSI MÉRNÖKI MSc 1

Atomabszorpciós spektroszkópia 80. Lecke 2

Atomspektroszkópiás módszerek • Az atomspektroszkópiás módszerek 70 -80 elem minőségi és nagy analitikai érzékenységű mennyiségi meghatározására alkalmas műszeres analitikai eljárások. • Közös bennük, hogy a mintában jelenlevő vizsgálni kívánt elemet szabad atomokká alakítjuk. A szabad atomok létrehozhatók különböző hőmérsékletű lángokkal, elektromos ívvel, szikrával, egyenáramú, induktív vagy kapacitív csatolású plazmával illetve nagy hőmérsékletű grafitcsőben. • Aszerint, hogy a szabad atomok minőségéről és mennyiségéről hogyan szerzünk adatokat, beszélünk – atomemissziós (AES), – atomabszorpciós (AAS) és – atomfluoreszcens (AFS) módszerekről. http: //www. tankonyvtar. hu/kemia/atomabszorpcios-080904 -6 3

A mérés elve • Az atomemissziós spektrometriában termikus vagy elektromos energia segítségével a vizsgált elem gerjesztett atomjait (gerjesztet ionjait) állítjuk elő. E gerjesztett atomok által kisugárzott fény színképéből a jellemző hullámhosszak alapján állapítjuk meg az adott elem minőségét (minőségi elemzés). Az elem adott hullámhosszúságú színképvonalának relatív intenzitásából (Irel) pedig annak (c) koncentrációját határozzuk meg (mennyiségi elemzés). A mért jel és a koncentráció közötti általános összefüggést a Scheibe. Lomakin egyenlet írja le, ahol K állandó, n pedig anyagszerkezeti tényező, amelynek az értéke 0. 5 – 1. 5 közé esik. n Irel = Kc 4

Atomabszorpciós spektrometria • Az atomabszorpciós spektrometriában a vizsgálandó elemet elsősorban termikus energia alkalmazásával alapállapotú szabad atomokká alakítjuk. • Az így létrehozott atomgőzön a vizsgálandó elemre jellemző hosszúságú fénynyalábot bocsátunk keresztül és mérjük a fényintenzitás csökkenését, amely a későbbiekben részletezett módon, a Lambert-Beer törvény alapján egyértelmű kapcsolatban áll a fényelést okozó atomok koncentrációjával. http: //www. tankonyvtar. hu/kemia/atomabszorpcios-080904 -1 5

Atomfluoreszcens spektrometria • Az atomfluoreszcens spektrometriában ugyancsak alapállapotú szabad atomokat állítunk elő. • Ezeket az atomokat azonban a vizsgált elemre jellemző hullámhosszúságú fénnyel gerjesztjük, majd e fénnyel gerjesztett atomok által kibocsátott fluoreszcens fény relatív intenzitását (IF) mérjük, amely az alábbi egyenlet szerint arányos az adott elem c koncentrációjával. http: //www. tankonyvtar. hu/kemia/atomabszorpcios-080904 -1 6

Fluoreszcens fény relatív intenzitása (IF) Io - a megvilágító fény intenzitása ω - a gerjesztő fénynyaláb átmérője a - abszorpciós együttható c - a vizsgált elem térfogategységben levő alapállapotú atomjainak a száma l - az abszorbeálódó fénynyaláb úthossza az atomizáló térben φ - fluoreszcens hatásfok Ω - az a térszög, amelyen belül a fluoreszcens fény detektálása történik http: //www. tankonyvtar. hu/kemia/atomabszorpcios-080904 -1 7

Az atom szerkezete és az atomszínképek keletkezése • Annak idején az elemek emissziós atomszínképe jelentette az alapot az atomok elektronszerkezetének megfejtéséhez, az elektronhéjak felépítéséhez. • A Bohr-féle atommodell szerint az elektronok a nekik megfelelő alappályákon fény kibocsátás nélkül keringenek. Az ilyen energiaállapotú atomok tekinthetők alapállapotúaknak. Ha legalább egy elektron magasabb elektronpályára kerül, majd onnan egy alacsonyabbra, vagy az alappályára visszalép, a pályák közötti energiakülönbségnek megfelelő energiájú (rezgésszámú, hullámhosszúságú) fotont, fotonokat bocsát ki. • Bármelyik pályáról bármelyikre lép vissza az elektron, az mindig egy adott hullámhosszúságú színképvonal keletkezésével jár. http: //www. tankonyvtar. hu/kemia/atomabszorpcios-080904 -1 8

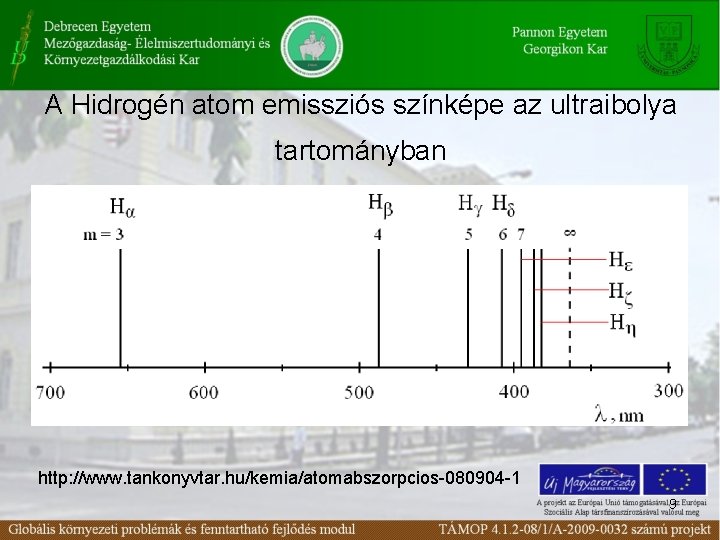
A Hidrogén atom emissziós színképe az ultraibolya tartományban http: //www. tankonyvtar. hu/kemia/atomabszorpcios-080904 -1 9

Rydberg-állandó • Legegyszerűbb a hidrogén színképe, a látható tartományban mindössze négy vonallal jelenik meg, de az ultraibolya tartományban a sorozat további, egyre sűrűsödő vonalai figyelhetők meg. • 1885 -ben Balmer felfedezte, hogy az alábbi képlettel a vonalak ν* hullámszámai igen pontosan kifejezhetők. ahol R = 109 678 cm─1 és n = 3, 4, 5, …… ∞. Az R állandót (a svéd fizikus neve után) Rydberg-állandónak nevezzük http: //www. tankonyvtar. hu/kemia/atomabszorpcios-080904 -1 10

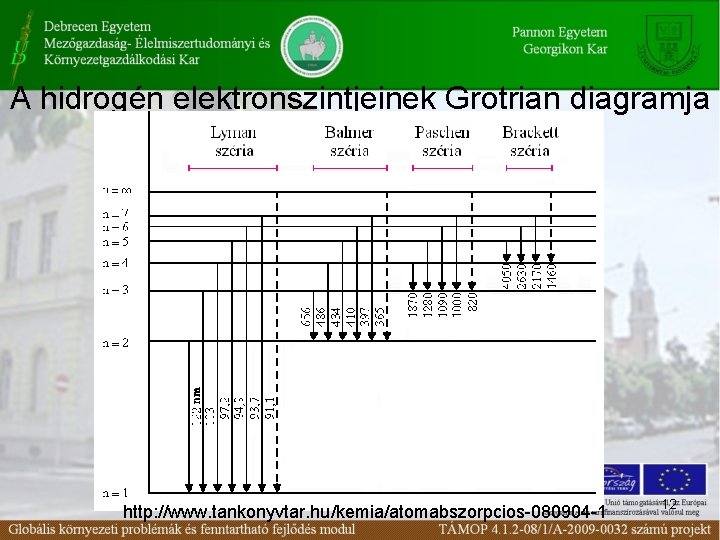
H színképszériák A hidrogén színképének későbbi, részletesebb tanulmányozása a távoli ultraibolya és az infravörös tartományban további színképszériák felfedezéséhez vezetett. Ezeket a szériákat felfedezőikről Lyman-, Paschen, Bracket- és Pfund-szériának nevezték el. Utóbbi sorozatok hullámszámának kiszámításához az összefüggést annyiban kell változtatni, hogy az első tagban a 22 helyett 12, 32, 42, 52 értékeket kell helyettesíteni. Így a hidrogén spektrumát kifejező általános képlet: Az n>m. Az m számok (1– 5) azt fejezik ki, hogy az adott szériánál az elektron bármely magasabb pályáról melyik pályára ugrik vissza. A Balmer-szériánál, például, mindig a 2. pályára. Mint látható, a legegyszerűbb atom is nagyszámú színképvonallal jellemezhető 11 http: //www. tankonyvtar. hu/kemia/atomabszorpcios-080904 -1

A hidrogén elektronszintjeinek Grotrian diagramja http: //www. tankonyvtar. hu/kemia/atomabszorpcios-080904 -1 12

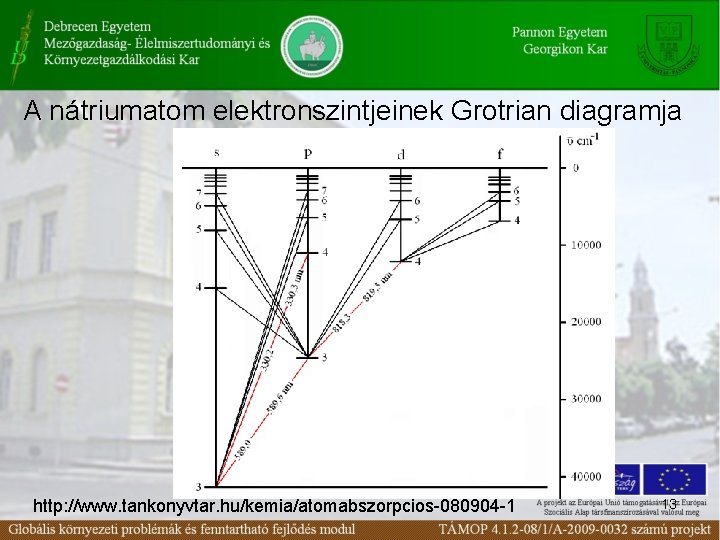
A nátriumatom elektronszintjeinek Grotrian diagramja http: //www. tankonyvtar. hu/kemia/atomabszorpcios-080904 -1 13

Kérdések a leckéhez • Atomspektroszkópiás módszerek • A mérés elve • Az atom szerkezete és az atomszínképek keletkezése 14

KÖSZÖNÖM FIGYELMÜKET! 15
 Munkajogi alapismeretek
Munkajogi alapismeretek Elsőáldozási ismeretek
Elsőáldozási ismeretek Modul animasi
Modul animasi Aritmatika sosial kelas 7 semester 2
Aritmatika sosial kelas 7 semester 2 Morov krug napona
Morov krug napona Kohesi functional
Kohesi functional Pengendalian pelaksanaan kegiatan
Pengendalian pelaksanaan kegiatan Modul studi kelayakan bisnis
Modul studi kelayakan bisnis Materi demokrasi sd
Materi demokrasi sd Contoh petunjuk penggunaan modul
Contoh petunjuk penggunaan modul Kemahiran insaniah
Kemahiran insaniah Prosemiks
Prosemiks Pendidikan anak tunadaksa dan tunalaras
Pendidikan anak tunadaksa dan tunalaras Modul logistik
Modul logistik Variatia orei pe glob este o consecinta a miscarii de
Variatia orei pe glob este o consecinta a miscarii de Videre10
Videre10





























