termochimica Grandezze termodinamiche Energia interna di un sistema



- Slides: 7

termochimica

Grandezze termodinamiche • Energia interna di un sistema (cinetica, potenziale) di tutti i suoi costituenti • Entalpia H • Entropia S • Energia libera G • Spontaneità di una reazione chimica DG < 0

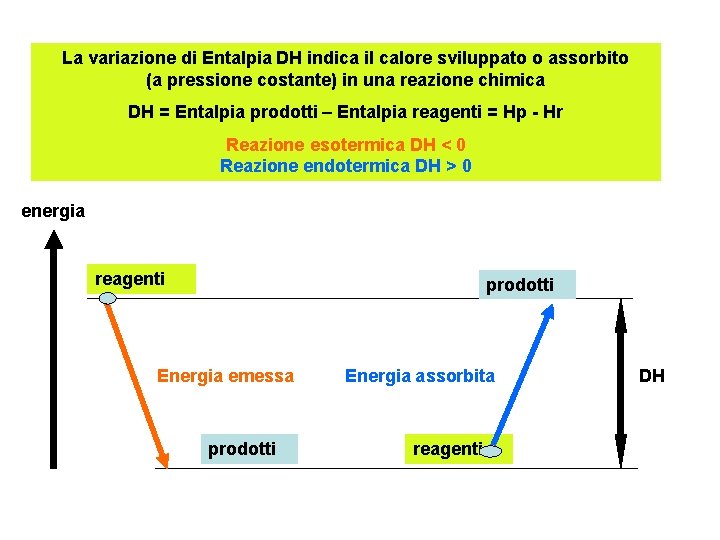
La variazione di Entalpia DH indica il calore sviluppato o assorbito (a pressione costante) in una reazione chimica DH = Entalpia prodotti – Entalpia reagenti = Hp - Hr Reazione esotermica DH < 0 Reazione endotermica DH > 0 energia reagenti prodotti Energia emessa prodotti Energia assorbita reagenti DH

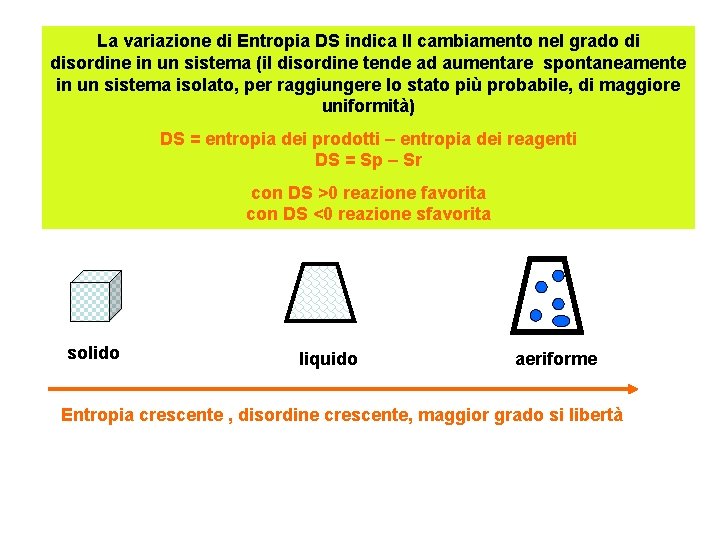
La variazione di Entropia DS indica ll cambiamento nel grado di disordine in un sistema (il disordine tende ad aumentare spontaneamente in un sistema isolato, per raggiungere lo stato più probabile, di maggiore uniformità) DS = entropia dei prodotti – entropia dei reagenti DS = Sp – Sr con DS >0 reazione favorita con DS <0 reazione sfavorita solido liquido aeriforme Entropia crescente , disordine crescente, maggior grado si libertà

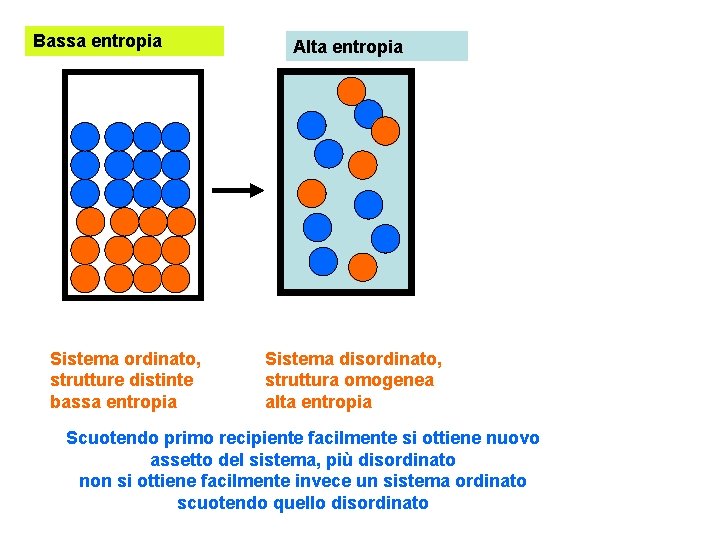
Bassa entropia Sistema ordinato, strutture distinte bassa entropia Alta entropia Sistema disordinato, struttura omogenea alta entropia Scuotendo primo recipiente facilmente si ottiene nuovo assetto del sistema, più disordinato non si ottiene facilmente invece un sistema ordinato scuotendo quello disordinato

La variazione di Energia libera DG (G = H – TS ) DG = DH –TDS può fornire indicazioni sulla spontaneità di una reazione A pressione e temperatura costanti un processo avviene spontaneamente se DG < 0 Se DH < 0 la reazione sarebbe spontanea se DS > 0 la reazione sarebbe spontanea possibili valori di DG = DH – TDS in funzione di DH, DS, T DH < 0 e DS> 0 …. . DG = DH – TDS < 0 avviene DH > 0 e DS< 0……. DG = DH – TDS > non avviene DH < 0 e DS< 0 ……DG = DH – TDS ? dipende dal valore di T DH > 0 e DS > 0……DG = DH –TDS ? dipende dal valore di T DH =-100 e DS> 10 …. . DG = -100 – 10*10 = -200 <0 DH =100 e DS< -10……. DG =100 – 10*(-10) =200 >0 DH =-100 e DS< -10 ……DG = -100 – T(-10) =-100 -5(-10)=-50<0 DH =-100 e DS< -10 ……DG = -100 – T(-10) =-100 -20(-10)=100>0 DH =100 e DS > 10……DG = 100 –T(10) = 100 -20*(10)=-100 <0 DH =100 e DS > 10……DG = 100 –T(10) = 100 -5*(10)=50 >0

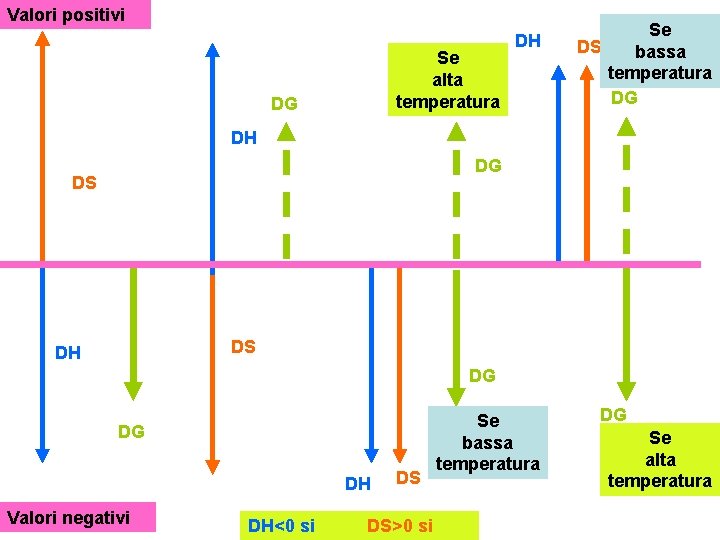
Valori positivi Se alta temperatura DG DH Se DS bassa temperatura DG DH DG DS DS DH DG DG DH Valori negativi DH<0 si DS DS>0 si Se bassa temperatura DG Se alta temperatura












