Struttura generale di un amminoacido Questa struttura comune



- Slides: 11

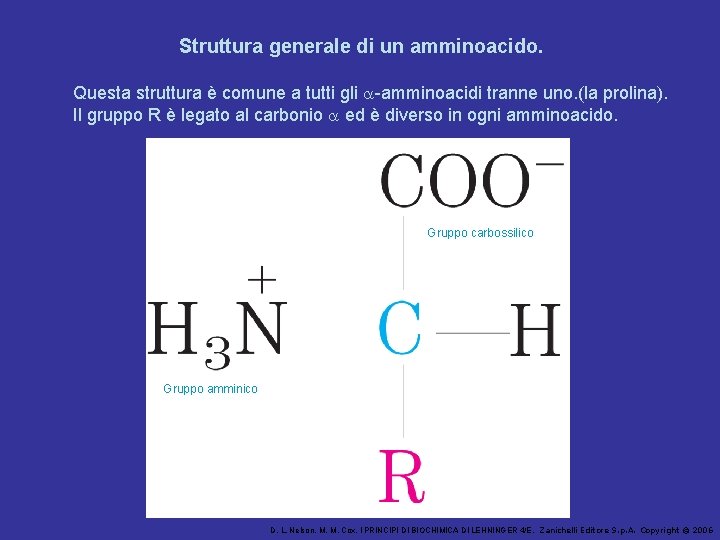
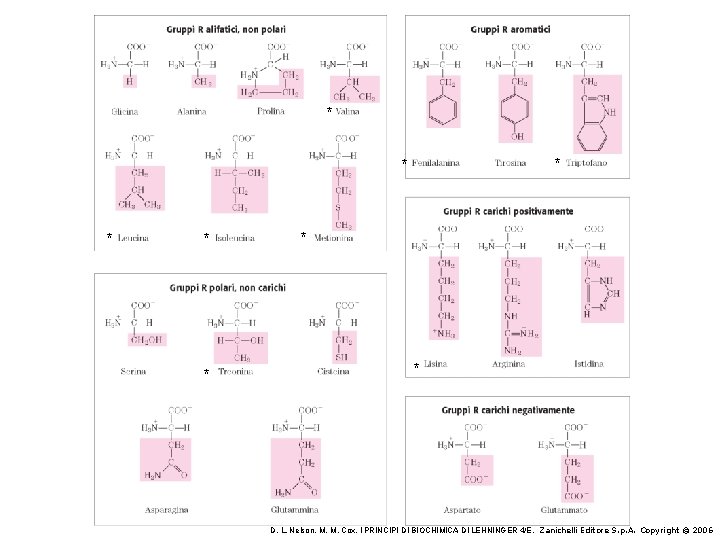
Struttura generale di un amminoacido. Questa struttura è comune a tutti gli a-amminoacidi tranne uno. (la prolina). Il gruppo R è legato al carbonio a ed è diverso in ogni amminoacido. Gruppo carbossilico Gruppo amminico D. L. Nelson, M. M. Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER 4/E, Zanichelli Editore S. p. A. Copyright © 2006

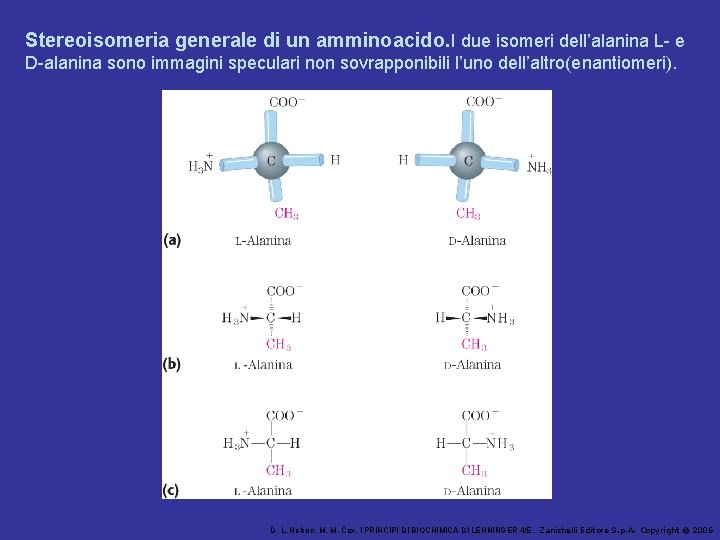
Stereoisomeria generale di un amminoacido. I due isomeri dell’alanina L- e D-alanina sono immagini speculari non sovrapponibili l’uno dell’altro(enantiomeri). D. L. Nelson, M. M. Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER 4/E, Zanichelli Editore S. p. A. Copyright © 2006

Relazioni steriche tra gli stereoisomeri dell’alanina e la configurazione assoluta della D- e della L- gliceraldeide. D. L. Nelson, M. M. Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER 4/E, Zanichelli Editore S. p. A. Copyright © 2006

* * * * D. L. Nelson, M. M. Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER 4/E, Zanichelli Editore S. p. A. Copyright © 2006

D. L. Nelson, M. M. Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER 4/E, Zanichelli Editore S. p. A. Copyright © 2006

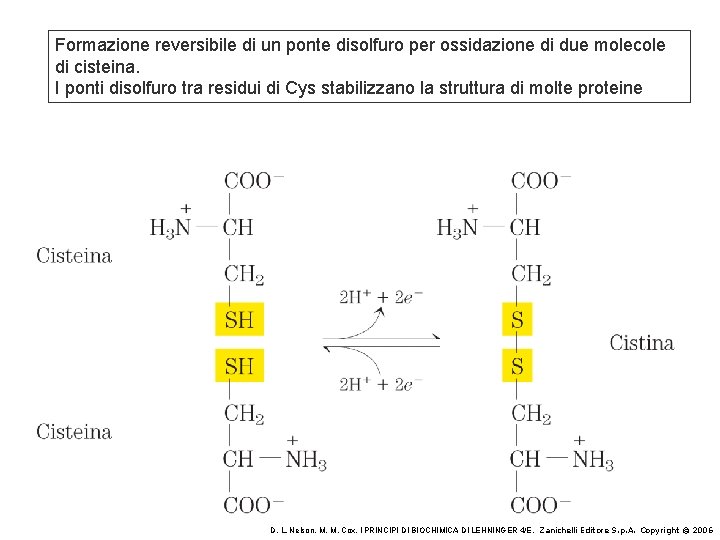
Formazione reversibile di un ponte disolfuro per ossidazione di due molecole di cisteina. I ponti disolfuro tra residui di Cys stabilizzano la struttura di molte proteine D. L. Nelson, M. M. Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER 4/E, Zanichelli Editore S. p. A. Copyright © 2006

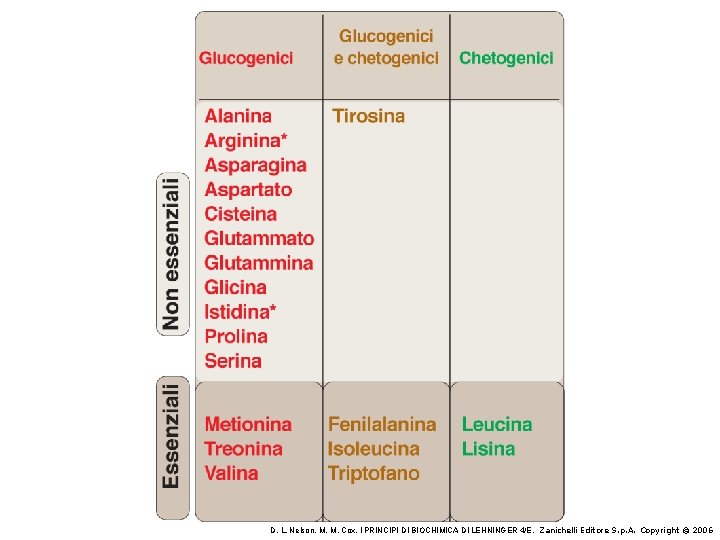
Amminoacidi non standard. Tutti derivano da amminoacidi standard. I gruppi funzionali extra sono mostrati in rosso D. L. Nelson, M. M. Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER 4/E, Zanichelli Editore S. p. A. Copyright © 2006

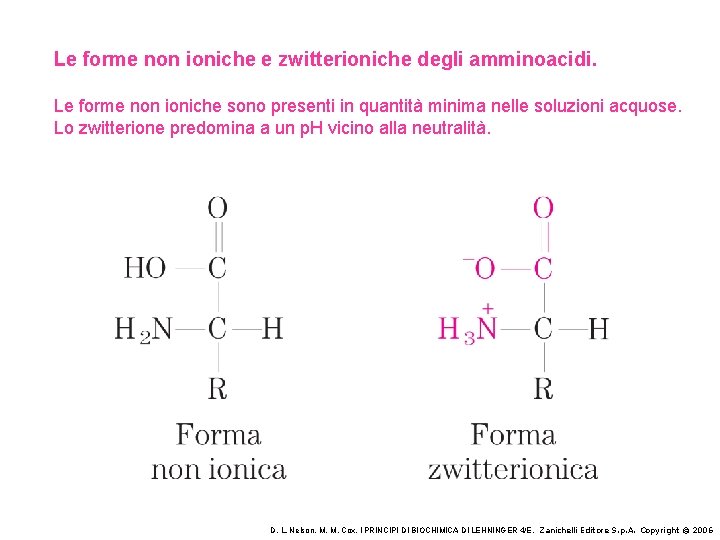
Le forme non ioniche e zwitterioniche degli amminoacidi. Le forme non ioniche sono presenti in quantità minima nelle soluzioni acquose. Lo zwitterione predomina a un p. H vicino alla neutralità. D. L. Nelson, M. M. Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER 4/E, Zanichelli Editore S. p. A. Copyright © 2006

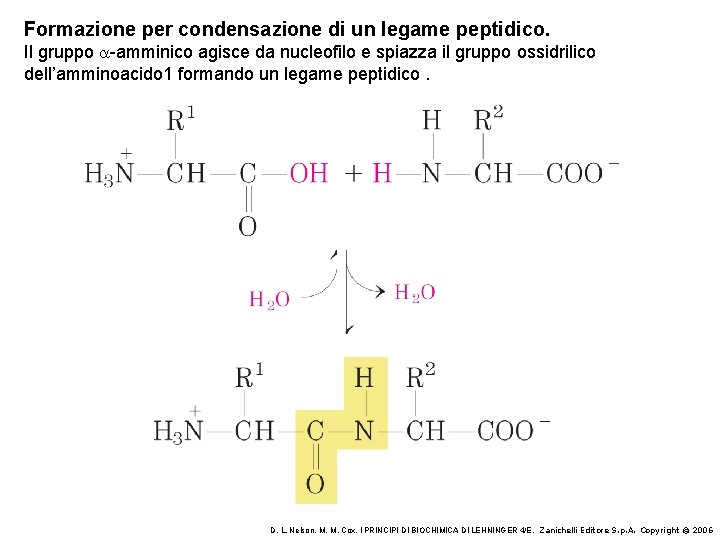
Formazione per condensazione di un legame peptidico. Il gruppo a-amminico agisce da nucleofilo e spiazza il gruppo ossidrilico dell’amminoacido 1 formando un legame peptidico. D. L. Nelson, M. M. Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER 4/E, Zanichelli Editore S. p. A. Copyright © 2006

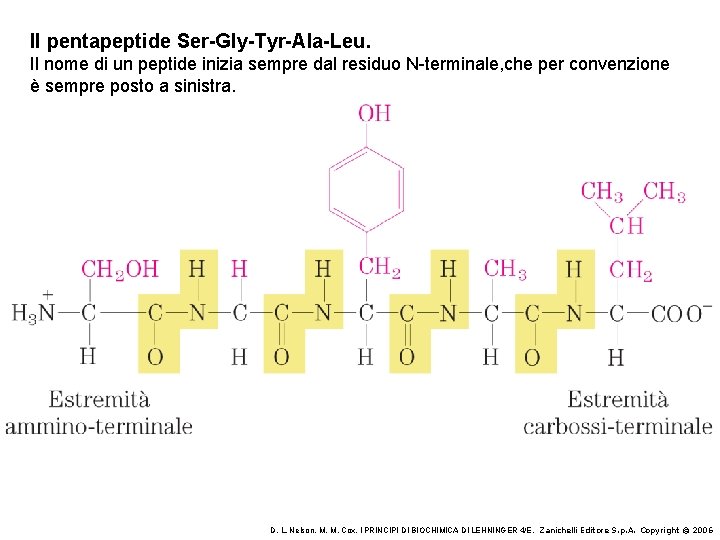
Il pentapeptide Ser-Gly-Tyr-Ala-Leu. Il nome di un peptide inizia sempre dal residuo N-terminale, che per convenzione è sempre posto a sinistra. D. L. Nelson, M. M. Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER 4/E, Zanichelli Editore S. p. A. Copyright © 2006

Alanilglutammilglicillisina. Il tetrapeptide ha un gruppo a-amminico libero, un gruppo a-carbossilico libero e due gruppi R ionizzabili. I gruppi ionizzati a p. H 7 sono in rosso. D. L. Nelson, M. M. Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER 4/E, Zanichelli Editore S. p. A. Copyright © 2006
 Ic ronco scrivia
Ic ronco scrivia Questa è la notte in cui cristo ha distrutto la morte
Questa è la notte in cui cristo ha distrutto la morte Sempre caro mi fu questo ermo colle
Sempre caro mi fu questo ermo colle Saliremo in questa barca anche noi
Saliremo in questa barca anche noi Nummeri
Nummeri Se il signore avesse conosciuto questa piana di puglia
Se il signore avesse conosciuto questa piana di puglia Espressioni impossibili
Espressioni impossibili Portale ndr
Portale ndr Il metodo deduttivo
Il metodo deduttivo Artropode caractere generale
Artropode caractere generale Quadro generale in inglese
Quadro generale in inglese Intelligenza psicologia generale
Intelligenza psicologia generale