stav experimentlnej fyziky Slovensk akadmia vied Koice Slovensko




- Slides: 11

Ústav experimentálnej fyziky, Slovenská akadémia vied Košice, Slovensko Súťaž mladých vedeckých pracovníkov ÚEF SAV do 35 rokov Interakcie malých molekúl s amyloidogénnymi proteínmi RNDr. Zuzana Bednáriková, Ph. D. Oddelenie biofyziky Košice 15. 12. 2016

Zoznam prihlásených prác do súťaže: Bednarikova Z, Huy PDQ, Mocanu MM, Fedunova D, Li MS, Gazova Z. Fullerenol C 60(OH)16 prevents amyloid fibrillization of Aβ 40 – in vitro and in silico approach. Physical Chemistry Chemical Physics, 2016, 18855 -18867 Impact factor 2015: 4. 449 – Q 1 Hamulakova S, Poprac P, Jomova K, Brezova V, Lauro P, Drostinova L, Jun D, Sepsova V, Hrabinova M, Soukup O, Kristian P, Gazova Z, Bednarikova Z, Kuca K, Valko M. Targeting copper(II)-induced oxidative stress and the acetylcholinesterase system in Alzheimer's disease using multifunctional tacrine-coumarin hybrid molecules Journal of Inorganic Biochemistry, 2016, 161, 52 -62 Impact factor 2015: 3. 205 – Q 1 Kar RK, Gazova Z, Bednarikova Z, Mroue KH, Ghosh A, Zhang R, Ulicna K, Siebert H-Ch, Nifantiev NE, Bhunia A. Evidence for Inhibition of Lysozyme Amyloid Fibrillization by Peptide Fragments from Human Lysozyme: A Combined Spectroscopy, Microscopy and Docking Study Biomacromolecules, 2016, 17 (6), 1998 -2009 Impact factor 2015: 5. 583 – Q 1 Flachbartova Z, Pulzova L, Bencurova E, Potocnakova L, Comor L, Bednarikova Z, Bhide M. Inhibition of multidrug resistant Listeria monocytogenes by peptides isolated from combinatorial phage display libraries Microbiological Research, 2016, 188– 189, 34 -41 Impact factor 2015: 2. 723 – Q 2 Siposova K, Pospiskova K, Bednarikova Z, Safarik I, Safarikova M, Kubovcikova M, Kopcansky P, Gazova Z. The molecular mass of dextran used to modify magnetite nanoparticles affects insulin amyloid aggregation Journal of Magnetism and Magnetic Materials, In Press, 2016, 10. 1016/j. jmmm. 2016. 10. 083 Impact factor 2015: 2. 357 – Q 1

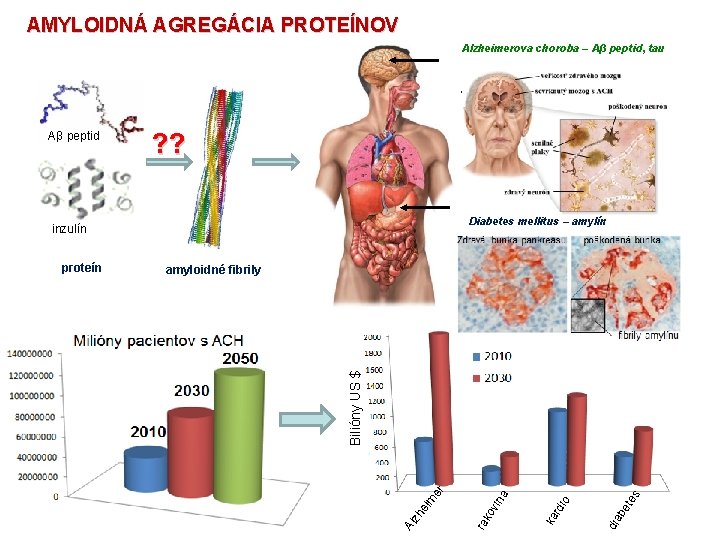
AMYLOIDNÁ AGREGÁCIA PROTEÍNOV Alzheimerova choroba – Aβ peptid, tau Parkinsonova choroba – α-synukleín Priónové ochorenia – infekčný priónový proteín ? ? Dedičná amyloidóza – lyzozým Lokalizovaná amyloidóza – inzulín Diabetes mellitus – amylín inzulín amyloidné fibrily s ete dia b dio a ov in ka r Al zh ei m er Bilióny US $ proteín ra k Aβ peptid

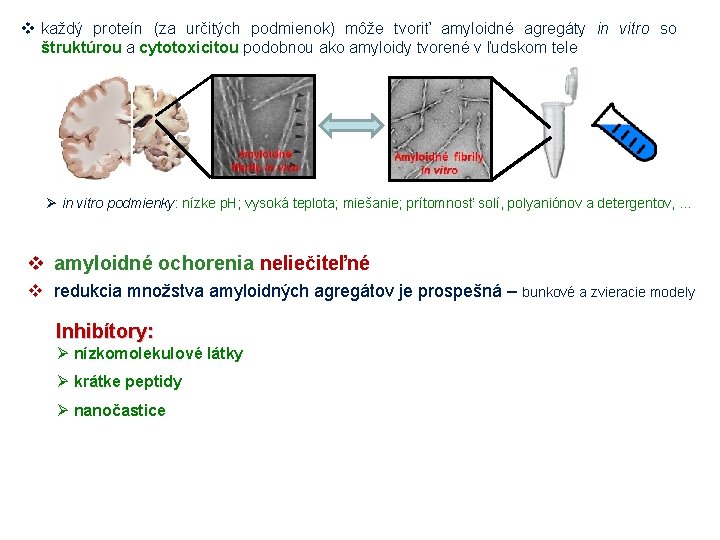
v každý proteín (za určitých podmienok) môže tvoriť amyloidné agregáty in vitro so štruktúrou a cytotoxicitou podobnou ako amyloidy tvorené v ľudskom tele Ø in vitro podmienky: nízke p. H; vysoká teplota; miešanie; prítomnosť solí, polyaniónov a detergentov, . . . v amyloidné ochorenia neliečiteľné v redukcia množstva amyloidných agregátov je prospešná – bunkové a zvieracie modely Inhibítory: Ø nízkomolekulové látky Ø krátke peptidy Ø nanočastice

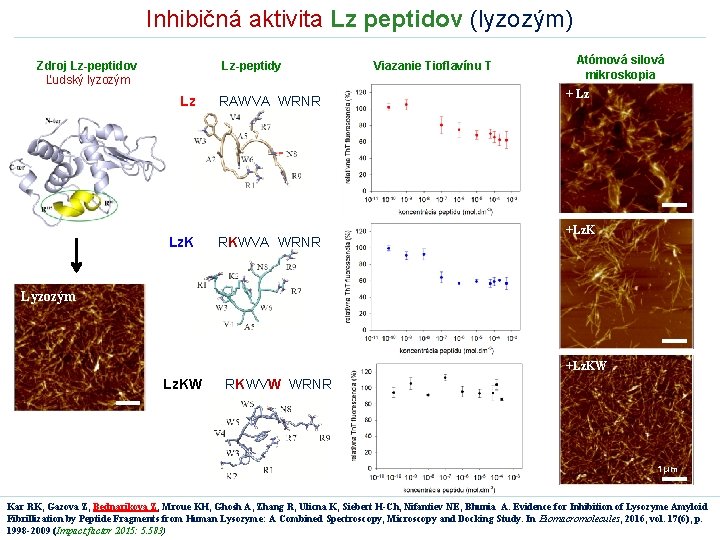
Inhibičná aktivita Lz peptidov (lyzozým) Zdroj Lz-peptidov Ľudský lyzozým Lz-peptidy Lz RAWVA WRNR Lz. K RKWVA WRNR Viazanie Tioflavínu T Atómová silová mikroskopia + Lz +Lz. K Lyzozým +Lz. KW RKWVW WRNR 1 μm Kar RK, Gazova Z, Bednarikova Z, Mroue KH, Ghosh A, Zhang R, Ulicna K, Siebert H-Ch, Nifantiev NE, Bhunia A. Evidence for Inhibition of Lysozyme Amyloid Fibrillization by Peptide Fragments from Human Lysozyme: A Combined Spectroscopy, Microscopy and Docking Study. In Biomacromolecules, 2016, vol. 17(6), p. 1998 -2009 (Impact factor 2015: 5. 583)

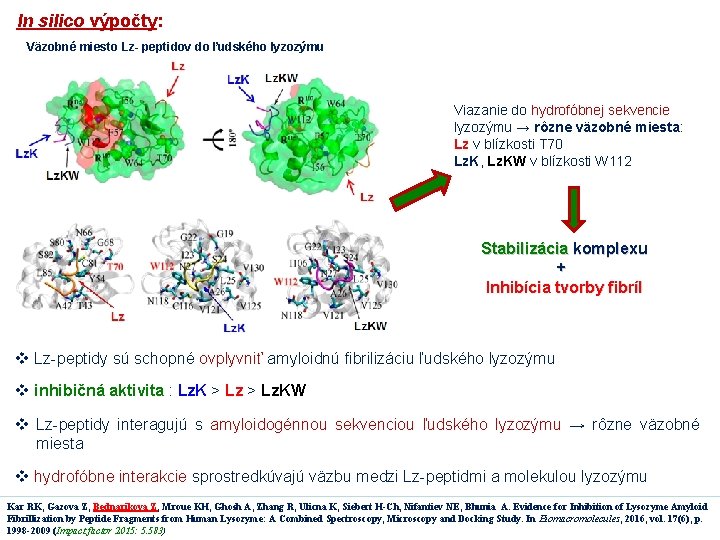
In silico výpočty: Väzobné miesto Lz- peptidov do ľudského lyzozýmu Viazanie do hydrofóbnej sekvencie lyzozýmu → rôzne väzobné miesta: Lz v blízkosti T 70 Lz. K, Lz. KW v blízkosti W 112 Stabilizácia komplexu + Inhibícia tvorby fibríl v Lz-peptidy sú schopné ovplyvniť amyloidnú fibrilizáciu ľudského lyzozýmu v inhibičná aktivita : Lz. K > Lz. KW v Lz-peptidy interagujú s amyloidogénnou sekvenciou ľudského lyzozýmu → rôzne väzobné miesta v hydrofóbne interakcie sprostredkúvajú väzbu medzi Lz-peptidmi a molekulou lyzozýmu Kar RK, Gazova Z, Bednarikova Z, Mroue KH, Ghosh A, Zhang R, Ulicna K, Siebert H-Ch, Nifantiev NE, Bhunia A. Evidence for Inhibition of Lysozyme Amyloid Fibrillization by Peptide Fragments from Human Lysozyme: A Combined Spectroscopy, Microscopy and Docking Study. In Biomacromolecules, 2016, vol. 17(6), p. 1998 -2009 (Impact factor 2015: 5. 583)

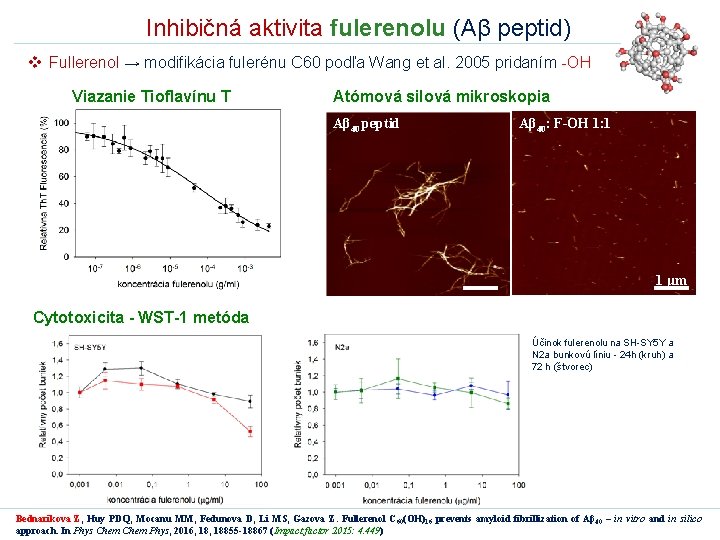
Inhibičná aktivita fulerenolu (Aβ peptid) v Fullerenol → modifikácia fulerénu C 60 podľa Wang et al. 2005 pridaním -OH Viazanie Tioflavínu T Atómová silová mikroskopia Aβ 40 peptid Aβ 40: F-OH 1: 1 1 μm Cytotoxicita - WST-1 metóda Účinok fulerenolu na SH-SY 5 Y a N 2 a bunkovú líniu - 24 h (kruh) a 72 h (štvorec) Bednarikova Z, Huy PDQ, Mocanu MM, Fedunova D, Li MS, Gazova Z. Fullerenol C 60(OH)16 prevents amyloid fibrillization of Aβ 40 – in vitro and in silico approach. In Phys Chem Phys, 2016, 18855 -18867 (Impact factor 2015: 4. 449)

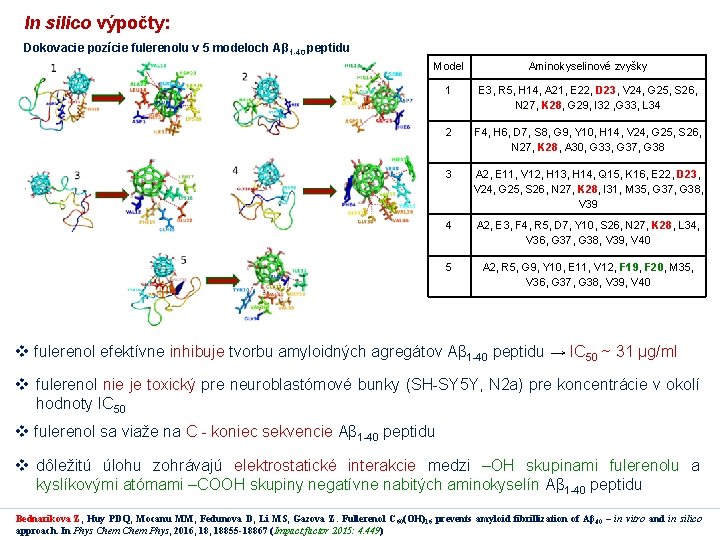
In silico výpočty: Dokovacie pozície fulerenolu v 5 modeloch Aβ 1 -40 peptidu Model Aminokyselinové zvyšky 1 E 3, R 5, H 14, A 21, E 22, D 23, V 24, G 25, S 26, N 27, K 28, G 29, I 32 , G 33, L 34 2 F 4, H 6, D 7, S 8, G 9, Y 10, H 14, V 24, G 25, S 26, N 27, K 28, A 30, G 33, G 37, G 38 3 A 2, E 11, V 12, H 13, H 14, Q 15, K 16, E 22, D 23, V 24, G 25, S 26, N 27, K 28, I 31, M 35, G 37, G 38, V 39 4 A 2, E 3, F 4, R 5, D 7, Y 10, S 26, N 27, K 28, L 34, V 36, G 37, G 38, V 39, V 40 5 A 2, R 5, G 9, Y 10, E 11, V 12, F 19, F 20, M 35, V 36, G 37, G 38, V 39, V 40 v fulerenol efektívne inhibuje tvorbu amyloidných agregátov Aβ 1 -40 peptidu → IC 50 ~ 31 µg/ml v fulerenol nie je toxický pre neuroblastómové bunky (SH-SY 5 Y, N 2 a) pre koncentrácie v okolí hodnoty IC 50 v fulerenol sa viaže na C - koniec sekvencie Aβ 1 -40 peptidu v dôležitú úlohu zohrávajú elektrostatické interakcie medzi –OH skupinami fulerenolu a kyslíkovými atómami –COOH skupiny negatívne nabitých aminokyselín Aβ 1 -40 peptidu Bednarikova Z, Huy PDQ, Mocanu MM, Fedunova D, Li MS, Gazova Z. Fullerenol C 60(OH)16 prevents amyloid fibrillization of Aβ 40 – in vitro and in silico approach. In Phys Chem Phys, 2016, 18855 -18867 (Impact factor 2015: 4. 449)

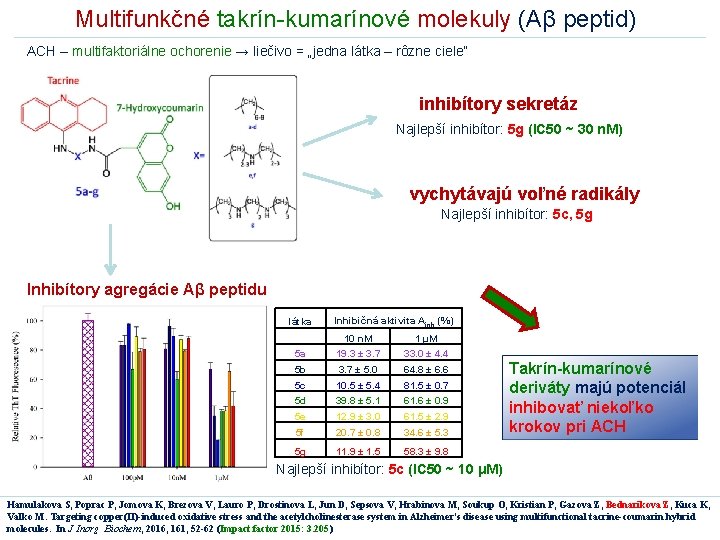
Multifunkčné takrín-kumarínové molekuly (Aβ peptid) ACH – multifaktoriálne ochorenie → liečivo = „jedna látka – rôzne ciele“ inhibítory sekretáz Najlepší inhibítor: 5 g (IC 50 ~ 30 n. M) vychytávajú voľné radikály Najlepší inhibítor: 5 c, 5 g Inhibítory agregácie Aβ peptidu látka Inhibičná aktivita Ainh (%) 10 n. M 1 μM 5 a 19. 3 ± 3. 7 33. 0 ± 4. 4 5 b 3. 7 ± 5. 0 64. 8 ± 6. 6 5 c 10. 5 ± 5. 4 81. 5 ± 0. 7 5 d 39. 8 ± 5. 1 61. 6 ± 0. 9 5 e 12. 9 ± 3. 0 61. 5 ± 2. 9 5 f 20. 7 ± 0. 8 34. 6 ± 5. 3 5 g 11. 9 ± 1. 5 58. 3 ± 9. 8 Takrín-kumarínové deriváty majú potenciál inhibovať niekoľko krokov pri ACH Najlepší inhibítor: 5 c (IC 50 ~ 10 μM) Hamulakova S, Poprac P, Jomova K, Brezova V, Lauro P, Drostinova L, Jun D, Sepsova V, Hrabinova M, Soukup O, Kristian P, Gazova Z, Bednarikova Z, Kuca K, Valko M. Targeting copper(II)-induced oxidative stress and the acetylcholinesterase system in Alzheimer's disease using multifunctional tacrine-coumarin hybrid molecules. In J Inorg Biochem, 2016, 161, 52 -62 (Impact factor 2015: 3. 205)

ZÁVER v Lz-peptidy sú schopné ovplyvniť amyloidnú fibrilizáciu ľudského lyzozýmu • hydrofóbne interakcie • viazanie do hydrofóbnej sekvencie ľudského lyzozýmu v fulerenol je schopný inhibovať amyloidnú agregáciu Aβ 1 -40 peptidu • elektrostatické interakcie • viaže sa na hydrofóbny C-koniec molekuly Aβ 1 -40 peptidu • nie je toxický v Takrín-kumarínové deriváty ovplyvňujú viaceré prejavy Alzheimerovej choroby • inhibujú štiepenie Aβ peptidov • vychytávajú voľné radikály • potláčajú agregáciu Aβ(1 -40) peptidu

Ďakujem za pozornosť !!!