SPRZENIE MOMENTW PDU W ATOMACH WIELOELEKTRONOWYCH SPRZENIE LS





















- Slides: 34

SPRZĘŻENIE MOMENTÓW PĘDU W ATOMACH WIELOELEKTRONOWYCH; SPRZĘŻENIE L-S, j-j. REGUŁY WYBORU. EFEKT ZEEMANA. 1

Sprzężenie L – S Atom He: energia kulombowska (S, P, D…) i wymiany (multipletowość); termy i multiplety Dwa elektrony: S = 0 (singlety), S = 1 (tryplety) Trzy elektrony: S = 1/2 (dublety), S = 3/2 (kwartety) Cztery elektrony: S = 0 (singlety), S = 1 (tryplety), S = 2 (kwintety) Pięć elektronów: S = 1/2 (singlety), S = 3/2 (kwartety), S = 5/2 (sekstety), itd… (mimo wzg. słabego oddziaływania spinów, znaczenie części przestrzennej funkcji i oddziaływania e 2/r 12) 2

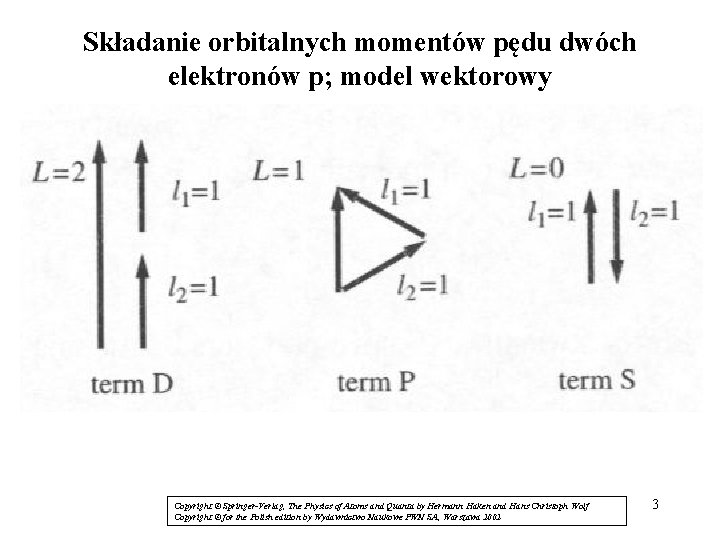
Składanie orbitalnych momentów pędu dwóch elektronów p; model wektorowy Copyright © Springer-Verlag, The Physics of Atoms and Quanta by Hermann Haken and Hans Christoph Wolf Copyright © for the Polish edition by Wydawnictwo Naukowe PWN SA, Warszawa 2002 3

Termy; nierozszczepione multiplety (bez s – o) Konfiguracja np. 1 s 2 p (pole centralne) Niecentralna część e 2/r 12 (różne L) Energia wymiany (termy) Spin – orbita (różne J, multiplety: zbiory poziomów) Pole magnetyczne (różne m. J, stany) 4

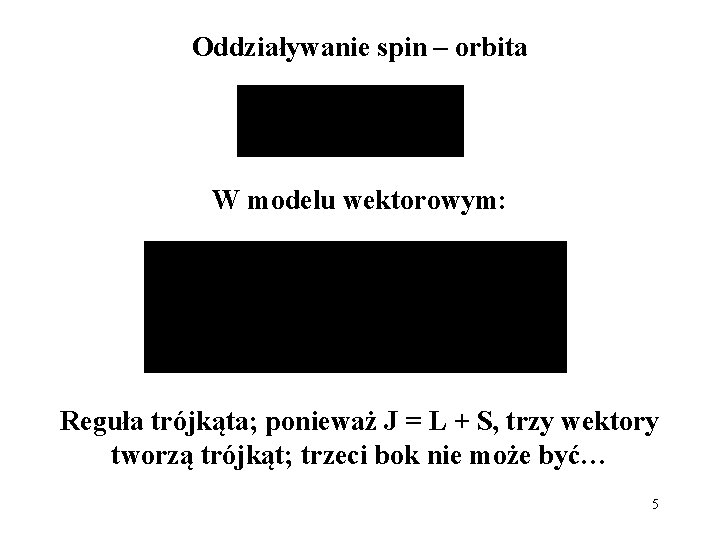
Oddziaływanie spin – orbita W modelu wektorowym: Reguła trójkąta; ponieważ J = L + S, trzy wektory tworzą trójkąt; trzeci bok nie może być… 5

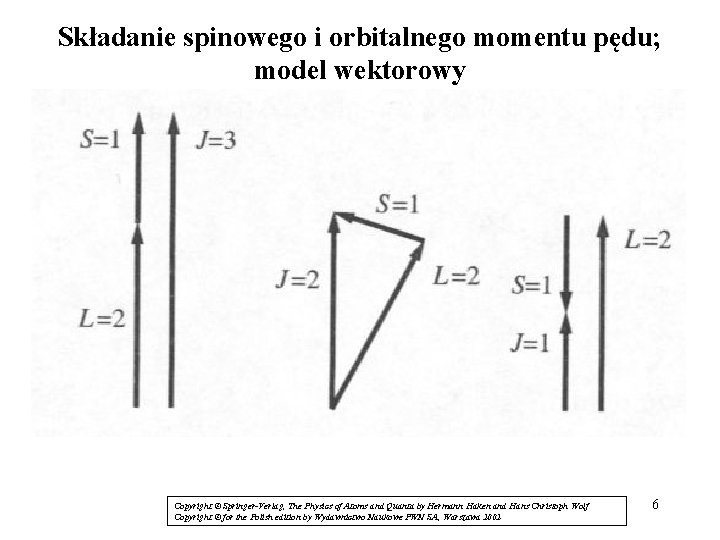
Składanie spinowego i orbitalnego momentu pędu; model wektorowy Copyright © Springer-Verlag, The Physics of Atoms and Quanta by Hermann Haken and Hans Christoph Wolf Copyright © for the Polish edition by Wydawnictwo Naukowe PWN SA, Warszawa 2002 6

Oddziaływanie spin – orbita W modelu wektorowym: 7

A więc, dla prostych multipletów (J wyżej od J – 1): Reguła interwałów Landégo; kryterium na spełnienie przybliżenia Russela – Saundersa (sprzężenie L–S) przez atom wieloelektronowy 8

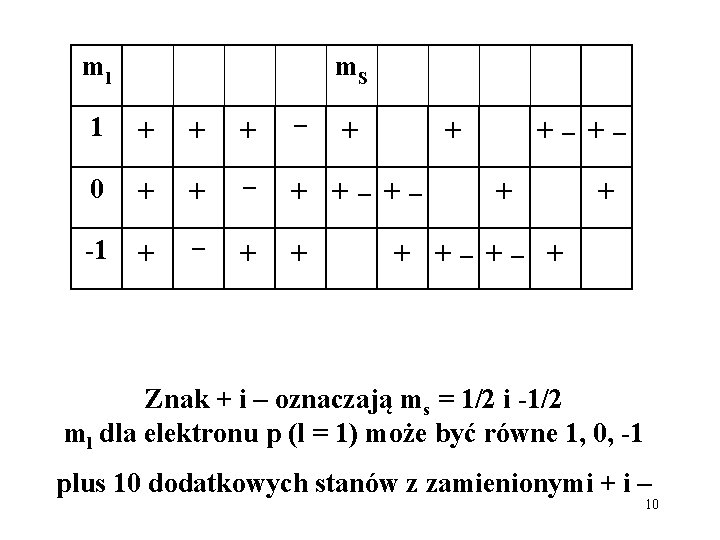
Przykład; termy konfiguracji stanu podstawowego atomu azotu, 2 p 3 Ponieważ: L = 3, 2, 1, 0 a S = 3/2 bądź 1/2, zatem wydawałoby się, że dozwolone termy powinny być S, P, D, F, dublety i kwartety. ZAKAZ PAULIEGO! Rozważymy rozkład elektronów 3 p w stanach jednoelektronowych, scharakteryzowanych liczbami ml i ms, taki, by był spełniony zakaz Pauliego 9

ml m. S 1 + + + – 0 + + – + +– +– -1 + – + + +– +– + Znak + i – oznaczają ms = 1/2 i -1/2 ml dla elektronu p (l = 1) może być równe 1, 0, -1 plus 10 dodatkowych stanów z zamienionymi + i – 10

Rozkład 20 stanów pomiędzy stany wieloelektronowe o określonej wartości ML i MS ML/MS -1/2 +1/2 2 1 1 1 2 2 3 2 1 1 0 -1 -2 -3/2 1 +3/2 1 Są to składowe następujących termów: 4 S, 2 P, 2 D 11

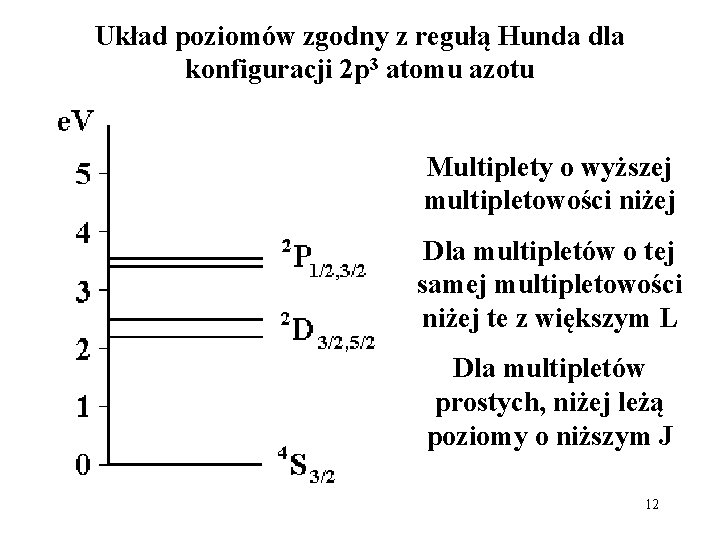
Układ poziomów zgodny z regułą Hunda dla konfiguracji 2 p 3 atomu azotu / Multiplety o wyższej multipletowości niżej Dla multipletów o tej samej multipletowości niżej te z większym L Dla multipletów prostych, niżej leżą poziomy o niższym J 12

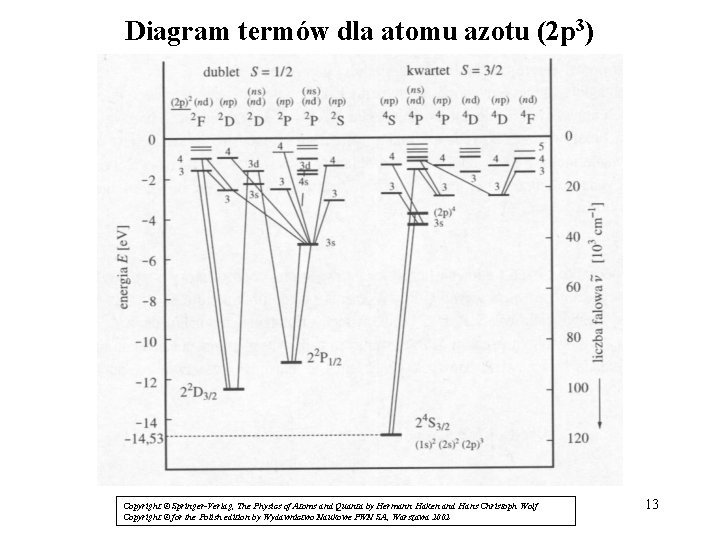
Diagram termów dla atomu azotu (2 p 3) / Copyright © Springer-Verlag, The Physics of Atoms and Quanta by Hermann Haken and Hans Christoph Wolf Copyright © for the Polish edition by Wydawnictwo Naukowe PWN SA, Warszawa 2002 13

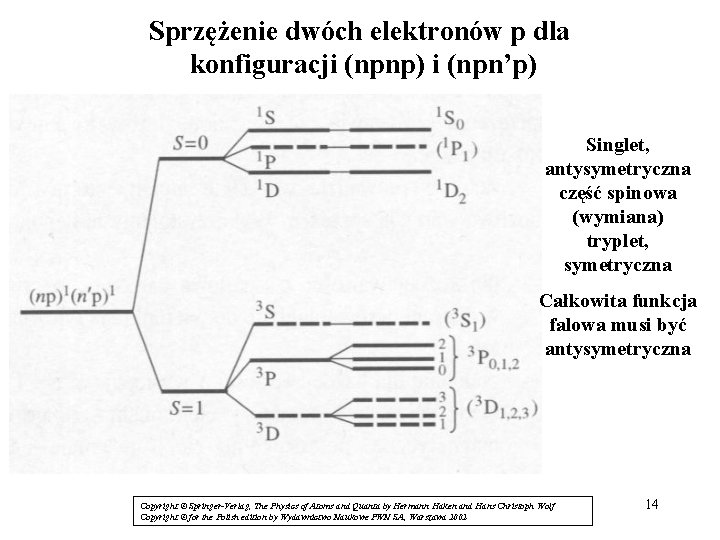
Sprzężenie dwóch elektronów p dla konfiguracji (npnp) i (npn’p) / Singlet, antysymetryczna część spinowa (wymiana) tryplet, symetryczna Całkowita funkcja falowa musi być antysymetryczna Copyright © Springer-Verlag, The Physics of Atoms and Quanta by Hermann Haken and Hans Christoph Wolf Copyright © for the Polish edition by Wydawnictwo Naukowe PWN SA, Warszawa 2002 14

Sprzężenie j – j Stała sprzężenia spin – orbita dla pojedynczego elektronu rośnie z Z: zatem dla ciężkich atomów maleje względne znaczenie energii wymiany; maleje uporządkowanie charakterystyczne dla sprzężenia L – S, rośnie znaczenie sprzężenia s i l dla pojedynczego elektronu 15

Musimy zastosować inny sposób składania momentów pędu: Wartości j i J znajdujemy stosując model wektorowy: j 1 = l 1 + s 1, l 1 – s 1, j 2 = l 2 + s 2, l 2 – s 2 J = j 1 + j 2, j 1 + j 2 – 1, … |j 1 – j 2| Ale nie wszystkie tak znalezione stany (j 1, j 2)J będą spełniać zakaz Pauliego 16

Przejście od sprzężenia L – S w atomach lekkich do sprzężenia j – j w atomach cięższych 1600 cm-1 / 40 cm-1 20 cm-1 Stany wzbudzone konfiguracji (np)2 atomów IV grupy układu okresowego (C, Si, Ge, Sn, Pb)17

Reguły wyboru (przejścia elektryczne – dipolowe) element macierzowy odpowiedzialny za przejścia ze stanu j do k ξ = x, y, z dla światła spolaryzowanego liniowo w kierunku x, y, z = x + iy, x – iy, dla światła spolaryzowanego kołowo, rozchodzącego się w kierunku z Całkowanie po współrzędnych przestrzennych i spinowych 18

Moment dipolowy (qξ), nie zależy od współrzędnych spinowych, zatem: zabronione przejścia interkombinacyjne Funkcje falowe są zbudowane z funkcji jednoelektronowych Część spinowa funkcji falowej daje się wyodrębnić (w przybliżeniu Russela – Saundersa) 19

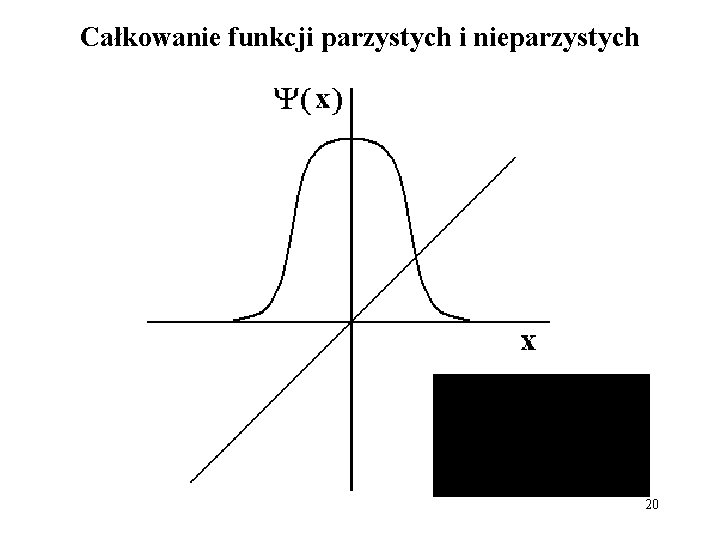
Całkowanie funkcji parzystych i nieparzystych / 20

Radialna część funkcji falowej dla wodoru: parzystość inwersja 21

Zatem: Dla funkcji s Dla funkcji p l = 1, funkcje nieparzyste Dla funkcji d Dla funkcji f l = 0, funkcje parzyste l = 2, funkcje parzyste l = 3, funkcje nieparzyste Iloczyn funkcji parzystych, parzysty Iloczyn funkcji nieparzystych, parzysty A więc: Δl = ± 1 22

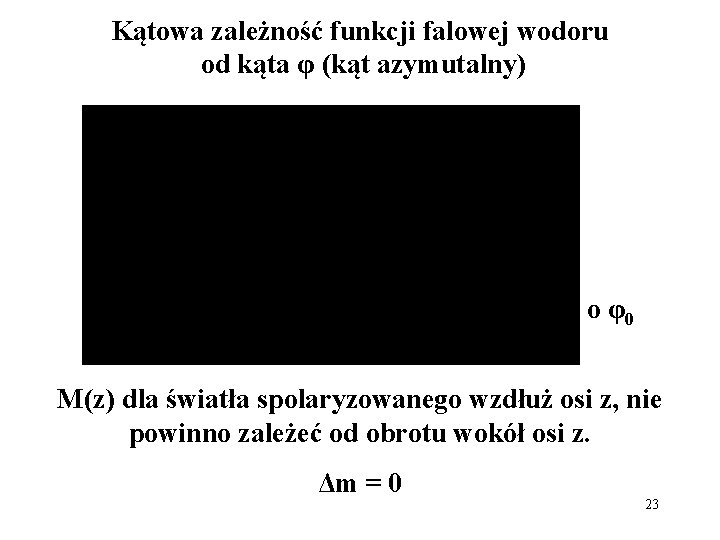
Kątowa zależność funkcji falowej wodoru od kąta φ (kąt azymutalny) obrót o φ0 M(z) dla światła spolaryzowanego wzdłuż osi z, nie powinno zależeć od obrotu wokół osi z. Δm = 0 23

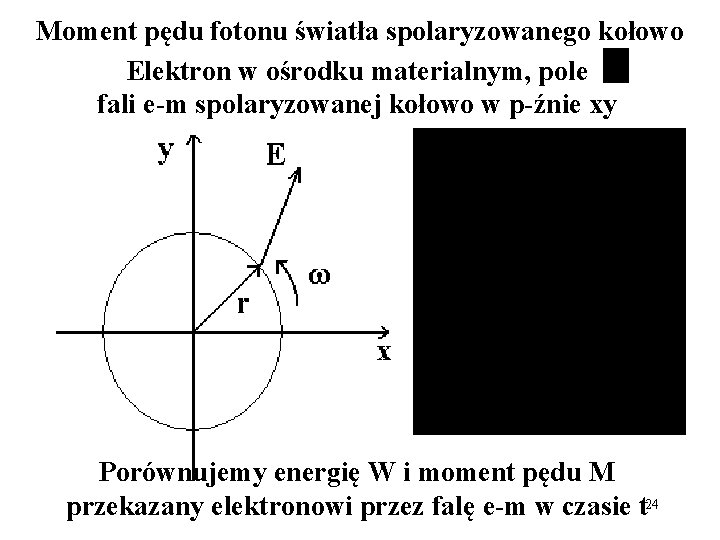
Moment pędu fotonu światła spolaryzowanego kołowo Elektron w ośrodku materialnym, pole fali e-m spolaryzowanej kołowo w p-źnie xy / Porównujemy energię W i moment pędu M przekazany elektronowi przez falę e-m w czasie t 24

Moment pędu fotonu światła spolaryzowanego kołowo, prawo- lub lewoskrętnie, rozchodzącego się w kierunku osi z jest równy: ±ħ Z zasady zachowania momentu pędu, moment pędu atomu musi się też zmienić o tę samą wartość; więc, ponieważ: Jz = mħ więc: Δm = ± 1 (polaryzacja lewo- lub prawoskrętna) 25

Reguły wyboru dla atomu w sprzężeniu L–S: 1. przejścia elektryczno-dipolowe zachodzą gdy jeden elektron zmienia stan i Δl = ± 1 2. Liczby kwantowe atomu ΔS = 0 ΔL = ± 1 lub 0 ΔJ = ± 1 lub 0, ale 0 → 0 zabronione Δm. J = ± 1 lub 0, ale Δm. J = 0 zabronione gdy ΔJ = 0 26

Reguły wyboru dla atomu w sprzężeniu j–j: 1. przejścia elektryczno-dipolowe zachodzą gdy jeden elektron zmienia stan; dla tego elektronu: Δl = ± 1, ΔJ = ± 1 lub 0, dla pozostałych elektronów ΔJ = 0 2. Liczby kwantowe atomu ΔJ = ± 1 lub 0, ale 0 → 0 zabronione Δm. J = ± 1 lub 0, ale Δm. J = 0 zabronione gdy ΔJ = 0 27

Atom wieloelektronowy w polu magnetycznym; efekt Zeemana moment magnetyczny w kierunku pola B energia w polu B Porównując oba wyrazy znajdujemy efektywny czynnik Landego g 28

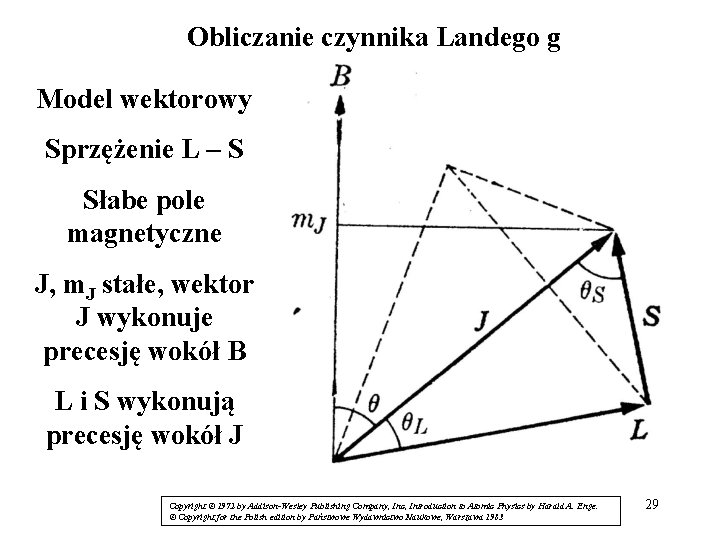
Obliczanie czynnika Landego g Model wektorowy Sprzężenie L – S Słabe pole magnetyczne J, m. J stałe, wektor J wykonuje precesję wokół B L i S wykonują precesję wokół J Copyright © 1972 by Addison-Wesley Publishing Company, Inc, Introduction to Atomic Physics by Harald A. Enge. © Copyright for the Polish edition by Państwowe Wydawnictwo Naukowe, Warszawa 1983 29

gdzie θL to kąt pomiędzy L i J, θS to kąt pomiędzy S i J, a θ to kąt pomiędzy J i B Ponieważ: i 30

a także: i z porównania odpowiednich wyrażeń: Dla S = 0 mamy g = 1, tzw. „normalne” zjawisko Zeemana, trzy składowe nawet dla J > 1, Δm. J = 0, ± 1 Dla S > 0, „anomalne” zjawisko Zeemana 31

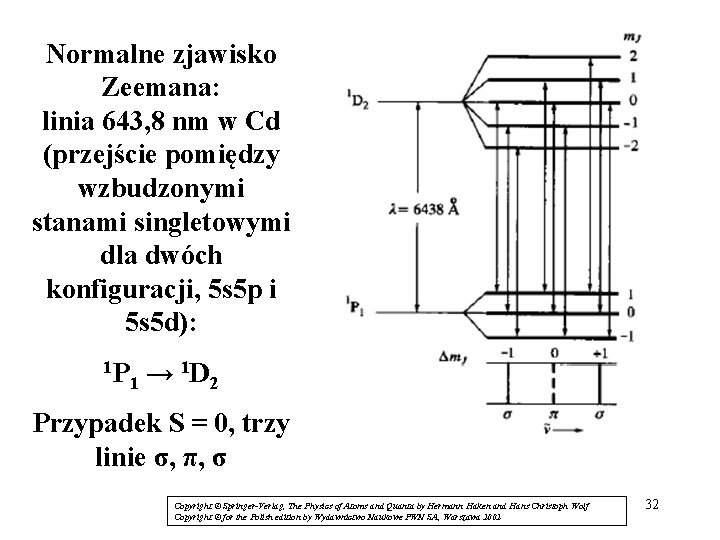
Normalne zjawisko Zeemana: linia 643, 8 nm w Cd (przejście pomiędzy wzbudzonymi stanami singletowymi dla dwóch konfiguracji, 5 s 5 p i 5 s 5 d): 1 P 1 D → 1 2 Przypadek S = 0, trzy linie σ, π, σ Copyright © Springer-Verlag, The Physics of Atoms and Quanta by Hermann Haken and Hans Christoph Wolf Copyright © for the Polish edition by Wydawnictwo Naukowe PWN SA, Warszawa 2002 32

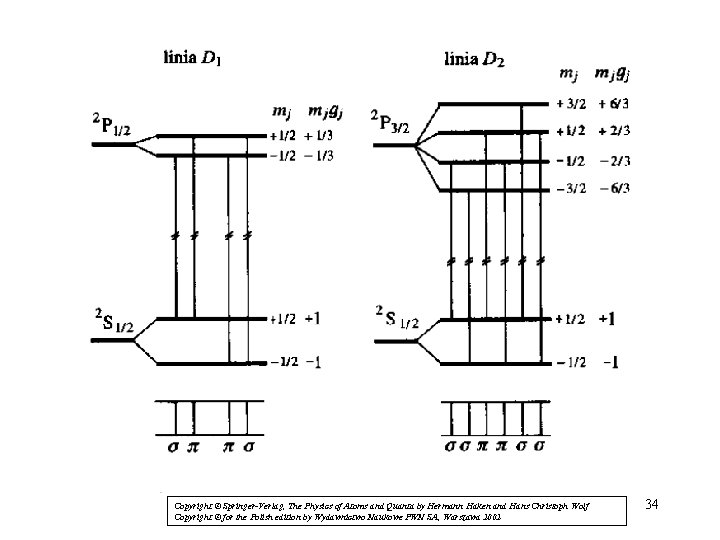
Anomalne zjawisko Zeemana, rozszczepienie linii D 1 i D 2 sodu (3 s-3 p): 2 S 2 P → 1/2 (D 1) 2 S 2 P → 1/2 3/2 (D 2) Przypadek S > 0, σ, π, π, σ (D 1) σ, σ, π, π, σ, σ (D 2) 33

Copyright © Springer-Verlag, The Physics of Atoms and Quanta by Hermann Haken and Hans Christoph Wolf Copyright © for the Polish edition by Wydawnictwo Naukowe PWN SA, Warszawa 2002 34