REGLA DEL OCTETO REGLA DE OCTETO Un tomo


- Slides: 6

REGLA DEL OCTETO

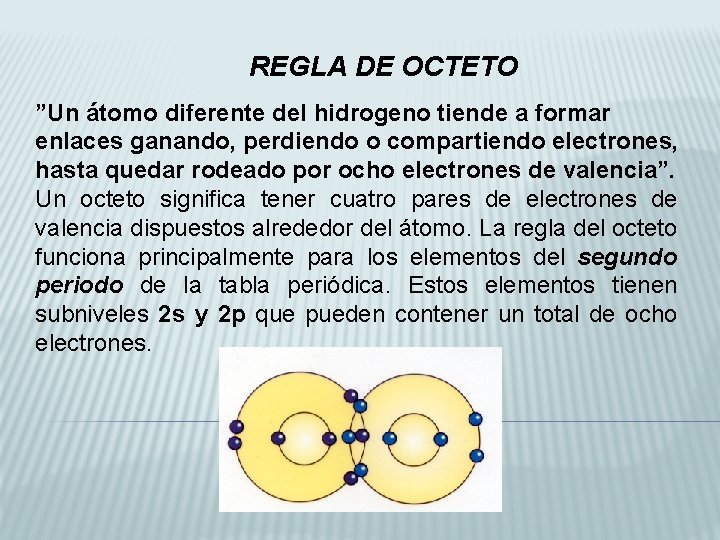
REGLA DE OCTETO ”Un átomo diferente del hidrogeno tiende a formar enlaces ganando, perdiendo o compartiendo electrones, hasta quedar rodeado por ocho electrones de valencia”. Un octeto significa tener cuatro pares de electrones de valencia dispuestos alrededor del átomo. La regla del octeto funciona principalmente para los elementos del segundo periodo de la tabla periódica. Estos elementos tienen subniveles 2 s y 2 p que pueden contener un total de ocho electrones.

Excepciones a la Regla del octeto a) Moléculas con número impar de electrones En moléculas como Cl. O 2 (19 e-); NO (11 e-); y NO 2 (17 e-), el número total de electrones de valencia es impar. Es imposible aparear totalmente y lograr un octeto alrededor de cada átomo. Las especies con número impar de electrones se llaman radicales y generalmente son muy reactivas, porque pueden utilizar el electrón desapareado para formar un nuevo enlace. Un birradical es una molécula con dos electrones desapareados, y estos se encuentran en átomos diferentes. Es el caso de la molécula de oxigeno.

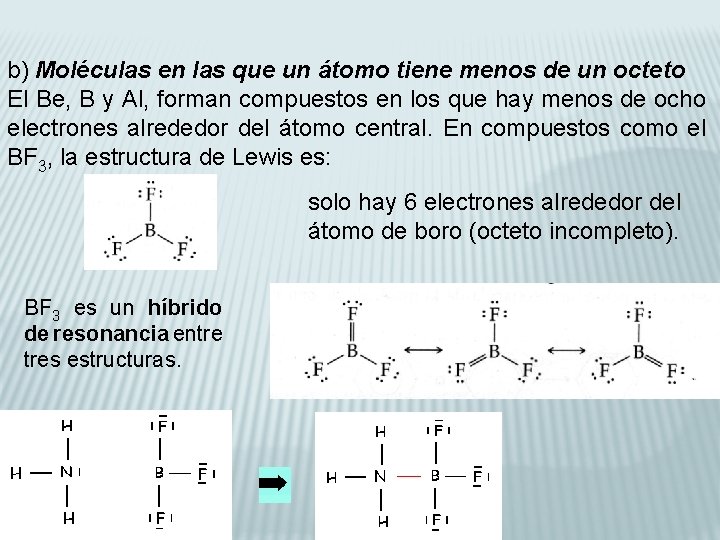
b) Moléculas en las que un átomo tiene menos de un octeto El Be, B y Al, forman compuestos en los que hay menos de ocho electrones alrededor del átomo central. En compuestos como el BF 3, la estructura de Lewis es: solo hay 6 electrones alrededor del átomo de boro (octeto incompleto). BF 3 es un híbrido de resonancia entre tres estructuras.

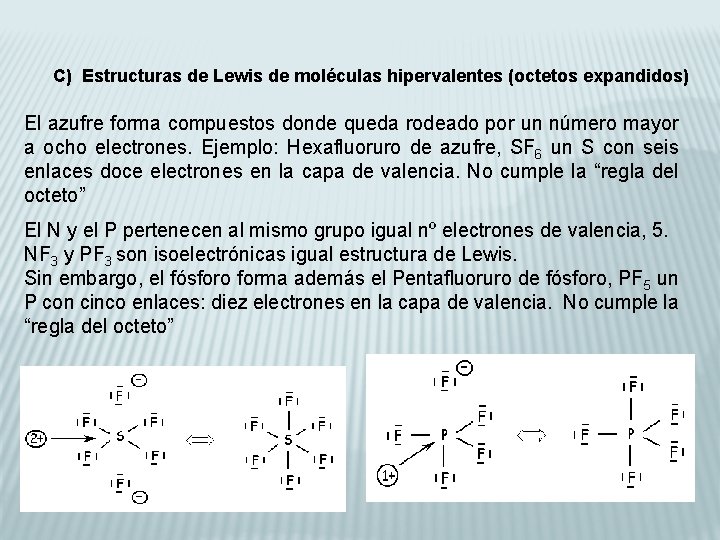
C) Estructuras de Lewis de moléculas hipervalentes (octetos expandidos) El azufre forma compuestos donde queda rodeado por un número mayor a ocho electrones. Ejemplo: Hexafluoruro de azufre, SF 6 un S con seis enlaces doce electrones en la capa de valencia. No cumple la “regla del octeto” El N y el P pertenecen al mismo grupo igual nº electrones de valencia, 5. NF 3 y PF 3 son isoelectrónicas igual estructura de Lewis. Sin embargo, el fósforo forma además el Pentafluoruro de fósforo, PF 5 un P con cinco enlaces: diez electrones en la capa de valencia. No cumple la “regla del octeto”

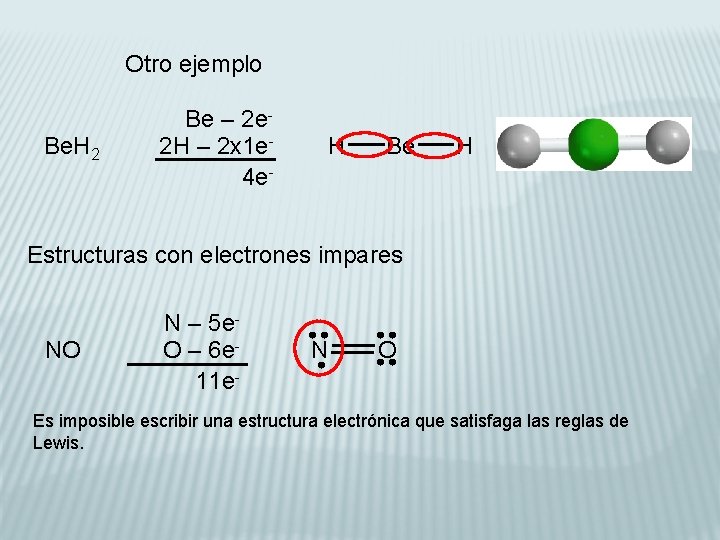
Otro ejemplo Be. H 2 Be – 2 e 2 H – 2 x 1 e 4 e- H Be H Estructuras con electrones impares NO N – 5 e. O – 6 e 11 e- N O Es imposible escribir una estructura electrónica que satisfaga las reglas de Lewis.








