QUAZAR AML001 tude internationale de Phase III multicentrique



- Slides: 5

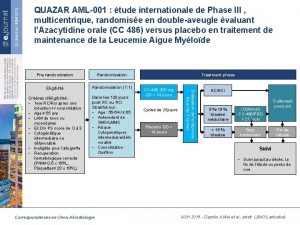
QUAZAR AML-001 : étude internationale de Phase III , multicentrique, randomisée en double-aveugle évaluant l’Azacytidine orale (CC 486) versus placebo en traitement de maintenance de la Leucemie Aigue Myéloïde Randomisation Eligibilté Randomisation (1: 1) Critères d’éligibilité : • 1 ere RC/Rci apres une induction +/-consolidation • Age ≥ 55 ans • LAM de novo ou secondaires • ECOG PS score de 0 à 3 • Cytogénétique intermediaire ou défavorable • Ineligible pour l’allogreffe • Recuperation hematologique correcte (PNN≥ 0, 5 x 109/L, Plaquettes≥ 20 x 109/L) Dans les 120 jours post RC ou RCi Stratifié sur: • Age : 55 -64 / ≥ 65 • Antecedent de SMD/LMMC • Risque Cytogenetiquer: intermediaire/défo vorable • Consolidation : Oui/Non Correspondances en Onco-Hématologie Treatment phase CC-486 300 mg QD x 14 jours Cycles de 28 jours Placebo QD x 14 jours Evaluation de la réponse tous les 3 cycles Pre-randomization RC/RCi 5 %-15 % blastes médullaire (Optional) CC-486/PBO X 21 jours > 15 % blastse Stop traitement Traitement poursuivi Fin de l’étude Suivi • Suivi jusqu’(au décés, la fin de l’étude ou perdu de vue ASH 2019 - D’après A. Wei et al. , abstr. LBA 03, actualisé

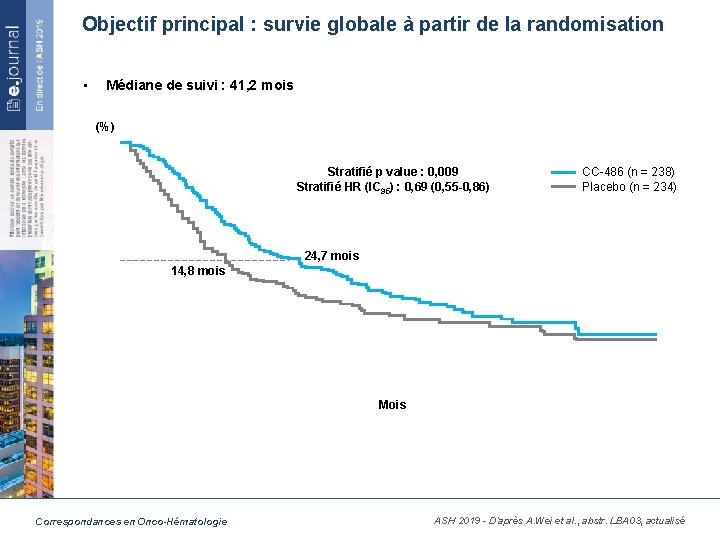
Objectif principal : survie globale à partir de la randomisation • Médiane de suivi : 41, 2 mois (%) Stratifié p value : 0, 009 Stratifié HR (IC 95) : 0, 69 (0, 55 -0, 86) CC-486 (n = 238) Placebo (n = 234) 24, 7 mois 14, 8 mois Mois Correspondances en Onco-Hématologie ASH 2019 - D’après A. Wei et al. , abstr. LBA 03, actualisé

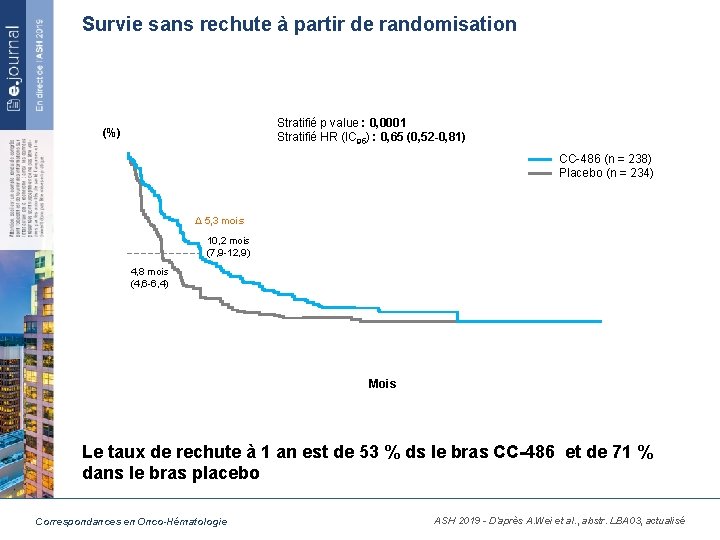
Survie sans rechute à partir de randomisation Stratifié p value : 0, 0001 Stratifié HR (IC 95) : 0, 65 (0, 52 -0, 81) (%) CC-486 (n = 238) Placebo (n = 234) Δ 5, 3 mois 10, 2 mois (7, 9 -12, 9) 4, 8 mois (4, 6 -6, 4) Mois Le taux de rechute à 1 an est de 53 % ds le bras CC-486 et de 71 % dans le bras placebo Correspondances en Onco-Hématologie ASH 2019 - D’après A. Wei et al. , abstr. LBA 03, actualisé

Tolérance CC-486 (n = 236) • Les effets secondaires gastro-intestinaux sont plus fréquents dans le bras CC-486 Durant les deux premiers cycles • Des effets indésirables sévères ont été rapportés dans les deux bras (34% avec CC 486, 25% avec le placebo) Tous grades Placebo (n = 233) Grade 3 -4 Tous grades Grade 3 -4 n (%) Patients avec ≥ 1 EI 231 (98) 169 (72) 225 (97) 147 (63) Nausées 153 (65) 6 (3) 55 (24) 1 (0, 4) Vomissements 141 (60) 7 (3) 23 (10) 0 Diarrhées 119 (50) 12 (5) 50 (22) 3 (1) Constipation 91 (39) 3 (1) 56 (24) 0 Neutropenie 105 (45) 97 (41) 61 (26) 55 (24) Thrombocytopenie 79 (34) 53 (23) 63 (27) 50 (22) Anemie 48 (20) 33 (14) 42 (18) 30 (13) Fatigue 70 (30) 7 (3) 45 (19) 2 (1) Asthenie 44 (19) 2 (1) 13 (6) 1 (0, 4) Fievre 36 (15) 4 (2) 44 (19) 1 (0, 4) Toux 29 (12) 0 39 (17) 0 Gastro-intestinal Hematologique Autres • Aucun décés en lien avec le traitement Correspondances en Onco-Hématologie ASH 2019 - D’après A. Wei et al. , abstr. LBA 03, actualisé

Messages • L’azacytidine orale est le premier traitement d’entretien montrant un benefice en survie globale et survie sans rechute dans une population de LAM non favorable, traitée et mis en remission complete par un schema de chimiothérapie intensive. • La tolérance du traitement est bonne , sans toxicité majeure avec de rares effets digestifs facilement gérables. • La qualité de vie, mesurée dans l’essai, n’est absolument pas diminuée par rapport au bras contrôle placebo Correspondances en Onco-Hématologie ASH 2019 - D’après A. Wei et al. , abstr. LBA 03, actualisé