POTANSYOMETR Elektrokimyasal Hcreler 2ye ayrlr a Galvanik Hcreler













- Slides: 16

POTANSİYOMETRİ

Elektrokimyasal Hücreler: 2’ye ayrılır. a- Galvanik Hücreler: b- Elektrolitik Hücreler: Hücreden akım geçebilmesi için: 1 - Metalik iletkenlik 2 - Elektrolitik iletkenlik gerekir. ANOT: Yükseltgenmenin olduğu elektrot KATOT: İndirgenmenin olduğu elektrot Hg 2 Cl 2 + 2 e- 2 Hg 0 + 2 Cl- Katodik reaksiyon 2 H 2 O O 2 + 4 H+ + 4 e. Anodik reaksiyon

SIVI DEĞME POTANSİYELİ Farklı elektrolitler içeren iki çözelti veya aynı elektrolitin değişik konsantrasyonundaki iki çözeltisi birbirine değdiği zaman değme ara yüzeyinde bir potansiyel farkı oluşur. Buna Sıvı değme potansiyeli (Difüzyon potansiyeli) denir. Hücrelerin Şematik Gösterilişi: (-) Pt Fe+2 (a 1), Fe+3 (a 2) Mn. O 4 (a 3) , Mn+2 (a 4), H+ (a 5) Pt (+) Hücreden akım geçişi: I= E / R I: Akım (Amper) ; R: Direnç (ohm) ; E: Potansiyel farkı (Volt)

Standard Elektrot Potansiyelleri ve İşaretleri: E 0 (e 0) ile gösterilir. Standard hidrojen elektroda göre indirgen olanlar (-), yükseltgen olanlar (+) işaret ile gösterilirler. E 0’ı büyük olan indirgenme yönünde, küçük olan yükseltgenme yönünde kendiliğinden yürür. HÜCREDE POTANSİYEL DÜŞMESİ:

Cd |Cd. SO 4 || Cu. SO 4 | Cu EH: 0. 74 V Cd 0 + Cu+2 Cu 0 + Cd+2 Bu hücrenin direnci 4 , akım da 0. 02 amper ise E= Ix. R =0. 08 yani – 0. 08 V luk bir gerilim daha uygulanmalıdır. Bu hücrenin çalışması için -0. 74 - 0. 08 = -0. 82 V luk bir gerilim uygulanmalıdır. Biraz önceki 4 , 0. 02 amperlik akım örneğini uygularsak: 4 x 0. 02 = 0. 08 V luk bir azalma olacaktır. 0. 74 – 0. 08 = 0. 66 V hücre gerilimi gereklidir. IR düşüşü daima termodinamik potansiyelden çıkarılır. EH = EK –EA -IR

POLARİZASYON: Hücre veya eleltrotta akım geçişi sırasında potansiyelin standard potansiyel ve IR düşüşünden hesaplanan değerinden sapmasına denir. Başlıca 3 tipi vardır. 1 - Konsantrasyon polarizasyonu Ag+ + e- Ag 0 2 - Aktivasyon polarizasyonu 3 - Direnç polarizasyonu ELEKTROTLAR: 1 - Referans elektrotlar 2 - İndikatör elektrotlar

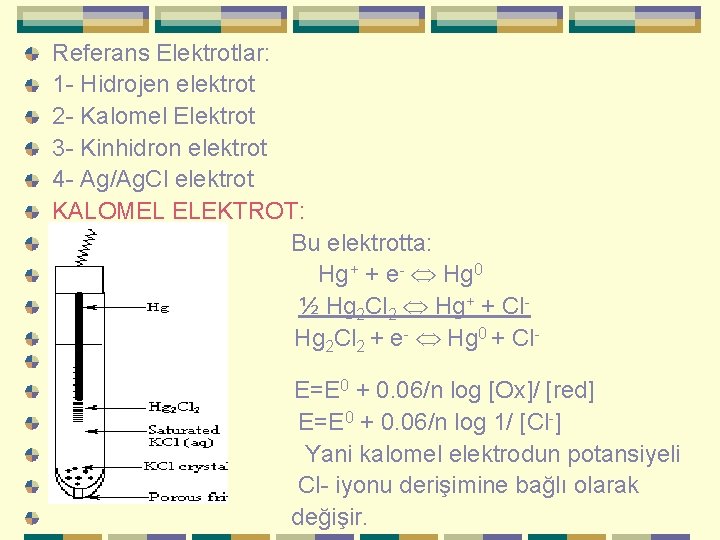
Referans Elektrotlar: 1 - Hidrojen elektrot 2 - Kalomel Elektrot 3 - Kinhidron elektrot 4 - Ag/Ag. Cl elektrot KALOMEL ELEKTROT: Bu elektrotta: Hg + + e- Hg 0 ½ Hg 2 Cl 2 Hg+ + Cl. Hg 2 Cl 2 + e- Hg 0 + Cl. E=E 0 + 0. 06/n log [Ox]/ [red] E=E 0 + 0. 06/n log 1/ [Cl-] Yani kalomel elektrodun potansiyeli Cl- iyonu derişimine bağlı olarak değişir.

0. 1 N Cl- E= 0. 334 1 N Cl. E= 0. 280 Doymuş kalomel E= 0. 242 Ag/Ag. Cl Elektrot:

Bu elektrotta: Ag+ + e- Ag 0 Ag. Cl Ag+ + Cl. Ag. Cl + e- Ag 0 + Cl. E=E 0 + 0. 06 log [Ag. Cl]/ [Ag] [Cl-] E=E 0 + 0. 06 log 1/ [Cl-] Yani Ag/Ag. Cl Elektrodun potansiyeli ortamdaki [Cl-] iyonu derişimine bağlı olarak değişir.

0. 1 N Ag/Ag. Cl E= 0. 290 V 1 N Ag/Ag. Cl E= 0. 237 V Doymuş kalomel E= 0. 199 V İndikatör (Ölçüm) Elektrotları: 1 -Metalik Elektrotlar: Ag, Cd, Cu, Pb, Hg. Pt, Au, Ir, Pd. 2 -Membran Elektrotlar: Na+, K+, Li+, F-. Cam Elektrot: E= E 0 c- 0. 06 loga. H+ E= E 0 c- 0. 06 log a. H+ E= E 0 c+0. 06 p. H

Cam elektrotlarda 2 tip hata olabilir: 1 -Asit Hatası: Çözelti p. H’ının 1 den küçük olduğu durumlarda gözlenir. 2 -Alkali Hatası: Çözelti p. H’ının 9 dan büyük olduğu durumlarda gözlenir.

Elektrometrik p. H Belirlenmesi (Hidrojen Elektrot ile) Hidrojen, Kinhidron, Cam elektrot gibi Ag/Ag. Cl, Kalomel elektrot karşılaştırma elektrodudur. Pt|H 2(1 atm), H+ (a. H+=? ) || KCl (doygun) Hg 2 Cl 2|Hg ANOT e. Hücre= e. Katot – e. Anot e. Hücre= 0, 247 – e. Anot KALOMEL ELEKTROT KATOT e. Anot = e. Hidrojen = e 0 + 0. 06/ 2 log | H+ |2 /PH 2 0. 0 V 1

e. Hücre= 0. 247 + 0. 06 log p. H = Kinhidron Elektrot: Ölçüm elektrodudur. Organik molekül yapılı bir kompleks olan kinhidron suda çözülünce eşdeğer konsantrasyonda hidrokinon (H 2 Q) ve kinon (Q) verir. Bu reaksiyon: 2 e- + Q+ 2 H 3 O+ H 2 Q+ 2 H 2 O E=E 0 + 0. 06/2 log |Q | |H 3 O + |2 / | H 2 Q | Suda çözülünce Q = H 2 Q olur. E=E 0 + 0. 06 log |H 3 O + | olur ve E=E 0 - 0. 06 p. H halini alır. Kinhidron elektrot için E 0 = 0. 6998 dır ve E= 0. 6998 - 0. 06 p. H olur.

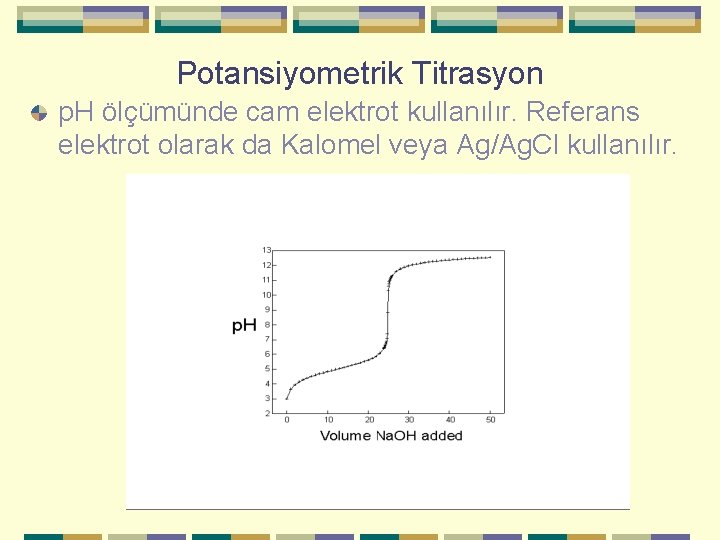
Potansiyometrik Titrasyon p. H ölçümünde cam elektrot kullanılır. Referans elektrot olarak da Kalomel veya Ag/Ag. Cl kullanılır.