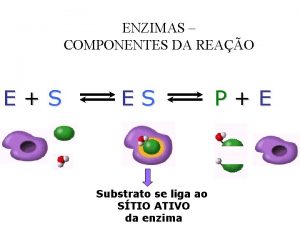
Per allestire un processo competitivo per la produzione
















- Slides: 21

Per allestire un processo competitivo per la produzione di aminoacidi per via microbica bisogna avere: • Microrganismo overproduttore o potenzialmente tale • Le conoscenze di base di biochimica, genetica e microbiologia del microrganismo per il suo miglioramento • Tecnica di fermentazione e di processo (fermentazioni batch o fed-batch, volumi elevati) • Downstream compatibile con l'ambiente (bassi costi di smaltimento, riciclo) 1. Separazione per centrifugazione o ultrafiltrazione (biomassa? ) 2. Evaporazione > cristallizzazione > filtrazione (acque madri? ) 3. Oppure resine > eluizione > cristallizzazione (eluenti? Acque madri? )

Amino acidi, basi azotate, vitamine … hanno vie biosintetiche soggette a regolazione feedback. La regolazione degli enzimi biosintetici può essere: • per INIBIZIONE • per REPRESSIONE Meccanismi di inibizione e repressione. Inibizione: azione del prodotto finale su uno dei primi enzimi della via biosintetica. In genere l’inibizione è allosterica, cioè il sito di regolazione è diverso dal sito catalitico, e non competitiva come quando i prodotti finali e iniziali sono simili e interagiscono con lo stesso sito (catalitico). Repressione: in genere esiste un gene R che codifica per un repressore R inattivo. In presenza del prodotto finale (il corepressore) il complesso R+corepressore diventa attivo e blocca la trascrizione del gene strutturale.




Vie biosintetiche LINEARI e vie RAMIFICATE La regolazione delle vie lineari avviene tramite l’unico prodotto finale. Le vie ramificate hanno più prodotti finali e tutti i prodotti finali possono esercitare la loro funzione regolativa sui primi passaggi della via biosintetica.

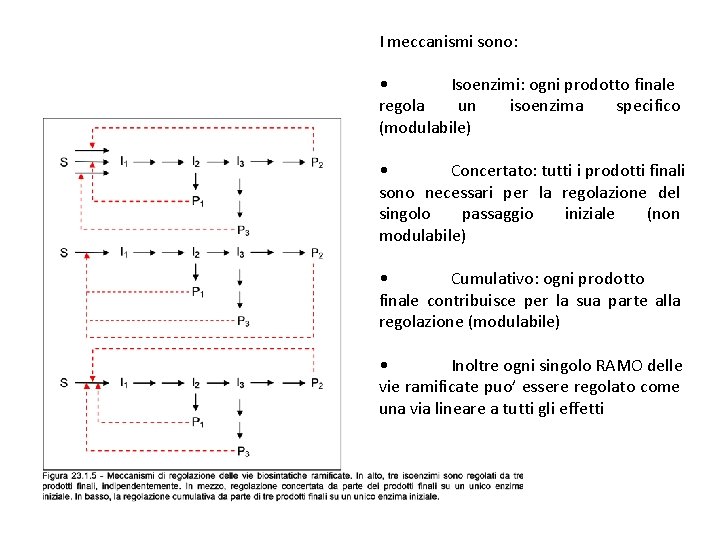
I meccanismi sono: • Isoenzimi: ogni prodotto finale regola un isoenzima specifico (modulabile) • Concertato: tutti i prodotti finali sono necessari per la regolazione del singolo passaggio iniziale (non modulabile) • Cumulativo: ogni prodotto finale contribuisce per la sua parte alla regolazione (modulabile) • Inoltre ogni singolo RAMO delle vie ramificate puo’ essere regolato come una via lineare a tutti gli effetti

Per aggirare il meccanismo regolativo esistono due possibilità: 1. 2. Diminuire la quantità della molecola regolatrice Alterare la sensibilità del sistema regolativo alla molecola regolatrice In entrambi i casi si fa ricorso a dei MUTANTI. I mutanti in cui la biosintesi dei prodotti non è più regolata, si chiamano COSTITUTIVI. Nel primo caso avremo dei mutanti AUXOTROFICI, cioè dei mutanti che hanno come esigenza nutrizionale proprio la molecola regolatrice che viene somministrata in quantità LIMITANTE (subottimale) in modo da permettere la crescita ma non la sua FUNZIONE REGOLATRICE. • I mutanti auxotrofici possono essere utilizzati sia per via lineari che per vie ramificate. • La massima efficacia per le vie ramificate si ha nel caso di meccanismi regolativi CONCERTATI.

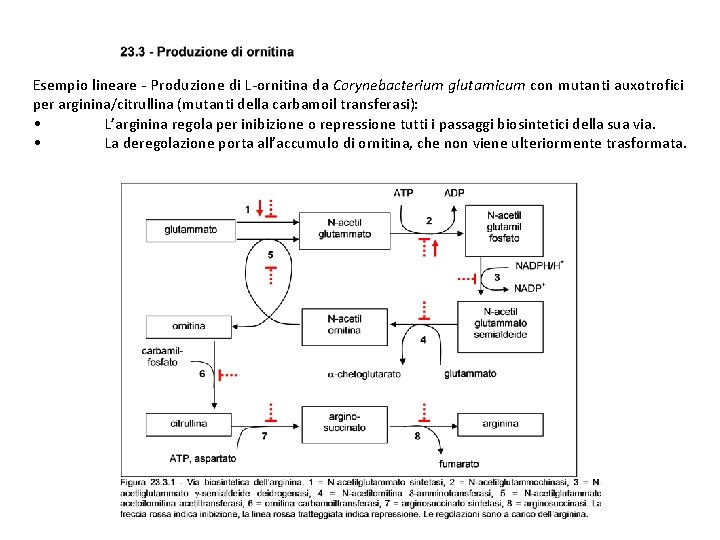
Esempio lineare - Produzione di L-ornitina da Corynebacterium glutamicum con mutanti auxotrofici per arginina/citrullina (mutanti della carbamoil transferasi): • L’arginina regola per inibizione o repressione tutti i passaggi biosintetici della sua via. • La deregolazione porta all’accumulo di ornitina, che non viene ulteriormente trasformata.

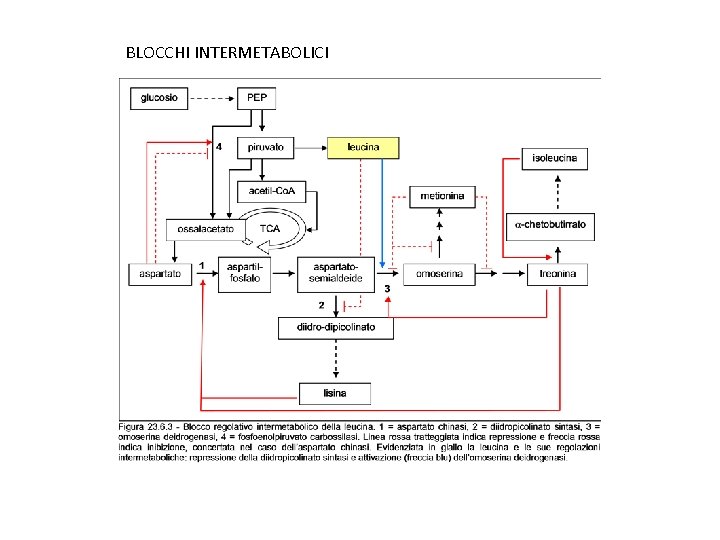
Esempio ramificato - Produzione di lisina da Corynebacterium glutamicum o Brevibacterium flavum: il ceppo selvatico non produce lisina, per cui si fa ricorso a mutanti auxotrofici, regolativi o entrambi. Esempio: mutanti auxotrofici per omoserina (mutanti della omoserina deidrogenasi, che sono anche auxotrofici per treonina, metionina e isoleucina, lucido): • La regolazione dell’ aspartato kinasi è CONCERTATA da lisina e treonina. • L’accumulo di lisina è consentito anche dal fatto che la diidropicolinato (DHP) sintasi NON E’ REGOLATA da lisina. • In E. coli ci sono invece tre aspartato kinasi, regolate individualmente da lisina, treonina e metionina (isoenzimi) e la DHP sintasi è’ inibita da lisina: la sovrapproduzione di lisina non è possibile.



Possiamo avere due tipi di mutanti REGOLATIVI (alterati nella sensibilità della via metabolica alla molecola regolatrice): • REVERTENTI desensibilizzati di mutanti auxotrofici, in cui la prima mutazione ha inattivato l’enzima e la seconda ha restituito l’ attività ma l’enzima ha perso la sensibilità al regolatore • Mutanti con enzimi INSENSIBILI alla regolazione (inibizione o repressione) ottenuti per selezione con ANALOGHI TOSSICI della molecola regolatrice. L’aa viene utilizzato sia nel circuito regolativo sia per la sintesi delle proteine. L’ analogo è invece attivo come regolatore ma le proteine che lo contengono sono inattive (da qui la tossicità). In presenza di analogo, la via biosintetica dell’aa è inibita/repressa e non si hanno proteine funzionali → no crescita (se aggiungo aa si ripristina la crescita: sintesi di proteine funzionali). Nei MUTANTI RESISTENTI, in presenza di analogo, si ripristina la via biosintetica: gli aa endogeni vengono usati per la sintesi di proteine attiva e si ha crescita. La via biosintetica, nei mutanti resistenti, è insensibile sia all’analogo che all’aa, e ciò permette l’accumulo dell’ aa prodotto.


Esempio: produzione di LISINA • La SAEC è stata usata per isolare mutanti di Brevibacterium flavum con aspartato kinasi insensibili a lisina • Mutanti resistenti ad analoghi possono essere usati anche in combinazione con altri mutanti. Ad es. si può incrementare la produzione di lisina usando doppi mutanti SAECR e auxotrofici per omoserina • In certi casi si possono avere dei blocchi regolativi intermetabolici. Ad es. in Brevibacterium lactofermentum la leucina (sintetizzata da una via diversa, dal piruvato) reprime la DHP sintasi. La combinazione di mutazione SAECR (aspartato kinasi deregolata) con auxotrofia per la leucina (DHP sintasi derepressa) comporta un aumento di produzione di lisina • Genetica: ormai tutti i geni biosintetici sono stati clonati, amplificati ed espressi per aumentare la produzione (dosaggio genico, espressione deregolata etc). Quindi oltre ai mutanti auxotrofici e regolativi sono disponibili dei ceppi geneticamente ingegnerizzati. Es: dap. A (diidropicolinato sintasi) in multicopia aumenta del 35% la produzione • Produzioni attuali: fino a 120 g/L in processi fed-batch

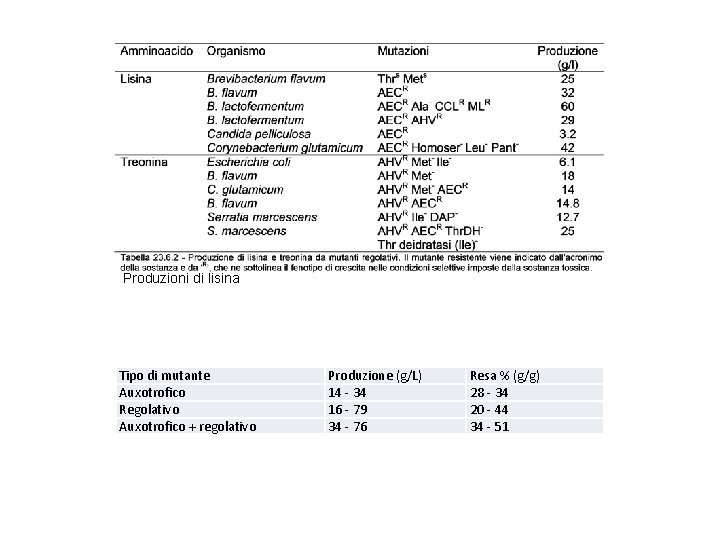
Produzioni di lisina Tipo di mutante Auxotrofico Regolativo Auxotrofico + regolativo Produzione (g/L) 14 - 34 16 - 79 34 - 76 Resa % (g/g) 28 - 34 20 - 44 34 - 51

BLOCCHI INTERMETABOLICI

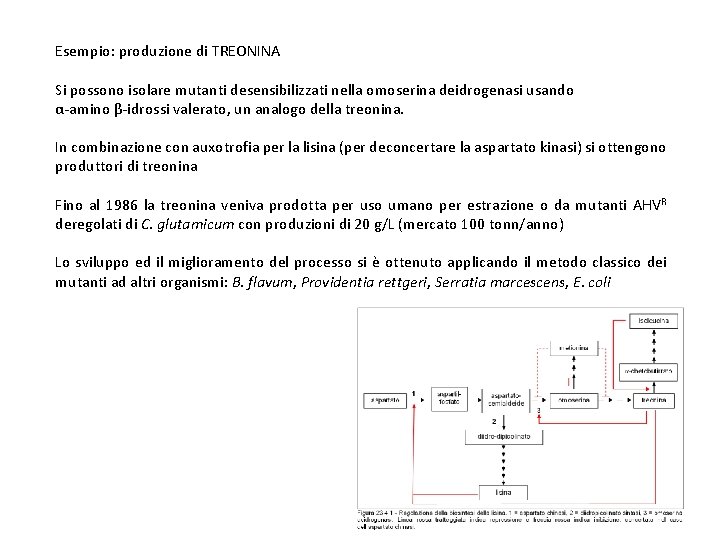
Esempio: produzione di TREONINA Si possono isolare mutanti desensibilizzati nella omoserina deidrogenasi usando α-amino β-idrossi valerato, un analogo della treonina. In combinazione con auxotrofia per la lisina (per deconcertare la aspartato kinasi) si ottengono produttori di treonina Fino al 1986 la treonina veniva prodotta per uso umano per estrazione o da mutanti AHVR deregolati di C. glutamicum con produzioni di 20 g/L (mercato 100 tonn/anno) Lo sviluppo ed il miglioramento del processo si è ottenuto applicando il metodo classico dei mutanti ad altri organismi: B. flavum, Providentia rettgeri, Serratia marcescens, E. coli


In particolare E. coli è migliore produttore di C. glutamicum, anche se più strettamente regolato (mappa metabolica). E. coli è particolarmente adatto allo sviluppo di produttori geneticamente ingegnerizzati. Es ceppi trasformati con l'operone biosintetico thr A, B e C su plasmide o integrato, fusione con promotori forti/deregolati > produzioni elevate (tabella) Attualmente produzioni di 80 g/L (10. 000 tonn/anno) > abbassamento dei costi > uso del prodotto anche in campo animale

 Fonti produzione
Fonti produzione Inibio
Inibio Inibidor competitivo e não competitivo
Inibidor competitivo e não competitivo Inibição
Inibição Cellulosa carta
Cellulosa carta Tassazione premi produzione
Tassazione premi produzione Programma di produzione
Programma di produzione Distinta base di produzione
Distinta base di produzione Equazione tornaconto
Equazione tornaconto Risultato
Risultato Celebrex ritirato dal commercio
Celebrex ritirato dal commercio Elencare i sistemi a regole di produzione
Elencare i sistemi a regole di produzione Fonti di produzione
Fonti di produzione Gestionale produzione calzature
Gestionale produzione calzature Budget di produzione
Budget di produzione Master produzione tv
Master produzione tv Distinta base di produzione
Distinta base di produzione Sfibratore carta
Sfibratore carta Che cos'è l'agenda 2030
Che cos'è l'agenda 2030 Distinta base
Distinta base Scaletta sceneggiatura esempio
Scaletta sceneggiatura esempio Il diamante di porter
Il diamante di porter