O 2 Kyslk Prvok nevyhnutn pre existenciu ivota



- Slides: 8

O 2 - Kyslík Prvok nevyhnutný pre existenciu života na našej planéte.

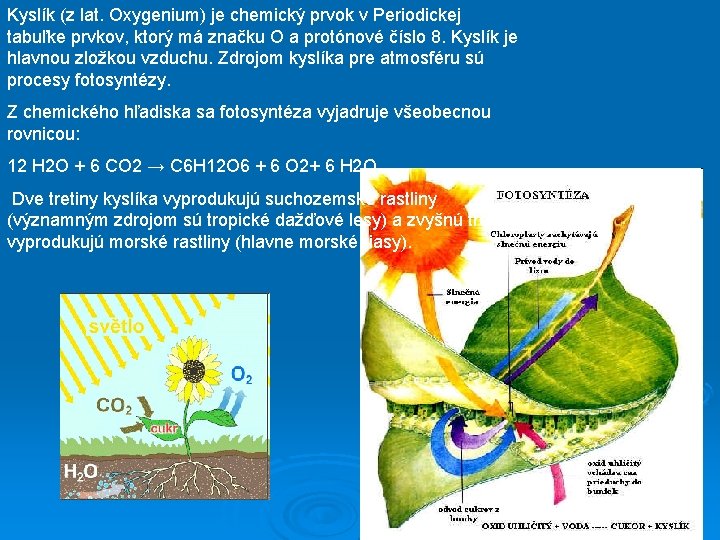
Kyslík (z lat. Oxygenium) je chemický prvok v Periodickej tabuľke prvkov, ktorý má značku O a protónové číslo 8. Kyslík je hlavnou zložkou vzduchu. Zdrojom kyslíka pre atmosféru sú procesy fotosyntézy. Z chemického hľadiska sa fotosyntéza vyjadruje všeobecnou rovnicou: 12 H 2 O + 6 CO 2 → C 6 H 12 O 6 + 6 O 2+ 6 H 2 O Dve tretiny kyslíka vyprodukujú suchozemské rastliny (významným zdrojom sú tropické dažďové lesy) a zvyšnú tretinu vyprodukujú morské rastliny (hlavne morské riasy).

Charakteristika: Pri štandartnej teplote a tlaku, sa kyslík vyskytuje ako dvojatómová molekula O 2, v ktorej sú dva kyslíkové atómy spojené medzi sebou. Kyslík je bezfarebný plyn. V kvapalnom a tuhom stave má svetlomodrú farbu. Vo vode je slabo rozpustný. Táto skutočnosť má veľký význam, pre život vodných organizmov, pretože im umožňuje dýchanie. Kyslík je veľmi reaktívny prvok. Reakcie zlučovania kyslíka s látkami sú najčastejšie exotermické.

Na Zemi sa najčastejšie vyskytuje kyslík ako dioxygén (dvojatómová molekula O 2). V atmosfére tvorí plynný kyslík 21 objemových %. Voda oceánov, ktorá pokrýva 2/3 zemského povrchu je hmotnostne zložená z 86 % kyslíka. V zemskej kôre je kyslík majoritným prvkom, je prítomný takmer vo všetkých horninách. Jeho obsah je odhadovaný na 46 – 50 hmotnostných %. V hlbších vrstvách zemského telesa zastúpenie kyslíka klesá a predpokladá sa, že v zemskom jadre je prítomný iba v stopách. Vo vesmíre je zastúpenie kyslíka podstatne nižšie. Na 1 000 atómov vodíka pripadá iba jeden atóm kyslíka. Okrem zvyčajných dvojatómových molekúl O 2 sa kyslík vyskytuje aj vo forme trojatómovej molekuly ako ozón O 3. Za normálnych podmienok je to vysoko reaktívny plyn modrej farby a charakteristického zápachu s mimoriadne silnými oxidačnými účinkami.

Využitie: • V medicíne slúži k sterilizácii nástrojov, pri operáciách a traumatických stavoch pre podporu pacientovho dýchania. • Baktericídne účinky ozónu slúži k dezinfekcii pitnej vody namiesto predtým často využívanej dezinfekcie vody plynných chlórom alebo chlórnanom. • Silné oxidačné účinky ozónu sa veľmi často využívajú v papierenskom priemysle k bieleniu celulózy pre výrobu papiera. • Zmesi kyslíka s inertnými plynmi slúžia potápačom k utlmeniu kesónovej choroby pri ponoroch do veľkých hĺbok. • Pri horení zmesi kyslíka s vodíkom možno dosiahnuť teploty viac ako 3 000 °C. Preto sa kyslíkovo-vodíkový plameň využíva na rezanie oceli a tavenie kovov s vysokým bodom topenia, napr. platinových kovov. • Základnou požiadavkou pri výrobe oceli je odstrániť zo železa uhlík. Tzv. Bessemerov spôsob výroby je založený na vháňaní čistého kyslíka do roztaveného železa v konvertore. Pri vysokej teplote taveniny dôjde k oxidácii prítomného grafitového uhlíka na plynné oxidy, ktoré z taveniny vytekajú.

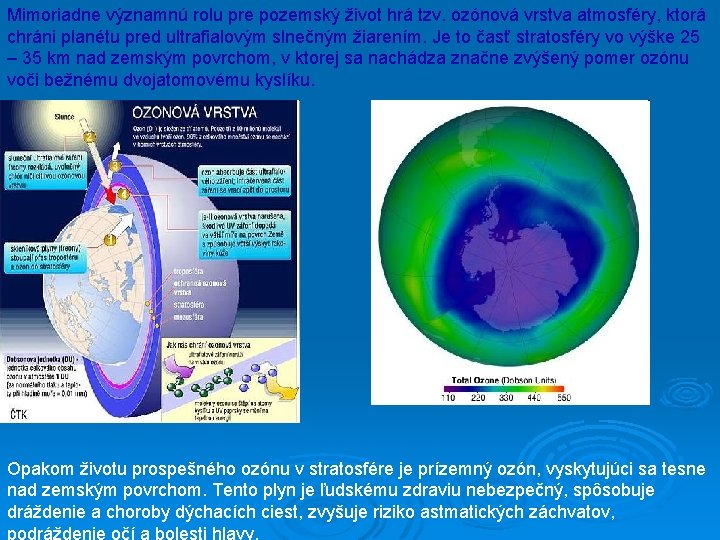
Mimoriadne významnú rolu pre pozemský život hrá tzv. ozónová vrstva atmosféry, ktorá chráni planétu pred ultrafialovým slnečným žiarením. Je to časť stratosféry vo výške 25 – 35 km nad zemským povrchom, v ktorej sa nachádza značne zvýšený pomer ozónu voči bežnému dvojatomovému kyslíku. Opakom životu prospešného ozónu v stratosfére je prízemný ozón, vyskytujúci sa tesne nad zemským povrchom. Tento plyn je ľudskému zdraviu nebezpečný, spôsobuje dráždenie a choroby dýchacích ciest, zvyšuje riziko astmatických záchvatov, podráždenie očí a bolesti hlavy.

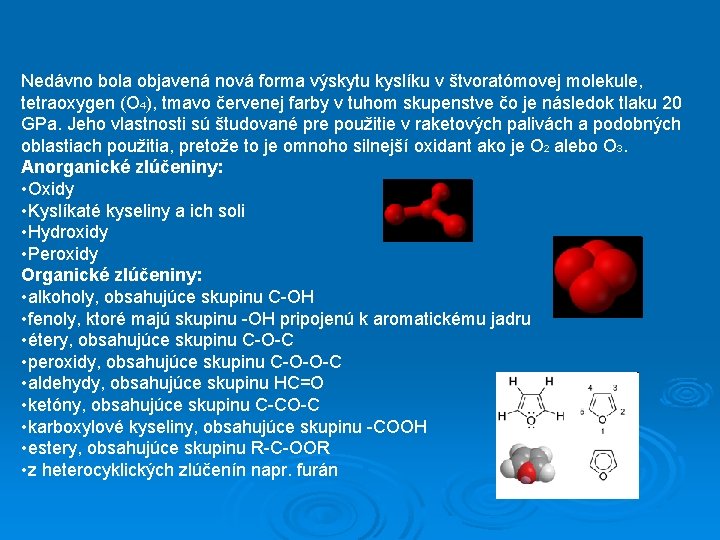
Nedávno bola objavená nová forma výskytu kyslíku v štvoratómovej molekule, tetraoxygen (O 4), tmavo červenej farby v tuhom skupenstve čo je následok tlaku 20 GPa. Jeho vlastnosti sú študované pre použitie v raketových palivách a podobných oblastiach použitia, pretože to je omnoho silnejší oxidant ako je O 2 alebo O 3. Anorganické zlúčeniny: • Oxidy • Kyslíkaté kyseliny a ich soli • Hydroxidy • Peroxidy Organické zlúčeniny: • alkoholy, obsahujúce skupinu C-OH • fenoly, ktoré majú skupinu -OH pripojenú k aromatickému jadru • étery, obsahujúce skupinu C-O-C • peroxidy, obsahujúce skupinu C-O-O-C • aldehydy, obsahujúce skupinu HC=O • ketóny, obsahujúce skupinu C-CO-C • karboxylové kyseliny, obsahujúce skupinu -COOH • estery, obsahujúce skupinu R-C-OOR • z heterocyklických zlúčenín napr. furán

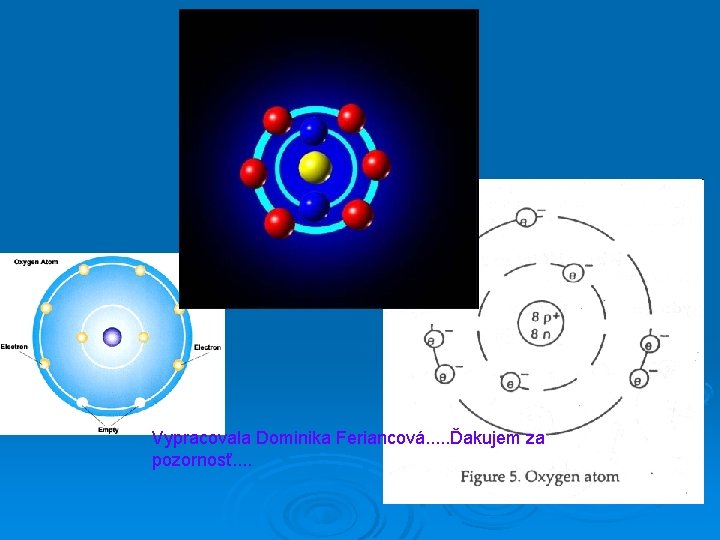
Vypracovala Dominika Feriancová. . . Ďakujem za pozornosť. .