ltalnos festsi s immunhisztokmiai mdszerek Makromolekulk azonostsa szvettani


















- Slides: 42

Általános festési és immunhisztokémiai módszerek Makromolekulák azonosítása szövettani metszeteken Dr. Bódi Ildikó Semmelweis Egyetem Anatómiai, Szövet- és Fejlődéstani Intézet Egészségügyi Ügyvitelszervező szak 2018. 12.

Mikrotechnikai alapismeretek Cél: a biológiai anyag mikroszkópos megfigyelése Előkészítő eljárások szükségesek kellő vékonyságú (átvilágítható) metszetek létrehozása kontrasztosítás illetve festés Fontos: Az előkészítési folyamatok során az elő anyag strukturális és funkcionális sajtságainak megőrzése, a lehető legkevesebb torzulás előidézése.

Minta előkészítés lépései: 1. ) Fixálás (anyagpreparálás és rögzítés): az élő anyag strukturális és kémiai stabilizálása (immerziós vagy perfúziós) 2. ) Kimosás: a rögzítőszer eltávolítása vízzel, vagy egyéb oldószerrel 3. ) Víztelenítés (dehidrálás): a szövet víztartalmának vízelvonószerekkel történő kivonása és azokkal való helyettesítése abból a célból, hogy a biológiai anyag a nem vízoldékony, többnyire nagy viszkozitású beágyazóanyagokkal, illetve azok szerves oldószereivel (=intermedier anyagok) átitatható legyen. Utána derítés xilol-lal 4. ) Beágyazás: a vizsgálandó anyag folyékony beágyazószerekkel történő átitatása és a beágyazásra használt közeg kikeményítése. A kikeményített, beágyazószerrel átitatott és körülvett anyagot nevezik blokknak. A blokk mechanikai tulajdonságai olyanok, hogy belőle megfelelő vékonyságú metszetek nyerhetők 5. ) Metszet készítés: a blokk felszeletelése a vizsgálat céljából és az alkalmazott mikroszkóp fajtájától függően a kívánt vastagságban mikrotom-mal 6. ) A metszetek festése: a szövetelemek fény–, illetve elektronszórásbeli különbségeinek növelése 7. ) Lefedés: elzárni a levegőtől a metszetet, üveggel történő lefedéssel

Fixálás Fénymikroszkóp Elektronmikroszkóp 4 -10% formaldehid 4% formaldehid és/vagy 2% glutáraldehid Utófixálás Víztelenítés Ozmiumsavval Felszálló alkoholsor 50%, 70%, 80%, 96%, absz. Etanol Intermedium Xilol Propilénoxid Beágyazás Paraffin Műgyanta Metszés Átitatás olvasztott parafinnal, kiöntés formába Mikrotóm, 5 -10 µm vastag metszetek Tárgylemezre vesszük fel Kiöntés formába, gyanta polimerizálása hővel Ultramikrotom, 50 -70 nm-es Ultravékony metszetek szürke (40– 50 nm), ezüst (50– 70 nm), arany (70– 90 nm) színűek. Gridre vesszük fel Paraffin kioldása Festés Különböző eljárások Lásd következő diák Kontrasztosítás Uranilacetát, ólomacetát

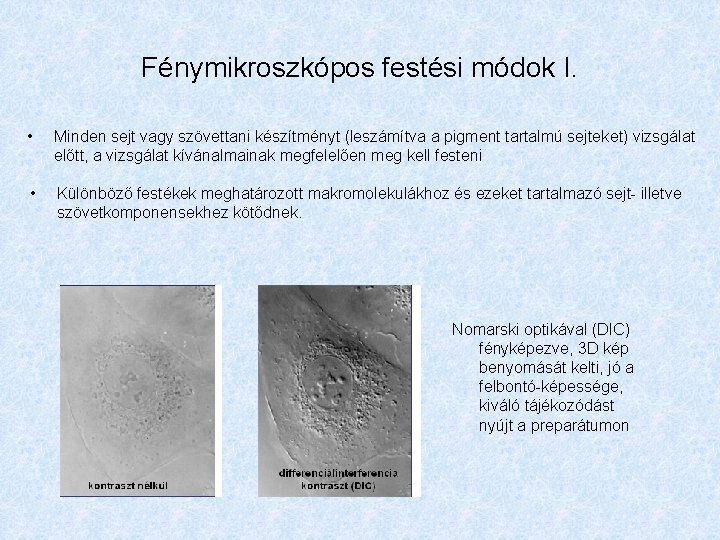
Fénymikroszkópos festési módok I. • Minden sejt vagy szövettani készítményt (leszámítva a pigment tartalmú sejteket) vizsgálat előtt, a vizsgálat kívánalmainak megfelelően meg kell festeni • Különböző festékek meghatározott makromolekulákhoz és ezeket tartalmazó sejt- illetve szövetkomponensekhez kötődnek. Nomarski optikával (DIC) fényképezve, 3 D kép benyomását kelti, jó a felbontó-képessége, kiváló tájékozódást nyújt a preparátumon

Fénymikroszkópos festési módok II. Vitális festés: A festék a sejtek által felvehető, azt nem pusztítja el, viszont egyes organellumokat megfest. Általános festés: pl. H-E. Általános, áttekintő jellegű a festés, a szövet minden részét megfesti, nem maradnak festetlen területek. Trikróm festés: A festési eljárás során három festékkel is megfestjük a metszetünket. Specifikus eljárások→hisztokémiai eljárások: fehérjék, enzimek, egyes ionok stb. szöveti lokalizációjának meghatározása.

Néhány alapfogalom Bázikus festék: Kationokaban gazdag festék. A sejtek, szövetek savas természetű (szabad negatív gyököt tartalmazó) komponenseihez kötődik. Pl: Hematoxilin, toluidinkék, metilénkék. Bazofil anyag: bázikus festékkel színezhető struktúrák összefoglaló neve. Bazofil festődés: A bazofil anyag és bázikus festék reakciójának pozitív eredménye. p. Hfüggő jelenség. Acidofil anyag: savas jellegű festékkel színezhető. Acidofil festődés: acidofil anyag és savas festék pozitív eredménye. Szintén p. H függő. Eozinofília: Acidofílián belül megkülönböztetjük az eozinnal történő festést. Metakromázia: A festék bizonyos komponenseket a saját színétől eltérő színnel fest meg. Ortokromázia: A festék bizonyos komponenseket a saját színével megegyezőre fest (max. az árnyalat más. )

Általános festések (áttekintő festések)

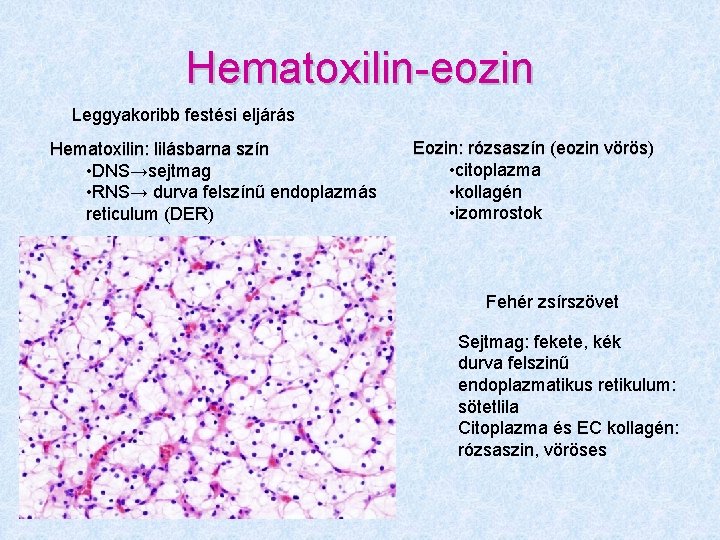
Hematoxilin-eozin Leggyakoribb festési eljárás Hematoxilin: lilásbarna szín • DNS→sejtmag • RNS→ durva felszínű endoplazmás reticulum (DER) Eozin: rózsaszín (eozin vörös) • citoplazma • kollagén • izomrostok Fehér zsírszövet Sejtmag: fekete, kék durva felszinű endoplazmatikus retikulum: sötetlila Citoplazma és EC kollagén: rózsaszin, vöröses

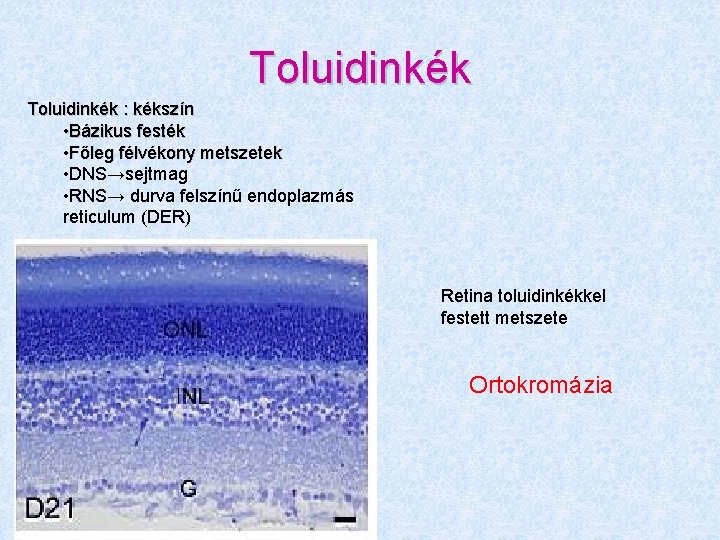
Toluidinkék : kékszín • Bázikus festék • Főleg félvékony metszetek • DNS→sejtmag • RNS→ durva felszínű endoplazmás reticulum (DER) Retina toluidinkékkel festett metszete Ortokromázia

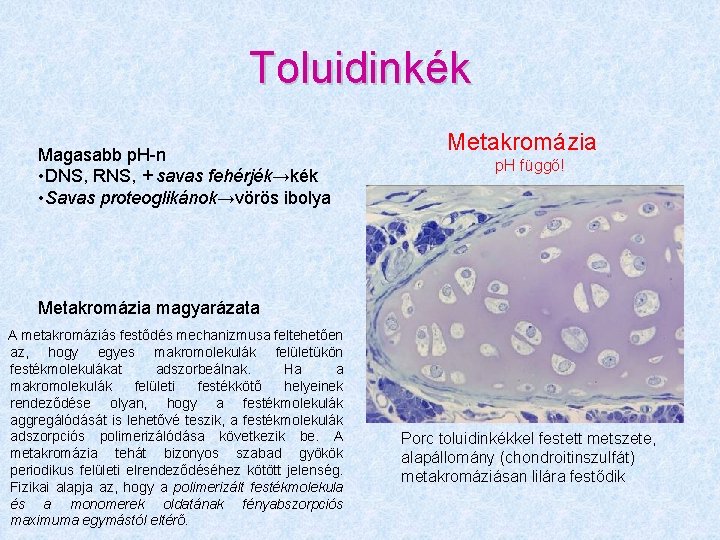
Toluidinkék Magasabb p. H-n • DNS, RNS, + savas fehérjék→kék • Savas proteoglikánok→vörös ibolya Metakromázia p. H függő! Metakromázia magyarázata A metakromáziás festődés mechanizmusa feltehetően az, hogy egyes makromolekulák felületükön festékmolekulákat adszorbeálnak. Ha a makromolekulák felületi festékkötő helyeinek rendeződése olyan, hogy a festékmolekulák aggregálódását is lehetővé teszik, a festékmolekulák adszorpciós polimerizálódása következik be. A metakromázia tehát bizonyos szabad gyökök periodikus felületi elrendeződéséhez kötött jelenség. Fizikai alapja az, hogy a polimerizált festékmolekula és a monomerek oldatának fényabszorpciós maximuma egymástól eltérő. Porc toluidinkékkel festett metszete, alapállomány (chondroitinszulfát) metakromáziásan lilára festődik

Speciális festések (makromulekulák kimutatása)

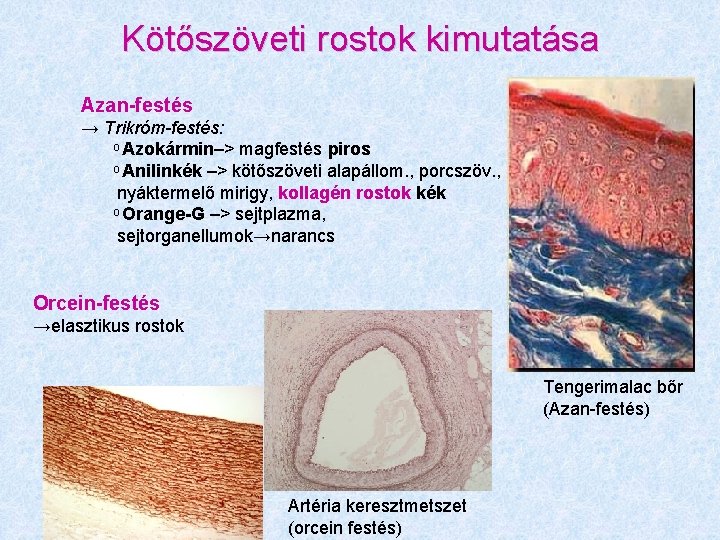
Kötőszöveti rostok kimutatása Azan-festés → Trikróm-festés: Azokármin–> magfestés piros Anilinkék –> kötőszöveti alapállom. , porcszöv. , nyáktermelő mirigy, kollagén rostok kék Orange-G –> sejtplazma, sejtorganellumok→narancs Orcein-festés →elasztikus rostok Tengerimalac bőr (Azan-festés) Artéria keresztmetszet (orcein festés)

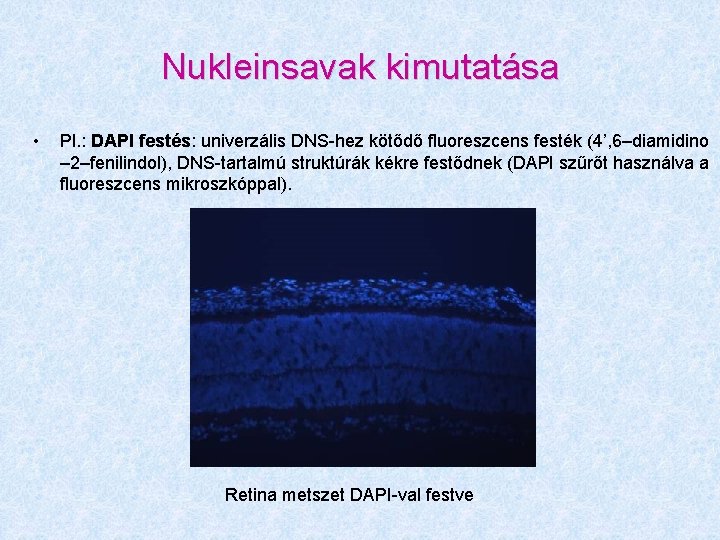
Nukleinsavak kimutatása • Pl. : DAPI festés: univerzális DNS-hez kötődő fluoreszcens festék (4’, 6–diamidino – 2–fenilindol), DNS-tartalmú struktúrák kékre festődnek (DAPI szűrőt használva a fluoreszcens mikroszkóppal). Retina metszet DAPI-val festve

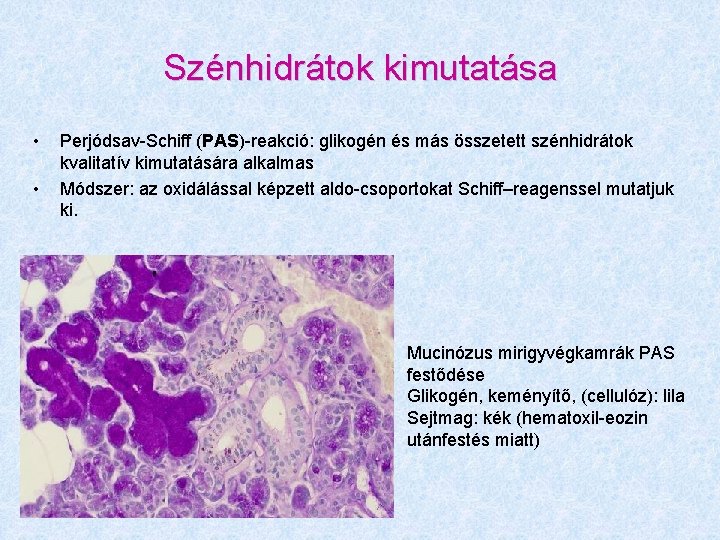
Szénhidrátok kimutatása • • Perjódsav-Schiff (PAS)-reakció: glikogén és más összetett szénhidrátok kvalitatív kimutatására alkalmas Módszer: az oxidálással képzett aldo-csoportokat Schiff–reagenssel mutatjuk ki. Mucinózus mirigyvégkamrák PAS festődése Glikogén, keményítő, (cellulóz): lila Sejtmag: kék (hematoxil-eozin utánfestés miatt)

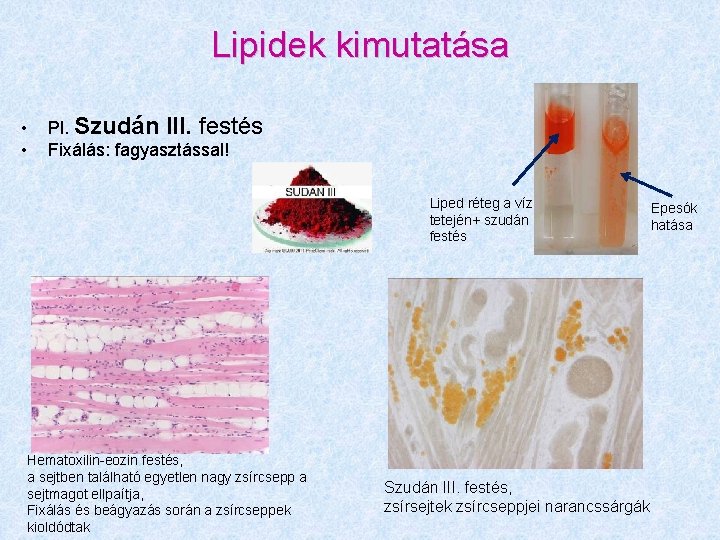
Lipidek kimutatása • • Pl. Szudán III. festés Fixálás: fagyasztással! Liped réteg a víz tetején+ szudán festés Hematoxilin-eozin festés, a sejtben található egyetlen nagy zsírcsepp a sejtmagot ellpaítja, Fixálás és beágyazás során a zsírcseppek kioldódtak Szudán III. festés, zsírsejtek zsírcseppjei narancssárgák Epesók hatása

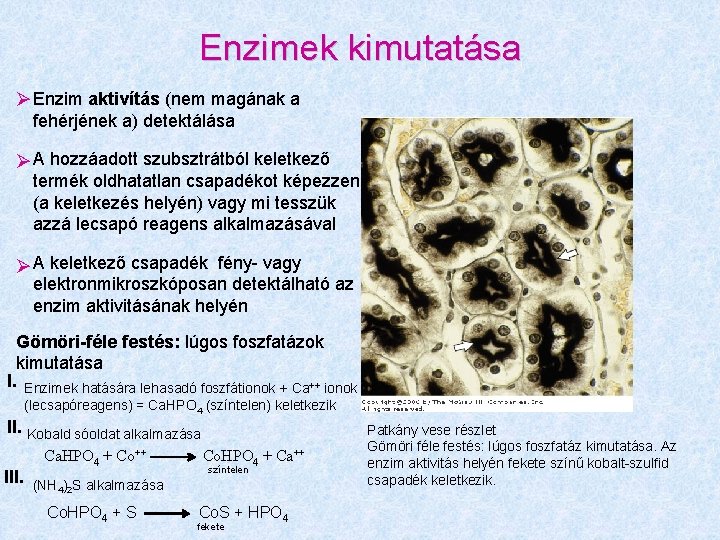
Enzimek kimutatása Enzim aktivítás (nem magának a fehérjének a) detektálása A hozzáadott szubsztrátból keletkező termék oldhatatlan csapadékot képezzen (a keletkezés helyén) vagy mi tesszük azzá lecsapó reagens alkalmazásával A keletkező csapadék fény- vagy elektronmikroszkóposan detektálható az enzim aktivitásának helyén Gömöri-féle festés: lúgos foszfatázok kimutatása I. Enzimek hatására lehasadó foszfátionok + Ca++ ionok (lecsapóreagens) = Ca. HPO 4 (színtelen) keletkezik II. Kobald sóoldat alkalmazása III. Ca. HPO 4 + Co++ Co. HPO 4 + Ca++ színtelen (NH 4)2 S alkalmazása Co. HPO 4 + S Co. S + HPO 4 fekete Patkány vese részlet Gömöri féle festés: lúgos foszfatáz kimutatása. Az enzim aktivitás helyén fekete színű kobalt-szulfid csapadék keletkezik.

Elektronmikroszkópos kontrasztosítás

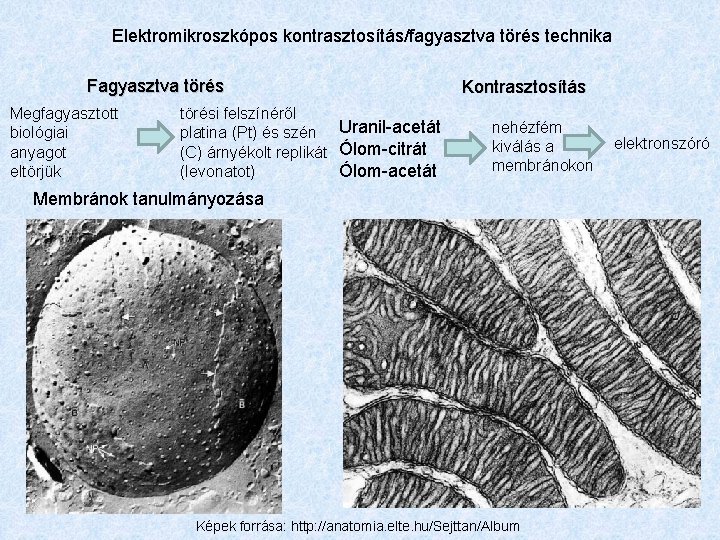
Elektromikroszkópos kontrasztosítás/fagyasztva törés technika Fagyasztva törés Megfagyasztott biológiai anyagot eltörjük törési felszínéről platina (Pt) és szén Uranil-acetát (C) árnyékolt replikát Ólom-citrát Ólom-acetát (levonatot) Kontrasztosítás nehézfém kiválás a membránokon Membránok tanulmányozása Képek forrása: http: //anatomia. elte. hu/Sejttan/Album elektronszóró

Immunhisztokémia és immuncitokémia (a „keresett” fehérje kimutatása → sejttípusazonosítás)

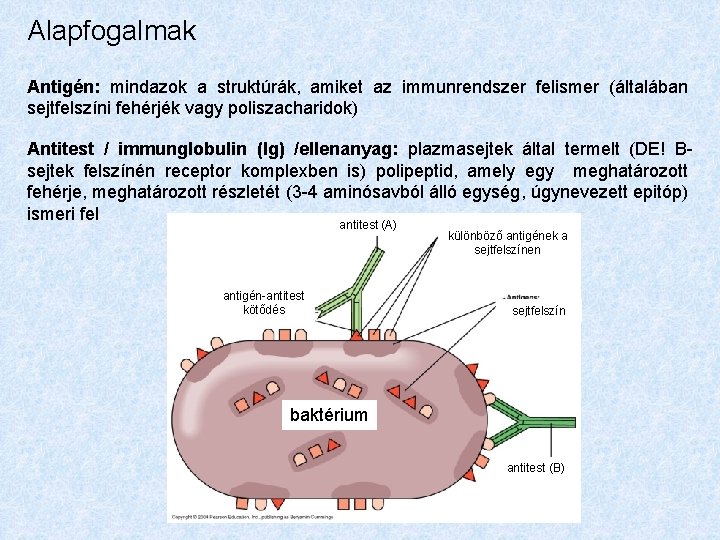
Alapfogalmak Antigén: mindazok a struktúrák, amiket az immunrendszer felismer (általában sejtfelszíni fehérjék vagy poliszacharidok) Antitest / immunglobulin (Ig) /ellenanyag: plazmasejtek által termelt (DE! Bsejtek felszínén receptor komplexben is) polipeptid, amely egy meghatározott fehérje, meghatározott részletét (3 -4 aminósavból álló egység, úgynevezett epitóp) ismeri fel antitest (A) különböző antigének a sejtfelszínen antigén-antitest kötődés sejtfelszín baktérium antitest (B)

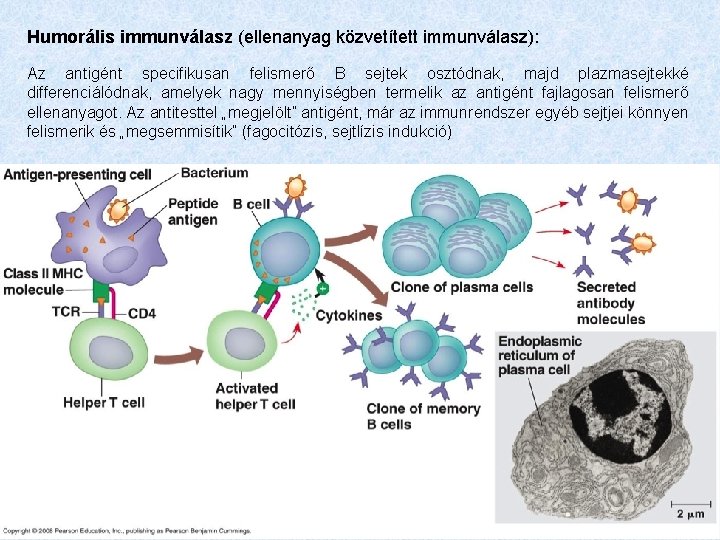
Humorális immunválasz (ellenanyag közvetített immunválasz): Az antigént specifikusan felismerő B sejtek osztódnak, majd plazmasejtekké differenciálódnak, amelyek nagy mennyiségben termelik az antigént fajlagosan felismerő ellenanyagot. Az antitesttel „megjelölt” antigént, már az immunrendszer egyéb sejtjei könnyen felismerik és „megsemmisítik” (fagocitózis, sejtlízis indukció)

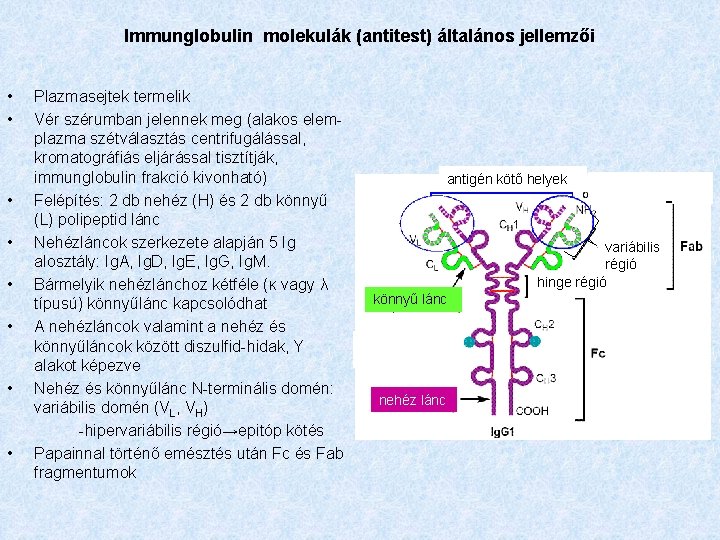
Immunglobulin molekulák (antitest) általános jellemzői • • Plazmasejtek termelik Vér szérumban jelennek meg (alakos elemplazma szétválasztás centrifugálással, kromatográfiás eljárással tisztítják, immunglobulin frakció kivonható) Felépítés: 2 db nehéz (H) és 2 db könnyű (L) polipeptid lánc Nehézláncok szerkezete alapján 5 Ig alosztály: Ig. A, Ig. D, Ig. E, Ig. G, Ig. M. Bármelyik nehézlánchoz kétféle (κ vagy λ típusú) könnyűlánc kapcsolódhat A nehézláncok valamint a nehéz és könnyűláncok között diszulfid-hidak, Y alakot képezve Nehéz és könnyűlánc N-terminális domén: variábilis domén (VL, VH) -hipervariábilis régió→epitóp kötés Papainnal történő emésztés után Fc és Fab fragmentumok antigén kötő helyek variábilis régió hinge régió könnyű lánc nehéz lánc

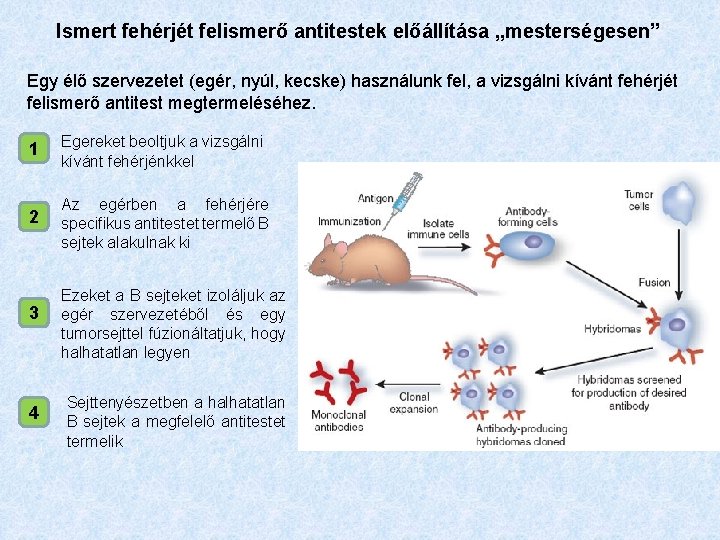
Ismert fehérjét felismerő antitestek előállítása „mesterségesen” Egy élő szervezetet (egér, nyúl, kecske) használunk fel, a vizsgálni kívánt fehérjét felismerő antitest megtermeléséhez. 1 Egereket beoltjuk a vizsgálni kívánt fehérjénkkel 2 Az egérben a fehérjére specifikus antitestet termelő B sejtek alakulnak ki 3 4 Ezeket a B sejteket izoláljuk az egér szervezetéből és egy tumorsejttel fúzionáltatjuk, hogy halhatatlan legyen Sejttenyészetben a halhatatlan B sejtek a megfelelő antitestet termelik

Immunhisztokémiai és immuncitokémia Alkalmazása: Konkrét fehérje lokalizációjának / vizualizációjának vizsgálatára alkalmas. Szerv, szövet, sejttenyészet szinten (fény-, és konfokális mikroszkóphoz) → immunhisztokémiai; szubcelluláris szinten (elektronmikroszkópos detektálás) → immuncitokémiai Módszer: antigén-antitest kapcsolódásán alapul Előnye: magas specifitás, mert antigén-antitest kapcsolódáson alapszik Hátránya: A kötött ellenanyag mikroszkópban nem látható, jelölni kell egy mikroszkóposan is felismerhető jelzőanyaggal, „elő kell hívni” (fluorokróm, enzim, kolloidális aranyszemcse) Alapvetően minőségi paraméterek meghatározása, de denzitometria segítségével mennyiségi paraméterek is mérhetőek ,

Immunhisztokémiai jelöléshez szükség van: Preparátum / metszett Keresett fehérje (antigén) Ellenanyag más néven antitest (a keresett antigént specifikusan ismeri fel) Kromogén (jelmolekula) Megfelelő mikroszkóp

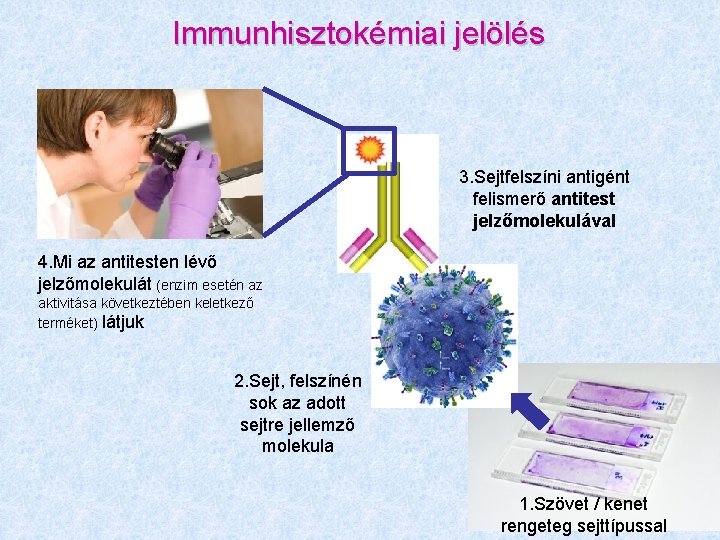
Immunhisztokémiai jelölés 3. Sejtfelszíni antigént felismerő antitest jelzőmolekulával 4. Mi az antitesten lévő jelzőmolekulát (enzim esetén az aktivitása következtében keletkező terméket) látjuk 2. Sejt, felszínén sok az adott sejtre jellemző molekula 1. Szövet / kenet rengeteg sejttípussal

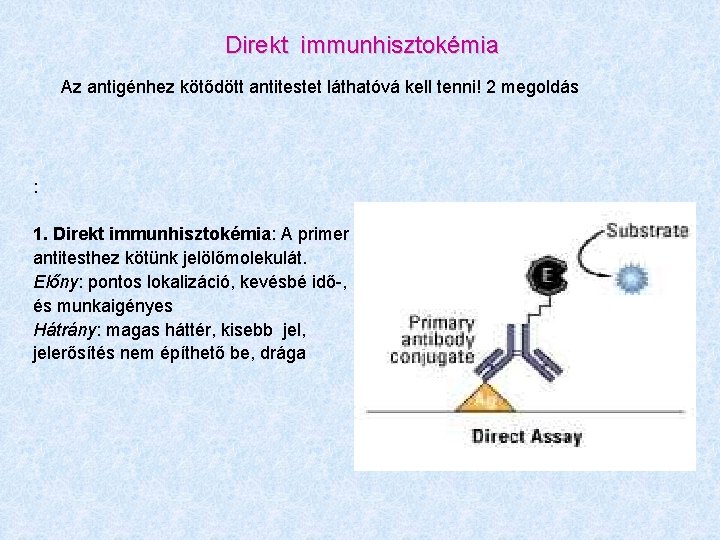
Direkt immunhisztokémia Az antigénhez kötődött antitestet láthatóvá kell tenni! 2 megoldás : 1. Direkt immunhisztokémia: A primer antitesthez kötünk jelölőmolekulát. Előny: pontos lokalizáció, kevésbé idő-, és munkaigényes Hátrány: magas háttér, kisebb jel, jelerősítés nem építhető be, drága

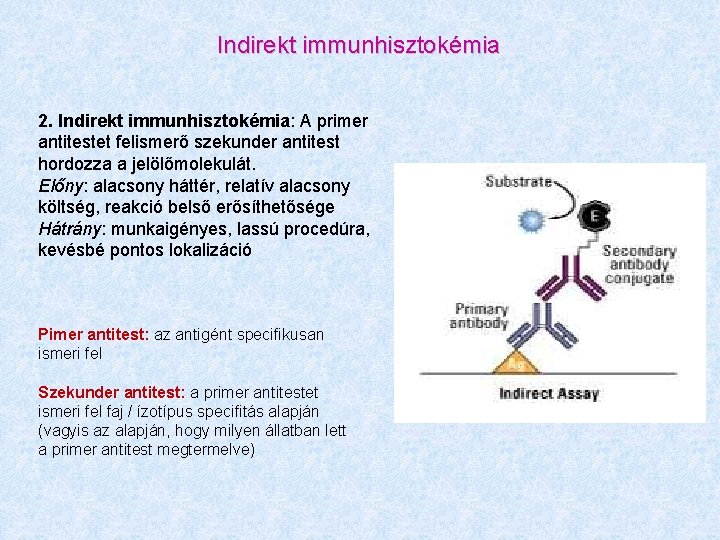
Indirekt immunhisztokémia 2. Indirekt immunhisztokémia: A primer antitestet felismerő szekunder antitest hordozza a jelölőmolekulát. Előny: alacsony háttér, relatív alacsony költség, reakció belső erősíthetősége Hátrány: munkaigényes, lassú procedúra, kevésbé pontos lokalizáció Pimer antitest: az antigént specifikusan ismeri fel Szekunder antitest: a primer antitestet ismeri fel faj / ízotípus specifitás alapján (vagyis az alapján, hogy milyen állatban lett a primer antitest megtermelve)

Immunhisztokémiai reakciók előhívása (jelölő molekulák) • Fluorokrómok • Enzimek Közvetlenül kapcsolt Közvetetten biotin által (ABC komplex) • Immunaranya Direkt jelölés esetén: primer antitest Indirekt jelölés esetén: szecunder antitest

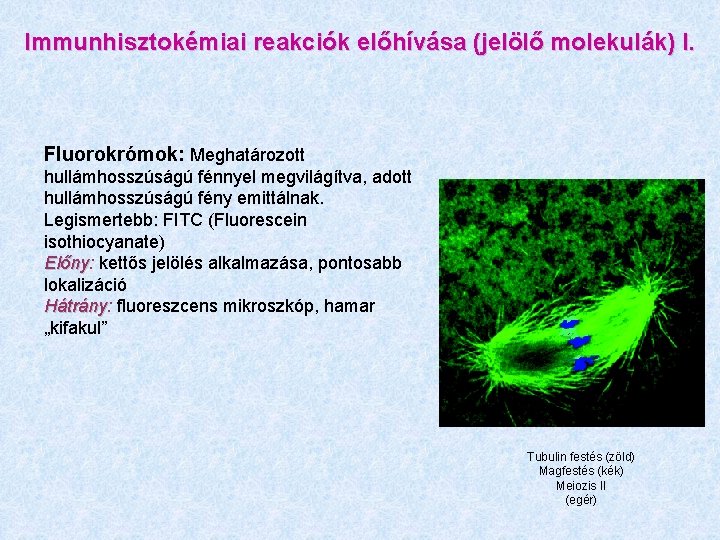
Immunhisztokémiai reakciók előhívása (jelölő molekulák) I. Fluorokrómok: Meghatározott hullámhosszúságú fénnyel megvilágítva, adott hullámhosszúságú fény emittálnak. Legismertebb: FITC (Fluorescein isothiocyanate) Előny: Előny kettős jelölés alkalmazása, pontosabb lokalizáció Hátrány: Hátrány fluoreszcens mikroszkóp, hamar „kifakul” Tubulin festés (zöld) Magfestés (kék) Meiozis II (egér)

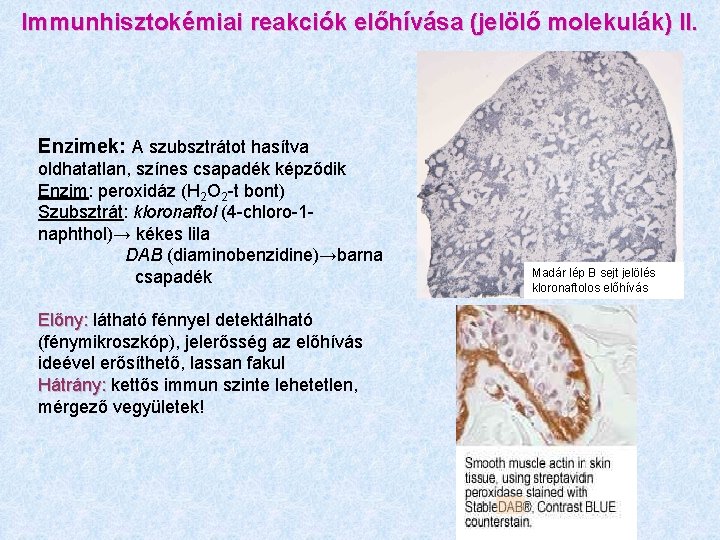
Immunhisztokémiai reakciók előhívása (jelölő molekulák) II. Enzimek: A szubsztrátot hasítva oldhatatlan, színes csapadék képződik Enzim: peroxidáz (H 2 O 2 -t bont) Szubsztrát: kloronaftol (4 -chloro-1 naphthol)→ kékes lila DAB (diaminobenzidine)→barna csapadék Előny: látható fénnyel detektálható (fénymikroszkóp), jelerősség az előhívás ideével erősíthető, lassan fakul Hátrány: kettős immun szinte lehetetlen, mérgező vegyületek! Madár lép B sejt jelölés kloronaftolos előhívás

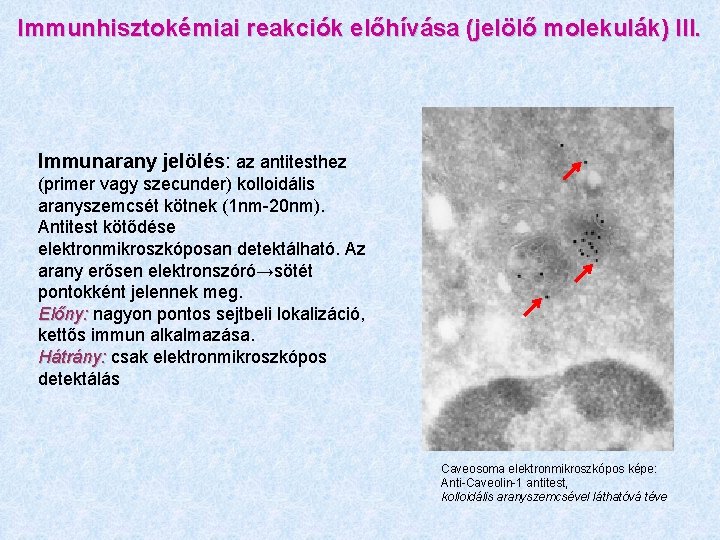
Immunhisztokémiai reakciók előhívása (jelölő molekulák) III. Immunarany jelölés: az antitesthez (primer vagy szecunder) kolloidális aranyszemcsét kötnek (1 nm-20 nm). Antitest kötődése elektronmikroszkóposan detektálható. Az arany erősen elektronszóró→sötét pontokként jelennek meg. Előny: nagyon pontos sejtbeli lokalizáció, kettős immun alkalmazása. Hátrány: csak elektronmikroszkópos detektálás Caveosoma elektronmikroszkópos képe: Anti-Caveolin-1 antitest, kolloidális aranyszemcsével láthatóvá téve

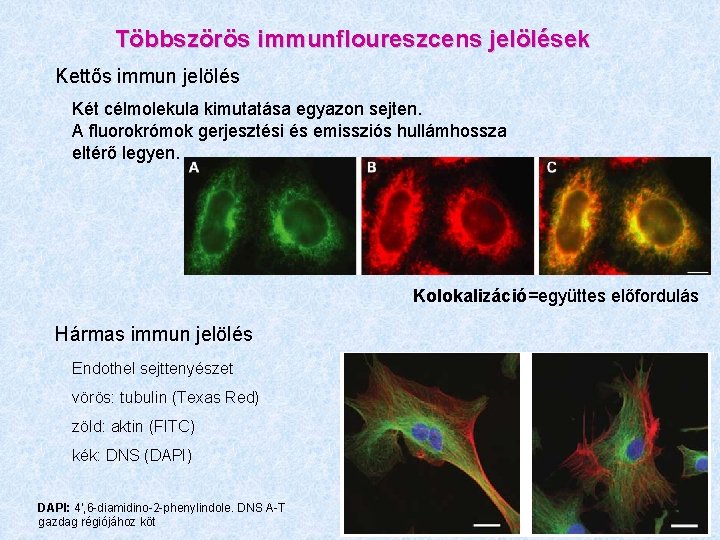
Többszörös immunfloureszcens jelölések Kettős immun jelölés Két célmolekula kimutatása egyazon sejten. A fluorokrómok gerjesztési és emissziós hullámhossza eltérő legyen. Kolokalizáció=együttes előfordulás Hármas immun jelölés Endothel sejttenyészet vörös: tubulin (Texas Red) zöld: aktin (FITC) kék: DNS (DAPI) DAPI: 4', 6 -diamidino-2 -phenylindole. DNS A-T gazdag régiójához köt

Kontrollok, blokkolás • Pozitív kontroll: olyan szövetminta, amelyre a reakciót kidolgozták, amelyben a feltüntetni kívánt vegyület nagy mennyiségben fordul elő és az adott protokollal bizonyítottan kimutatható • Negatív kontroll: a kimutatni kívánt anyagot nem, vagy teljesen inaktív formában tartalmazza, ezért abban reakciótermék nem alakulhat ki • Blokkolás (aspecifikus reakciók kiküszöbölése): Ha egy adott hisztokémiai reakcióval egy vegyület vagy vegyületcsoport specifikus feltüntetését akarjuk elérni, inaktiválni kell a hasonló tulajdonságú vegyületek reaktív csoportjait. Ezt az eljárást blokkolásnak nevezzük. -pl: peroxidáz enzimes előhívás, előzetes endogén peroxidáz blokk -antitest aspecifikus bekötődésének megelőzése BSA (bovine serum albumin

Diagnosztika • Terhességi teszt (HCG elleni antitest) • Malignus elváltozások típusának meghatározása (monoklonális antitest terápia) • Vércsoport szerológia • Kórszövettani-szövettani diagnosztika

In situ hibridizáció

Nukleinsavak kimutatása: In situ hibridizáció DNS/RNS szekvenciák kimutatása, lokalizációjuk meghatározása (szövet, sejt, kromoszóma szinten) Alkalmas • Génkifejeződés vizsgálata (m. RNS) • Vírusfertőzés azonosítására és lokalizációjára (RNS és DNS vírusok is) • Kromoszóma térképezés (DNS) • Génhiba, mutáció kimutatása (DNS) Alapja: Egyszálú nukleinsav-nukleinsav komplementaritás elve alapján történő kapcsolódása Próba: olyan oligo-, vagy polinukleotid szekvencia, amely a bázispárosodás szabályai szerint egy jól meghatározott (azaz a keresett) szekvenciához (DNS-hez, vagy RNS-hez ) hibridizál. A próba lehet DNS vagy RNS.

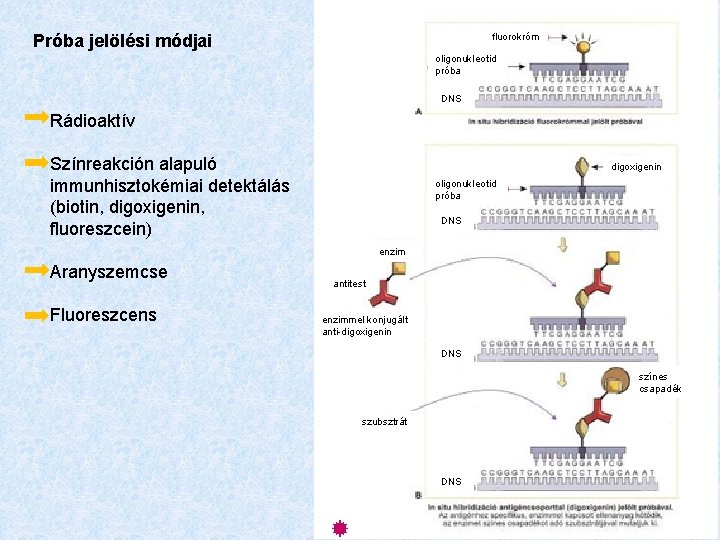
fluorokróm Próba jelölési módjai oligonukleotid próba DNS Rádioaktív Színreakción alapuló immunhisztokémiai detektálás (biotin, digoxigenin, fluoreszcein) digoxigenin oligonukleotid próba DNS enzim Aranyszemcse Fluoreszcens antitest enzimmel konjugált anti-digoxigenin DNS színes csapadék szubsztrát DNS

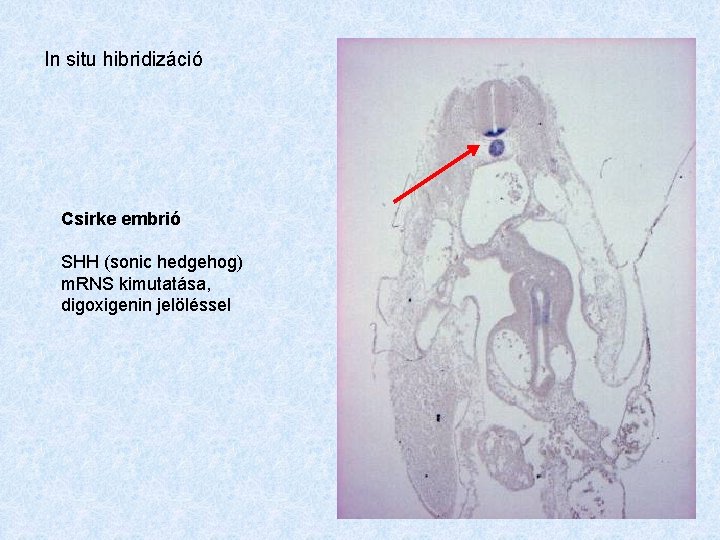
In situ hibridizáció Csirke embrió SHH (sonic hedgehog) m. RNS kimutatása, digoxigenin jelöléssel

Köszönöm szépen a figyelmet!

Források: Dr. Dávid Csaba előadása: Általános festési és immunhisztokémiai módszerek Dr. Doma Viktória előadása: Immunhisztokémiai módszerek; Makromolekulák azonosítása szövettani metszeteken (EKK) Röhlich Pál szerkeszette Szövettan (SE) ELTE-TTK; Anatómiai, Sejt- és Fejlődésbiológiai Tanszék honlapja; Sejttan; Ultrastruktúra album. ( http: //anatomia. elte. hu/Sejttan/index. htm )























