Lezione 16 La contrazione muscolare 05112019 091 FA









![Storia della scienza • When she [Jean Hanson] observed these myofibrils under a powerful Storia della scienza • When she [Jean Hanson] observed these myofibrils under a powerful](https://slidetodoc.com/presentation_image_h2/66ce26d0e834bd5f7b6fa87d083f2cb6/image-26.jpg)











- Slides: 46

Lezione 16 La contrazione muscolare 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 0

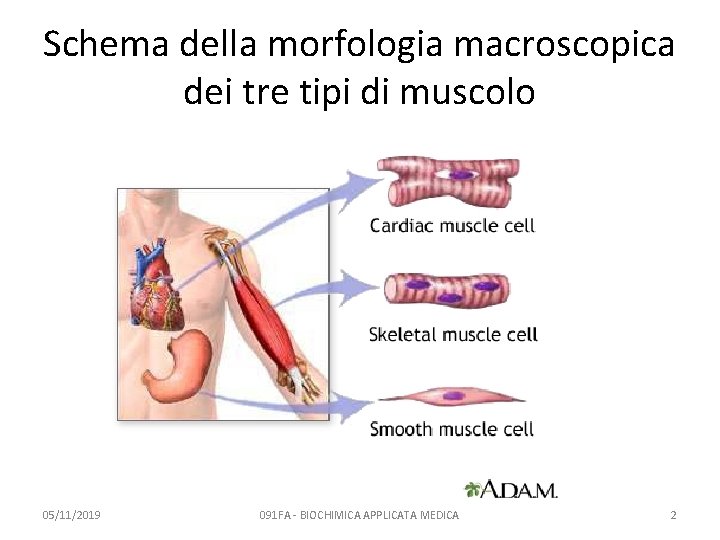
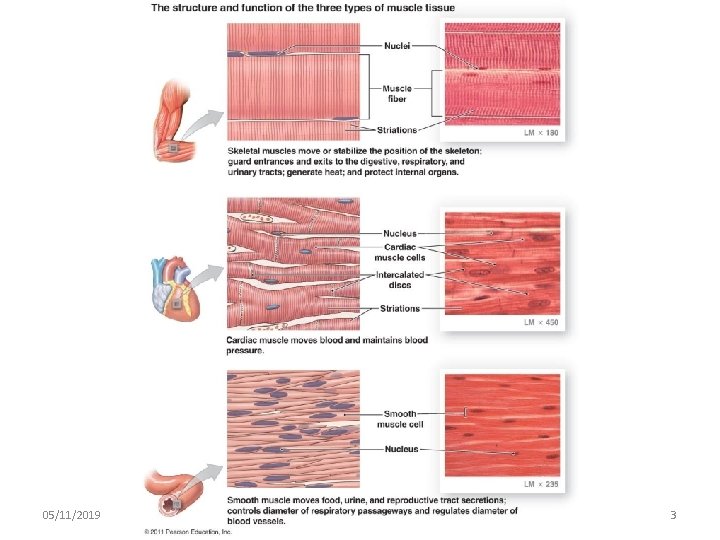
Tre tipi di muscolo • Striato scheletrico – le proteine contrattili formano sarcomeri – le fibre sono multinucleate – controllate volontariamente • Striato cardiaco – le proteine contrattili formano sarcomeri – le fibre sono mono- o binucleate – le fibre sono collegate tra loro e si contraggono o rilassano sincronicamente – controllate automaticamente (involontariamente) • Liscio – le proteine contrattili NON formano sarcomeri – controllate automaticamente (involontariamente) 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 1

Schema della morfologia macroscopica dei tre tipi di muscolo 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 2

05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 3

Le funzioni del muscolo scheletrico • Locomozione • Termogenesi • Omeostasi glicemica e lipdica: – A digiuno: fornisce aminoacidi per la gluconeogenesi epatica – Dopo un pasto: ed è un sito importante di uptake e metabolismo del glucosio e dei trigliceridi • Impatto elevato sul metabolismo di tutto l’organismo – 40% della massa corporea – se perdita di massa muscolare (senilità, malattie critiche come la sepsi o traumi, cancro, AIDS), grande impatto sul metabolismo generale 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 4

Le funzioni del muscolo cardiaco • Contrazione muscolare e attività cardiaca 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 5

Le funzioni del muscolo liscio • Pareti delle arterie – regola la pressione sanguigna e quindi il flusso ematico • Intestino – peristalsi e spostamento del contenuto verso l’ano • Dotti interni (vie aeree, vie biliari, vie renali e urinarie, vie secretorie, vie genitali, ecc. ) – spostare tutti i prodotti di secrezione verso i rispettivi orifizi. 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 6

Contrazione muscolare ATPdipendente • Il lavoro muscolare è attuato dalle proteine contrattili actina e miosina • Il lavoro muscolare è la causa principale del consumo di ATP • Il consumo di ATP è alla base del “controllo respiratorio” (consumo di ossigeno) QUESTIONE CENTRALE DEL METABOLISMO 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 7

Le principali proteine del muscolo costituiscono 80% della massa proteica muscolare • MIOSINA (p. m. 520. 000 Da), – proteina motrice (motor protein) – POLIMERO di 6 sub-unità: • 2 catene pesanti (220 k. Da, ciascuna) • 4 catene leggere (20 k. Da, ciascuna) • ACTINA-F (p. m. 559. 000 Da) – proteina rotaia (track protein) – POLIMERO di 13 subunità • ACTINA-G, actina globulare (p. m. 42. 000 Da) 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 8

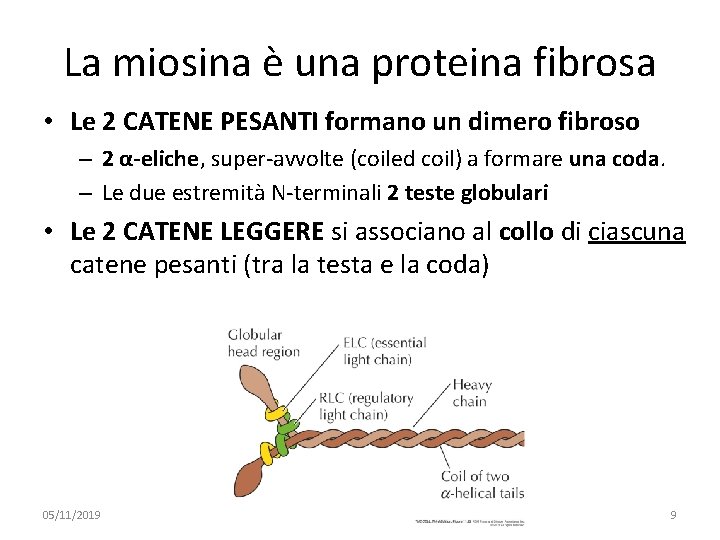
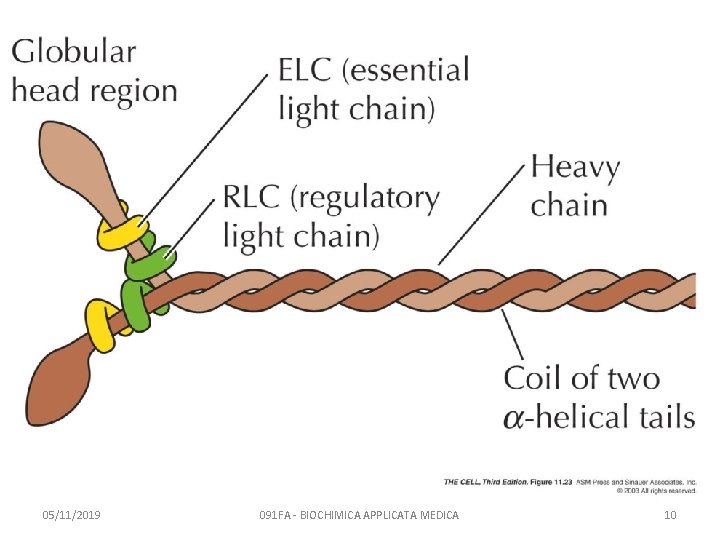
La miosina è una proteina fibrosa • Le 2 CATENE PESANTI formano un dimero fibroso – 2 α-eliche, super-avvolte (coiled coil) a formare una coda. – Le due estremità N-terminali 2 teste globulari • Le 2 CATENE LEGGERE si associano al collo di ciascuna catene pesanti (tra la testa e la coda) 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 9

05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 10

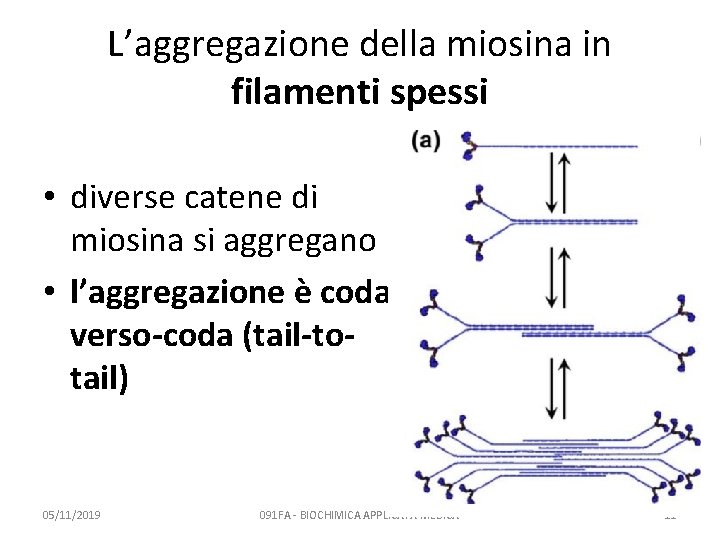
L’aggregazione della miosina in filamenti spessi • diverse catene di miosina si aggregano • l’aggregazione è codaverso-coda (tail-totail) 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 11

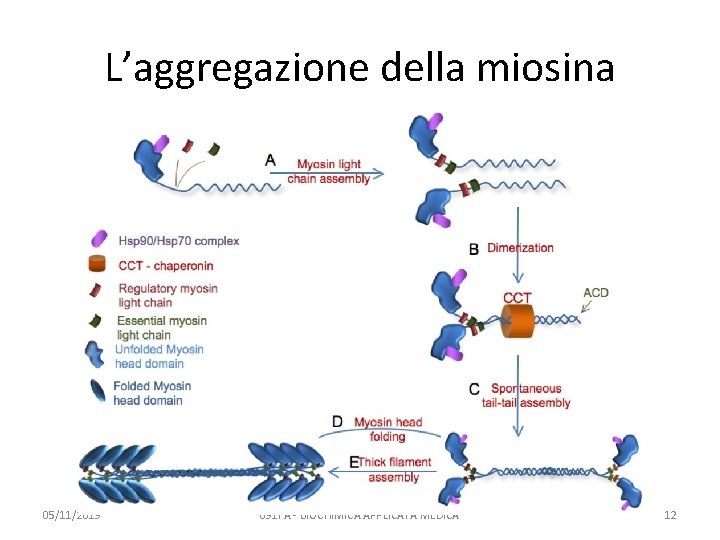
L’aggregazione della miosina 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 12

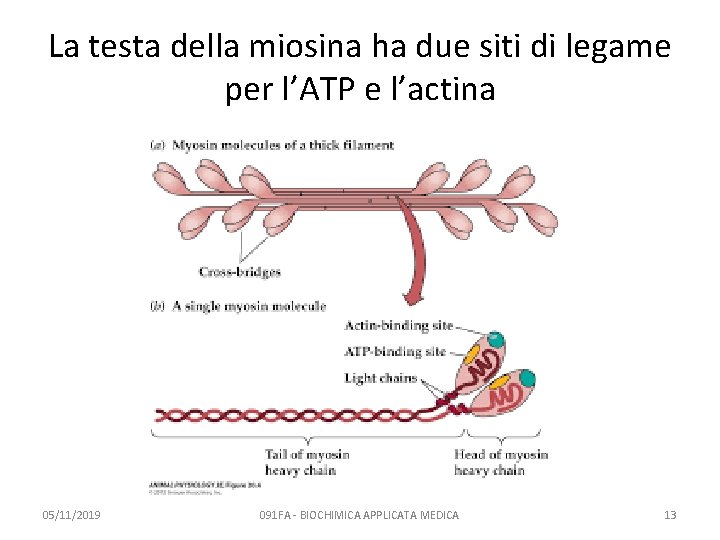
La testa della miosina ha due siti di legame per l’ATP e l’actina 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 13

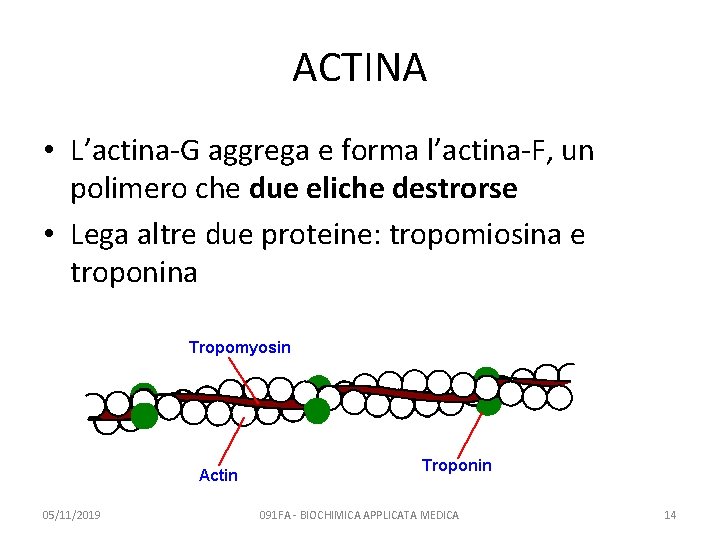
ACTINA • L’actina-G aggrega e forma l’actina-F, un polimero che due eliche destrorse • Lega altre due proteine: tropomiosina e troponina 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 14

La polimerizzazione dell’actina 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 15

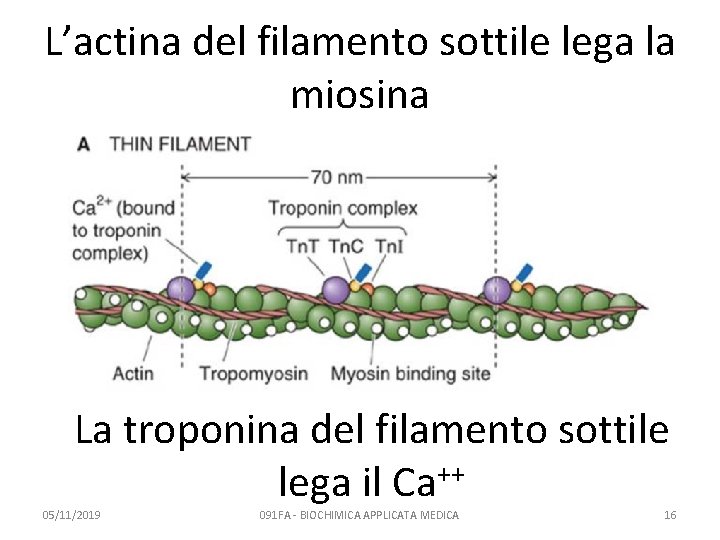
L’actina del filamento sottile lega la miosina La troponina del filamento sottile ++ lega il Ca 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 16

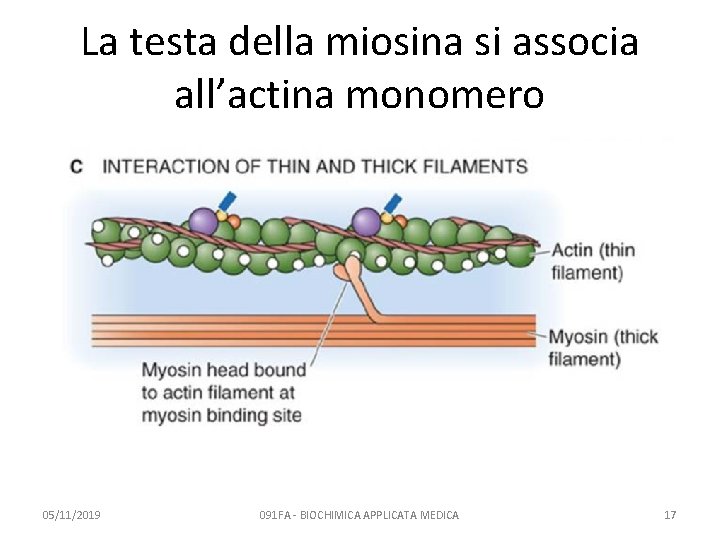
La testa della miosina si associa all’actina monomero 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 17

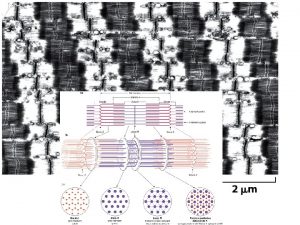
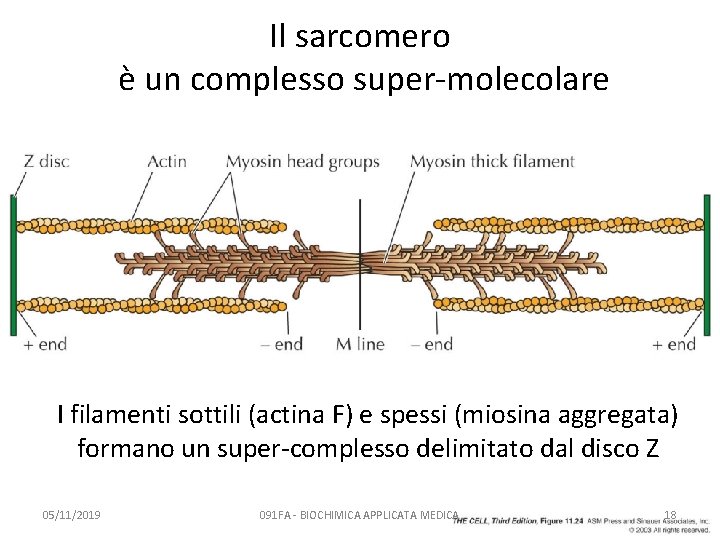
Il sarcomero è un complesso super-molecolare I filamenti sottili (actina F) e spessi (miosina aggregata) formano un super-complesso delimitato dal disco Z 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 18

Il sarcomero ha anche altre proteine strutturali giganti TITINA • 35. 213 amminoacidi; Massa (Da): 3. 906. 488 – terminale C alla linea M (centro del sarcomero) – associata alle fibre spesse del sarcomero – libera fino alla banda Z • Ha proprietà elastiche, utili per il rilassamento del sarcomero NEBULINA • 3. 007 amminoacidi; Massa (Da): 348. 968 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 19

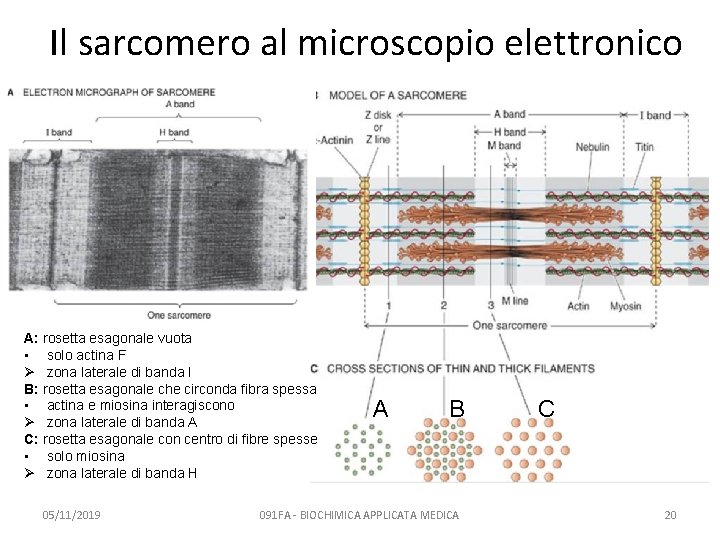
Il sarcomero al microscopio elettronico A: rosetta esagonale vuota • solo actina F Ø zona laterale di banda I B: rosetta esagonale che circonda fibra spessa • actina e miosina interagiscono Ø zona laterale di banda A C: rosetta esagonale con centro di fibre spesse • solo miosina Ø zona laterale di banda H 05/11/2019 A B 091 FA - BIOCHIMICA APPLICATA MEDICA C 20

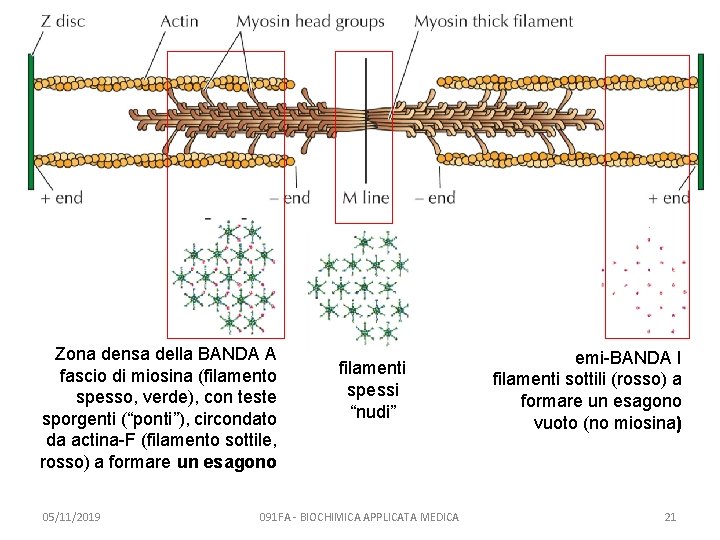
Zona densa della BANDA A fascio di miosina (filamento spesso, verde), con teste sporgenti (“ponti”), circondato da actina-F (filamento sottile, rosso) a formare un esagono 05/11/2019 filamenti spessi “nudi” 091 FA - BIOCHIMICA APPLICATA MEDICA emi-BANDA I filamenti sottili (rosso) a formare un esagono vuoto (no miosina) 21

22

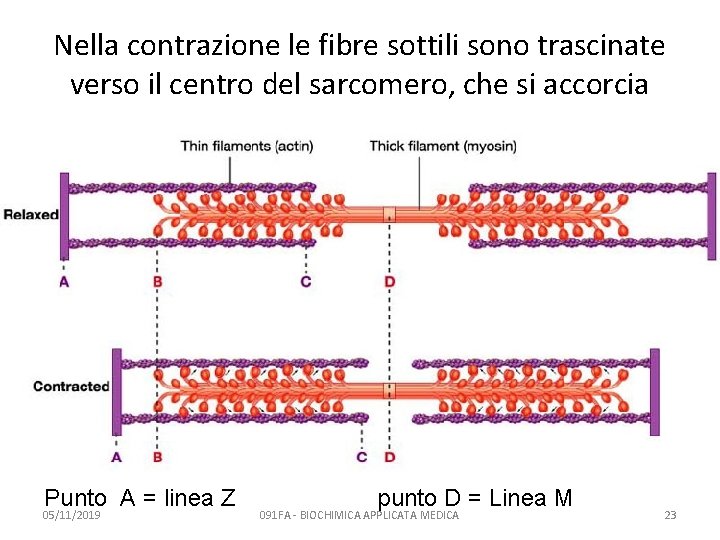
Nella contrazione le fibre sottili sono trascinate verso il centro del sarcomero, che si accorcia Punto A = linea Z 05/11/2019 punto D = Linea M 091 FA - BIOCHIMICA APPLICATA MEDICA 23

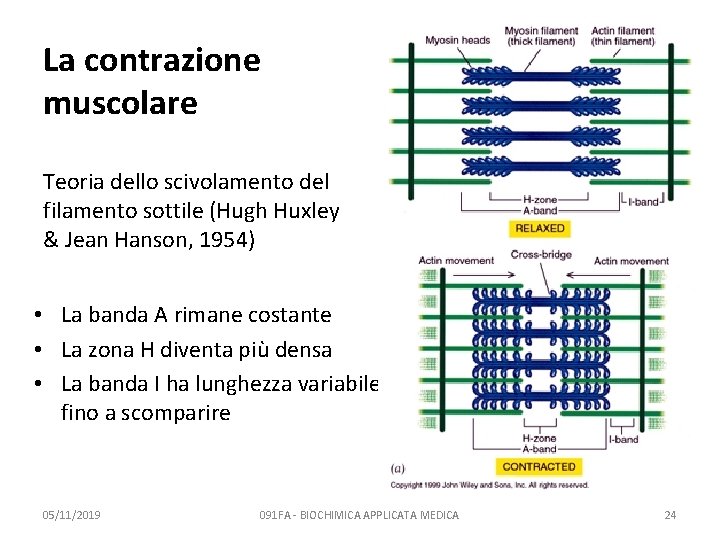
La contrazione muscolare Teoria dello scivolamento del filamento sottile (Hugh Huxley & Jean Hanson, 1954) • La banda A rimane costante • La zona H diventa più densa • La banda I ha lunghezza variabile, fino a scomparire 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 24
![Storia della scienza When she Jean Hanson observed these myofibrils under a powerful Storia della scienza • When she [Jean Hanson] observed these myofibrils under a powerful](https://slidetodoc.com/presentation_image_h2/66ce26d0e834bd5f7b6fa87d083f2cb6/image-26.jpg)
Storia della scienza • When she [Jean Hanson] observed these myofibrils under a powerful microscope, she noticed different bands of tissue, which changed shape as the muscle contracted. • She took her findings to America, when in 1953, she accepted a Rockefeller Fellowship to work for a year in FO Schmitt's Laboratory at Boston's Massachusetts Institute of Technology. • During her time at the institute, she met and collaborated with Professor Hugh Huxley, whose work with x-rays revealed there were two sets of filaments in the muscle fibre, not one as had been previously been suggested. 05/11/2019 Jean Hanson and Hugh Huxley No Nobel Prize was ever awarded for the discovery 091 FA - BIOCHIMICA APPLICATA MEDICA 25

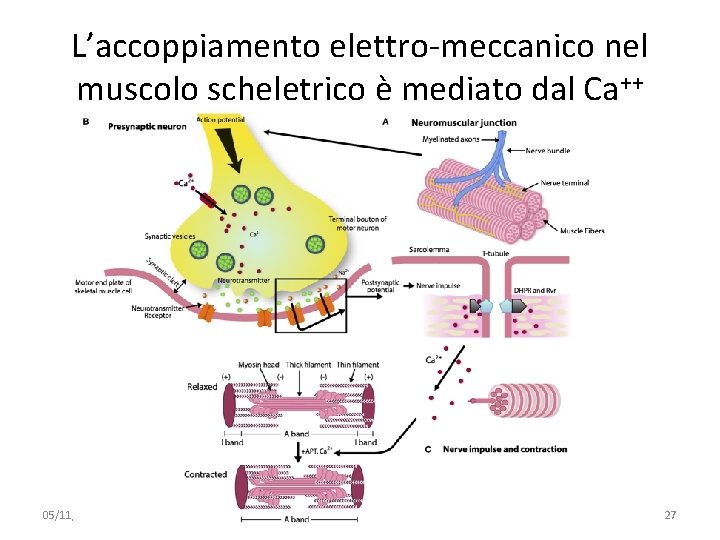
Il meccanismo molecolare della contrazione muscolare Lo scivolamento dell’actina dipende da Ca++ e ATP 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 26

L’accoppiamento elettro-meccanico nel muscolo scheletrico è mediato dal Ca++ 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 27

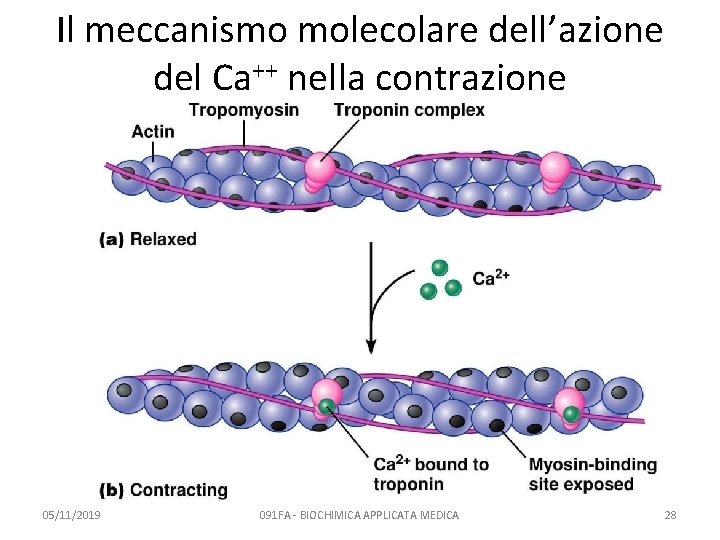
Il meccanismo molecolare dell’azione del Ca++ nella contrazione 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 28

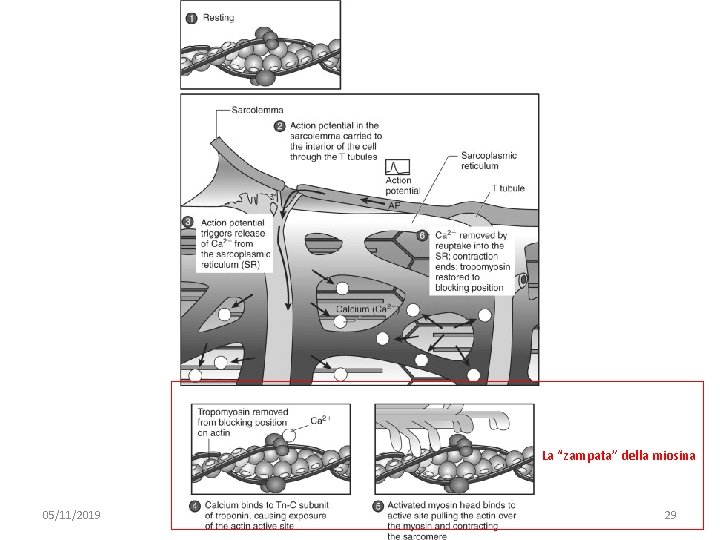
La “zampata” della miosina 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 29

Il ruolo del Calcio nella contrazione muscolare 1. La proteina tropomiosina si lega alla miosina e impedisce la formazione del complesso acto-miosina 2. Quando il Ca++ si lega alla troponina C, il complesso della troponina C cambia conformazione 3. Anche la tropomiosina cambia conformazione e si espongono i siti di legame di actina per miosina 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 30

Il ruolo dell’ATP nella contrazione muscolare è descritto da 4 equazioni chimiche M, miosina M*, miosina allo stato di elevata energia A, actina (M-ATP) ⇌ (M * -ADP-Pi) Eqn. 1 (M * -ADP-Pi) + A ⇌ (M * -ADP-A) + Pi Eqn. 2 (M * -ADP-A) ⇌ (M-A) + ADP Eqn. 3 (MA) + ATP ⇌ (M-ATP) + A Eqn. 4 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 31

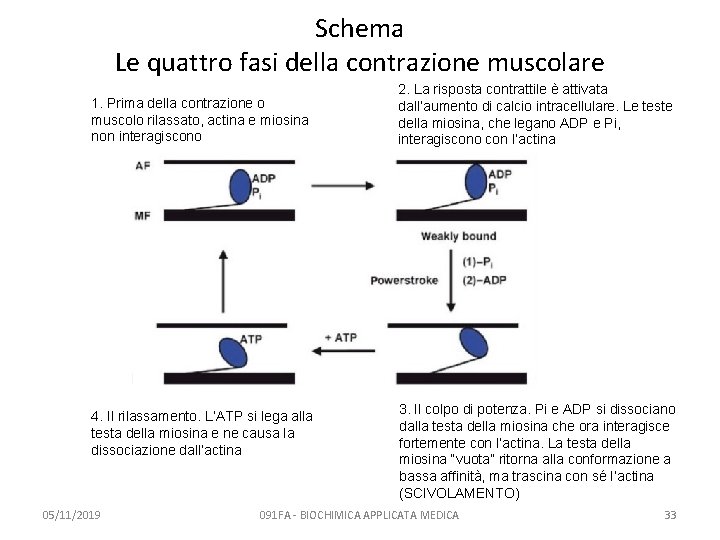
Le quattro fasi della contrazione muscolare 1. Prima della contrazione o muscolo rilassato – – 2. La risposta contrattile – – – 3. attivata dall’aumento di calcio intracellulare le teste della miosina, che legano ADP e Pi, interagiscono con l’actina vedi Eqn. 2 Il colpo di potenza – – – 4. actina e miosina non interagiscono vedi Eqn. 1 Pi e ADP si dissociano dalla testa della miosina che ora interagisce fortemente con l’actina La testa della miosina “vuota” ritorna alla conformazione a bassa affinità, ma trascina con sè l’actina (SCIVOLAMENTO) vedi Eqn. 3 Il rilassamento – L’ATP si lega alla testa della miosina e ne causa la dissociazione dall’actina – vedi Eqn. 4 – In assenza di ATP: Rigor 05/11/2019 091 FA -mortis BIOCHIMICA APPLICATA MEDICA 32

Schema Le quattro fasi della contrazione muscolare 1. Prima della contrazione o muscolo rilassato, actina e miosina non interagiscono 4. Il rilassamento. L’ATP si lega alla testa della miosina e ne causa la dissociazione dall’actina 05/11/2019 2. La risposta contrattile è attivata dall’aumento di calcio intracellulare. Le teste della miosina, che legano ADP e Pi, interagiscono con l’actina 3. Il colpo di potenza. Pi e ADP si dissociano dalla testa della miosina che ora interagisce fortemente con l’actina. La testa della miosina “vuota” ritorna alla conformazione a bassa affinità, ma trascina con sé l’actina (SCIVOLAMENTO) 091 FA - BIOCHIMICA APPLICATA MEDICA 33

L’attività ATPasica della miosina determina la velocità di contrazion • Una maggiore attività della miosina-ATPasi aumenta la possibilità delle teste di miosina di interagire con l’actina • Ciò consente un aumento del tasso di contrazione. • Diverse isoforme della miosina hanno livelli variabili di attività dell'ATPasi, con muscoli veloci con tassi più elevati di attività della miosina-ATPasi. 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 34

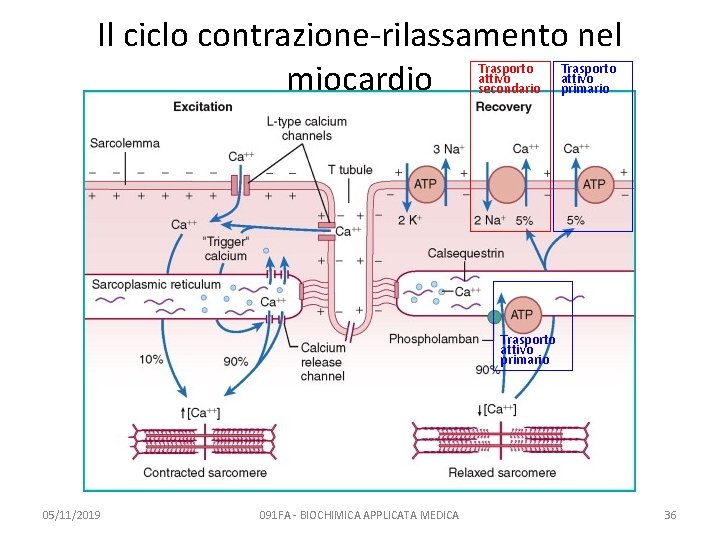
Il rilassamento muscolare Avviene per sequestro del Calcio nel reticolo sarcoplasmatico L’esempio del muscolo cardiaco 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 35

Il ciclo contrazione-rilassamento nel miocardio Trasporto attivo secondario Trasporto attivo primario 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 36

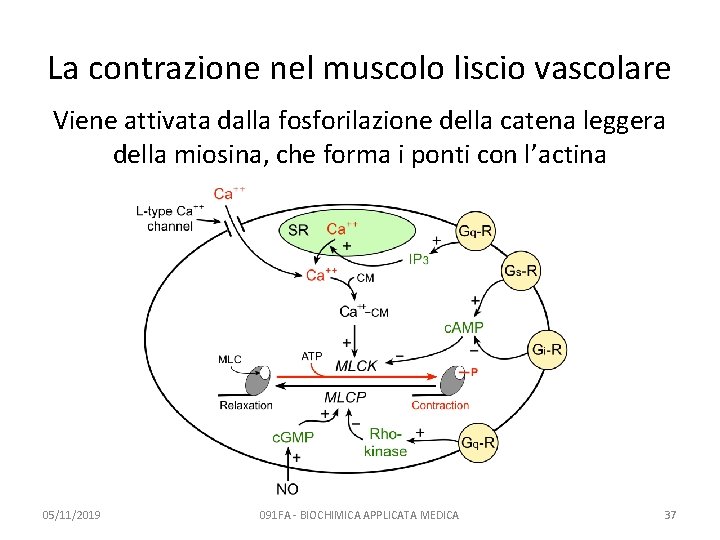
La contrazione nel muscolo liscio vascolare Viene attivata dalla fosforilazione della catena leggera della miosina, che forma i ponti con l’actina 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 37

Fine 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 38

Materiale integrativo 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 39

05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 40

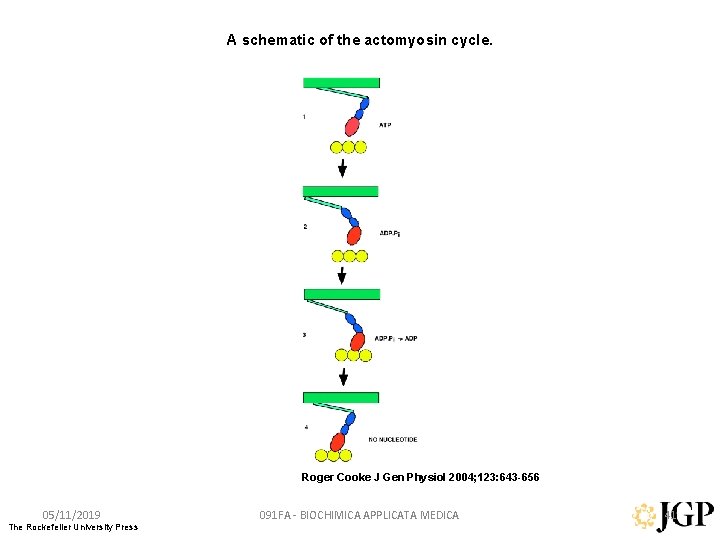
A schematic of the actomyosin cycle. Roger Cooke J Gen Physiol 2004; 123: 643 -656 05/11/2019 The Rockefeller University Press 091 FA - BIOCHIMICA APPLICATA MEDICA 41

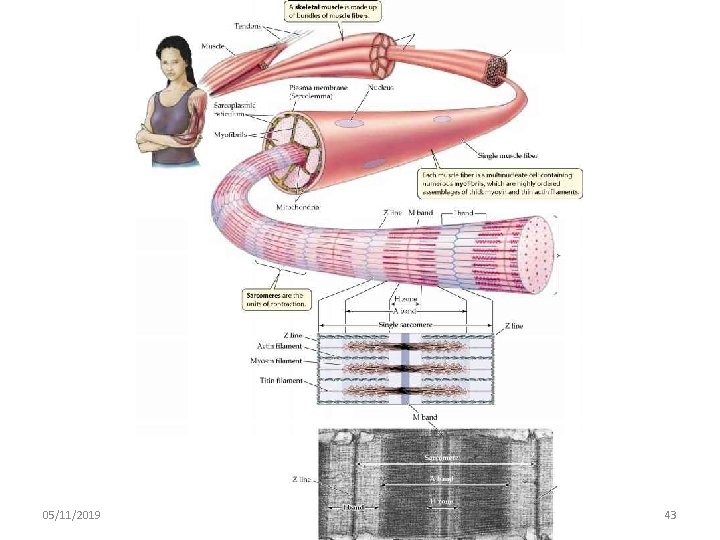
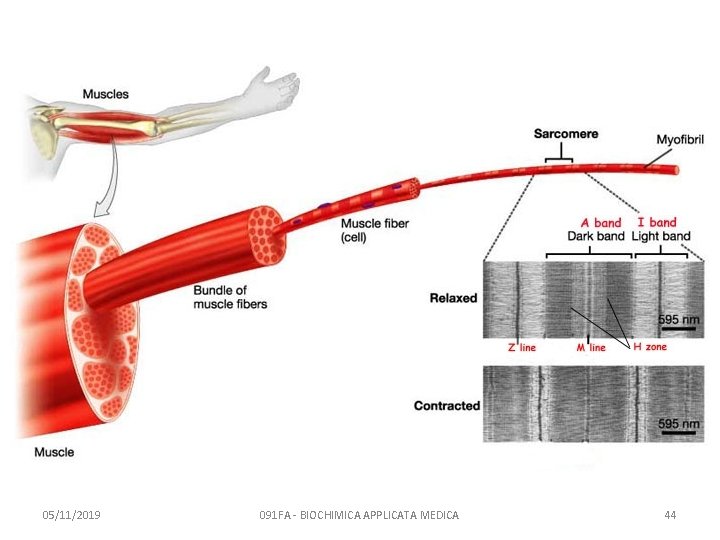
La struttura del muscolo scheletrico è gerarchica 05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 42

05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 43

05/11/2019 091 FA - BIOCHIMICA APPLICATA MEDICA 44

45
 Slidetodoc.com
Slidetodoc.com Sarcomero linea z
Sarcomero linea z 12012005
12012005 Lei11.091/05
Lei11.091/05 Bcd addition of 184 and 576
Bcd addition of 184 and 576 Mandala airlines flight 091
Mandala airlines flight 091 Contrazione isometrica
Contrazione isometrica Balzi sagittali
Balzi sagittali Miologia sistema muscolare
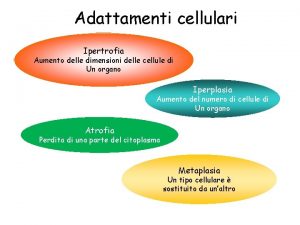
Miologia sistema muscolare Ipertrofia
Ipertrofia Follistatina vendita
Follistatina vendita Marietti scuola sistema muscolare
Marietti scuola sistema muscolare Ipertrofia muscolare
Ipertrofia muscolare Microsecolo
Microsecolo Ipertrofia muscolare
Ipertrofia muscolare Lezione 7
Lezione 7 Fasi di una lezione simulata
Fasi di una lezione simulata Struttura della lezione
Struttura della lezione Jigsaw esempio
Jigsaw esempio La lezione della farfalla
La lezione della farfalla Esempio di lezione clil diritto
Esempio di lezione clil diritto Is lezione masculine or feminine
Is lezione masculine or feminine L esperienza delle cose moderne e la lezione delle antique
L esperienza delle cose moderne e la lezione delle antique Lezione delle antique cose
Lezione delle antique cose