Lenergia definita come capacit di compiere un lavoro









- Slides: 14

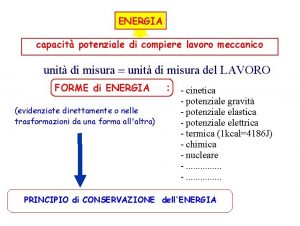
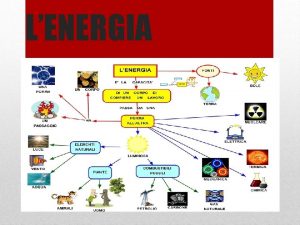
L'energia è definita come capacità di compiere un lavoro. Esistono molti tipi diversi di energia, che possono essere suddivisi in: • Energia cinetica. L'energia cinetica è associata al moto. Oltre all'energia cinetica vera e propria che si studia in meccanica, anche il calore è una forma di energia cinetica perché si riferisce al moto di atomi, molecole o ioni. • Energia potenziale. L'energia potenziale è associata alla posizione di un oggetto. Esempi sono: • Energia gravitazionale, che dipende dal'altezza dell'oggetto rispetto alla superficie terrestre. • Energia chimica, che dipende da come gli atomi sono disposti nei composti a cui partecipano. Questa è l'energia che varia in tutte le reazioni chimiche. Alcune reazioni chimiche si fanno soltanto per sfruttare questa energia, come avviene per i combustibili. • Energia elettrostatica, che dipende dalla distanza tra le cariche elettriche. Mentre i vari tipi di energia possono trasformarsi tra loro, l'energia non può essere creata né distrutta: questa è la legge della conservazione dell'energia. NB. Questi argomenti si trovano nel Capitolo 5 del libro

La temperatura è una misura della capacità di un corpo di trasferire calore ad un altro corpo: il calore passa dal corpo a temperatura superiore a quello a temperatura inferiore. Maggiore è le temperatura di un corpo, maggiore è l'energia termica dei suoi atomi, molecole o ioni. Il corpo che cede calore si raffredda, e diminuisce quindi la sua energia termica, e quello che acquista calore si riscalda, e aumenta quindi la sua energia termica. La quantità di calore totale resta costante. Il processo continua fino a che i due aggetti non hanno la a stessa temperatura: si dice che si è raggiunto l'equilibrio termico. Tuttavia, se consideriamo corpi diversi, può benissimo succedere che un oggetto ad temperatura inferiore abbia contenga più energia termica di un oggetto a temperatura superiore. Per esempio, una cisterna di acqua a 25 °C ha sicuramente energia termina sufficiente a sciogliere un cubetto di ghiaccio, ma un goccia di acqua a 100 °C no. Anche in questo caso, comunque, se mettiamo a contatto i due corpi, il calore passa dalla goccia di acqua bollente all'acqua nella cisterna. 6 – Termodinamica I. pdf – V 2. 0– Chimica Generale – Prof. A. Mangoni– A. A. 2012/2013

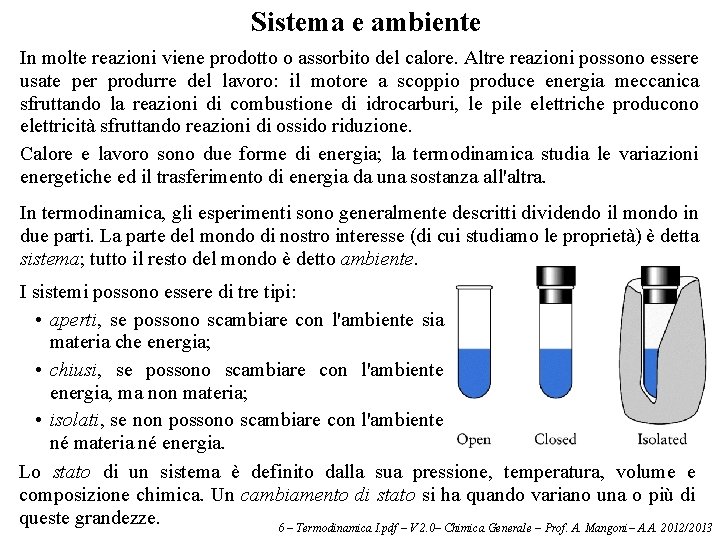
Sistema e ambiente In molte reazioni viene prodotto o assorbito del calore. Altre reazioni possono essere usate per produrre del lavoro: il motore a scoppio produce energia meccanica sfruttando la reazioni di combustione di idrocarburi, le pile elettriche producono elettricità sfruttando reazioni di ossido riduzione. Calore e lavoro sono due forme di energia; la termodinamica studia le variazioni energetiche ed il trasferimento di energia da una sostanza all'altra. In termodinamica, gli esperimenti sono generalmente descritti dividendo il mondo in due parti. La parte del mondo di nostro interesse (di cui studiamo le proprietà) è detta sistema; tutto il resto del mondo è detto ambiente. I sistemi possono essere di tre tipi: • aperti, se possono scambiare con l'ambiente sia materia che energia; • chiusi, se possono scambiare con l'ambiente energia, ma non materia; • isolati, se non possono scambiare con l'ambiente né materia né energia. Lo stato di un sistema è definito dalla sua pressione, temperatura, volume e composizione chimica. Un cambiamento di stato si ha quando variano una o più di queste grandezze. 6 – Termodinamica I. pdf – V 2. 0– Chimica Generale – Prof. A. Mangoni– A. A. 2012/2013

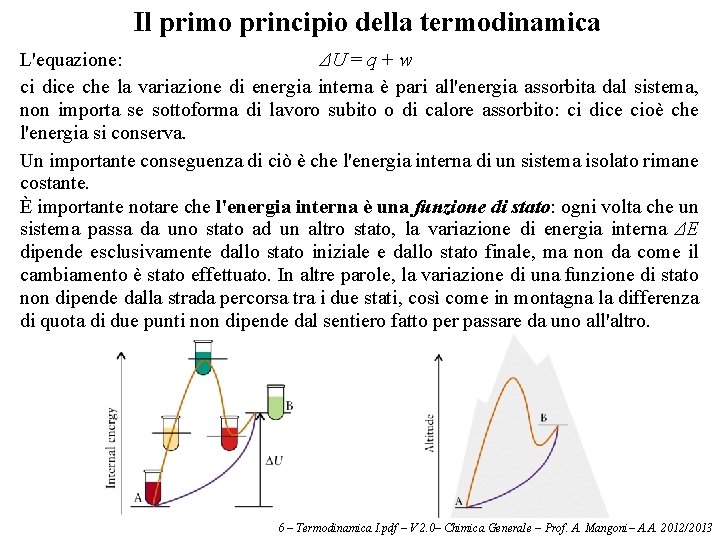
Il primo principio della termodinamica può essere enunciato in vari modi, ma fondamentalmente riguarda la conservazione dell'energia. Ogni sistema contiene una certa quantità di energia, detta energia interna, data dalla somma dell'energia cinetica e potenziale di tutte le particelle di cui è formato. L'energia interna è generalmente indicata con il simbolo U (talvolta anche col simbolo E). Non siamo in grado di misurare il valore di U, ma soltanto le sue variazioni: ΔU = Ufinale – Uiniziale Ogni volta che il nostro sistema compie un lavoro sull'ambiente esterno, gli cede energia. Da dove viene questa energia? Dall'energia interna del sistema, che di conseguenza diminuisce. Se invece è il lavoro è compiuto sul sistema, la sua energia interna aumenta. Anche il calore è una forma di energia, e quindi se il sistema cede calore all'ambiente esterno, la sua energia interna diminuisce, mentre se assorbe calore dall'ambiente esterno, la sua energia interna aumenta. Se chiamiamo w il lavoro compiuto sul sistema, e q il calore assorbito dal sistema, la variazione dell'energia interna è: ΔU = q + w Questa equazione è nota come primo principio della termodinamica. 6 – Termodinamica I. pdf – V 2. 0– Chimica Generale – Prof. A. Mangoni– A. A. 2012/2013

Il primo principio della termodinamica L'equazione: ΔU = q + w ci dice che la variazione di energia interna è pari all'energia assorbita dal sistema, non importa se sottoforma di lavoro subito o di calore assorbito: ci dice cioè che l'energia si conserva. Un importante conseguenza di ciò è che l'energia interna di un sistema isolato rimane costante. È importante notare che l'energia interna è una funzione di stato: ogni volta che un sistema passa da uno stato ad un altro stato, la variazione di energia interna ΔE dipende esclusivamente dallo stato iniziale e dallo stato finale, ma non da come il cambiamento è stato effettuato. In altre parole, la variazione di una funzione di stato non dipende dalla strada percorsa tra i due stati, così come in montagna la differenza di quota di due punti non dipende dal sentiero fatto per passare da uno all'altro. 6 – Termodinamica I. pdf – V 2. 0– Chimica Generale – Prof. A. Mangoni– A. A. 2012/2013

Il primo principio della termodinamica Al contrario, il calore assorbito q ed il lavoro subito w non sono funzioni di stato, poiché dipendono dalla particolare strada seguita per passare da uno stato all'altro. Per esempio, per riscaldare 100 m. L d'acqua da 25 °C a 30 °C potremmo fornire calore ma non compire lavoro sul sistema, oppure compiere lavoro ma non fornire calore, o ancora in parte fornire calore e in parte compiere lavoro. Quindi w e q sarebbero sicuramente diversi nei tre casi; tuttavia il primo principio della termodinamica ci garantisce che in tutti e tre i casi la somma w+q sarà identica, e pari proprio a ΔU. Reazioni esotermiche ed endotermiche Per quanto riguarda le reazioni chimiche, e ben noto che molte di esse liberano calore nell'ambiente, e sono dette reazioni esotermiche. Allora, per il primo principio della termodinamica, in una reazione esotermica l'energia interna deve diminuire, cioè deve essere ΔU < 0. Esistono anche reazioni che assorbono calore dall'ambiente, che sono dette reazioni endotermiche. In questo caso l'energia interna deve aumentare, cioè deve essere ΔU > 0. Se non viene compiuto alcun lavoro, il calore assorbito da una reazione è pari a ΔU (o, se preferite, il calore sviluppato dalla reazione è pari a –ΔU): q = ΔU (se non c’è lavoro e a T e V 6 – Termodinamica I. pdf – V 2. 0– Chimica Generale – Prof. A. Mangoni– A. A. 2012/2013 costanti)

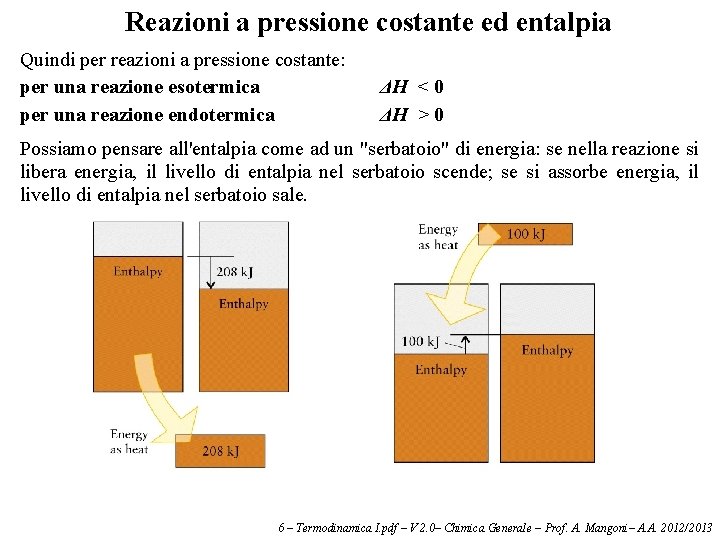
Reazioni a pressione costante ed entalpia La relazione appena vista è valida solo per un sistema il cui volume rimanga costante. Infatti, per aumentare di volume un sistema deve compiere lavoro (mentre se il sistema diminuisce di volume è l'ambiente esterno che compie lavoro sul sistema). Poiché la maggior parte delle reazioni sono effettuate a pressione costante e non a volume costante, è stata definita un'altra funzione di stato, detta entalpia (H): H = U + P ·V Poiché U, P e V sono funzioni di stato, anche H è una funzione di stato. Il vantaggio di usare l'entalpia al posto dell'energia interna è che, se non viene compiuto nessun lavoro tranne quello di espansione, il calore assorbito da una reazione fatta avvenire a pressione costante è pari alla variazione di entalpia del sistema: q = ΔH (a T e P costanti e se non c’è lavoro) L'entalpia è quindi utile per reazioni a pressione costante, mentre per reazioni a volume costante conviene usare l'energia interna. 6 – Termodinamica I. pdf – V 2. 0– Chimica Generale – Prof. A. Mangoni– A. A. 2012/2013

Reazioni a pressione costante ed entalpia Quindi per reazioni a pressione costante: per una reazione esotermica per una reazione endotermica ΔH < 0 ΔH > 0 Possiamo pensare all'entalpia come ad un "serbatoio" di energia: se nella reazione si libera energia, il livello di entalpia nel serbatoio scende; se si assorbe energia, il livello di entalpia nel serbatoio sale. 6 – Termodinamica I. pdf – V 2. 0– Chimica Generale – Prof. A. Mangoni– A. A. 2012/2013

Entalpia di reazione In tutte le relazioni viste, abbiamo assunto che non venga compiuto altro lavoro che il lavoro di espansione. Se invece viene compiuto un qualche tipo di lavoro, il calore sviluppato sarà diverso. Quello che invece è sempre uguale la variazione di entalpia. Per questo, se si vogliono esprimere gli aspetti termodinamici di una reazione chimica, va indicata la variazione di entalpia nella reazione (che è sempre la stessa) e non il calore sviluppato o assorbito dalla reazione (che può variare). Per esempio possiamo scrivere: CH 4 (g) + 2 O 2 (g) → CO 2 (g) + 2 H 2 O (l) ΔH = – 890 k. J mol-1 Quella che abbiamo scritto è detta equazione termochimica. Naturalmente la variazione di entalpia dipende dalla quantità di reagenti. Quella riportata è relativa ad un numero di moli di ogni reagenti parti al rispettivo coefficiente stechiometrico, in questo caso 1 mol di CH 4, 2 mol di O 2, ecc. Il valore di ΔH si riferisce quindi al particolare modo in cui scriviamo l'equazione chimica. Per esempio scrivendo: 2 CH 4 (g) + 4 O 2 (g) → 2 CO 2 (g) + 4 H 2 O (l) ΔH = – 1780 k. J mol-1 il valore numerico di ΔH raddoppia. Una volta scritta una equazione termochimica, è possibile calcolare la variazione di entalpia (e quindi il calore assorbito) di una qualsiasi quantità di sostanza trattando ΔH come se fosse un prodotto di reazione. 6 – Termodinamica I. pdf – V 2. 0– Chimica Generale – Prof. A. Mangoni– A. A. 2012/2013

Entalpia standard di reazione L'entalpia varia, oltre che in seguito ad una reazione chimica, anche in seguito a variazioni di temperatura e di pressione. È allora importante specificare a quale temperatura e pressione si riferiscono i valori numerici di ΔH riportati. Ancora meglio, è opportuno considerare i reagenti e prodotti nei loro stati standard. Lo stato standard per ogni composto è la forma pura, alla pressione di 1 atm. Per i composti in soluzione ("aq"), si considera standard la concentrazione di 1 M. La temperatura non fa parte delle condizioni standard, ma in generale per i valori tabulati è 25 °C. Se è misurata in condizioni standard, l'entalpia di reazione è detta entalpia standard di reazione, e si indica con il simbolo ΔH°. 6 – Termodinamica I. pdf – V 2. 0– Chimica Generale – Prof. A. Mangoni– A. A. 2012/2013

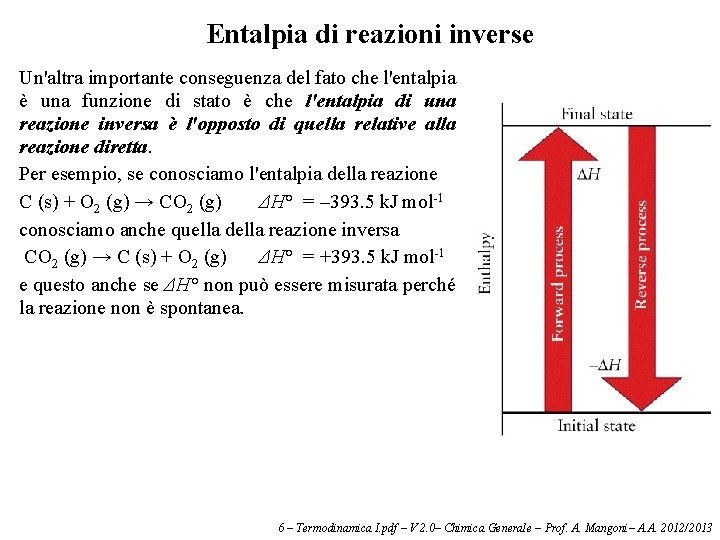
Entalpia di reazioni inverse Un'altra importante conseguenza del fato che l'entalpia è una funzione di stato è che l'entalpia di una reazione inversa è l'opposto di quella relative alla reazione diretta. Per esempio, se conosciamo l'entalpia della reazione C (s) + O 2 (g) → CO 2 (g) ΔH° = – 393. 5 k. J mol-1 conosciamo anche quella della reazione inversa CO 2 (g) → C (s) + O 2 (g) ΔH° = +393. 5 k. J mol-1 e questo anche se ΔH° non può essere misurata perché la reazione non è spontanea. 6 – Termodinamica I. pdf – V 2. 0– Chimica Generale – Prof. A. Mangoni– A. A. 2012/2013

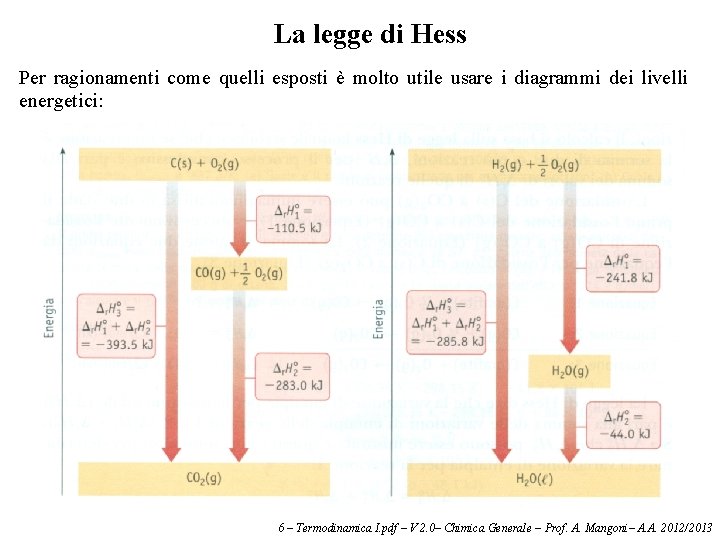
La legge di Hess Il fatto che l'entalpia sia una funzione di stato permette di calcolare entalpie di reazioni impossibili da misurare sperimentalmente. Consideriamo l'entalpia di reazione per: C (s) + ½ O 2 (g) → CO (g) ΔH° = ? (1) Questa non può essere misurata facilmente poiché se c'è eccesso di ossigeno avviene piuttosto la reazione, per la quale possiamo misurare facilmente il ΔH°: C (s) + O 2 (g) → CO 2 (g) ΔH° = – 393. 5 k. J mol-1 (2) D'altre parte CO reagisce con O 2 per dare CO 2, e anche per questa reazione possiamo misurare il ΔH°: CO (g) + ½ O 2 (g) → CO 2 (g) ΔH° = – 283. 0 k. J mol-1 (3) La legge di Hess ci dice che se una reazione è la somma di due o più reazioni, il suo ΔH° sarà la somma dei ΔH° delle singole reazioni. In questo caso la reazione 2 è la somma delle reazioni 1 e 3, e quindi anche ΔH°(2) = ΔH° (1) + ΔH° (3) Poiché conosciamo ΔH°(2) e ΔH° (3), possiamo facilmente calcolare ΔH° (1): ΔH°(1) = ΔH° (2) – ΔH° (3) = – 393. 5 k. J mol-1 –(– 283. 0 k. J mol-1) = – 110. 5 k. J mol-1 6 – Termodinamica I. pdf – V 2. 0– Chimica Generale – Prof. A. Mangoni– A. A. 2012/2013

La legge di Hess Per ragionamenti come quelli esposti è molto utile usare i diagrammi dei livelli energetici: 6 – Termodinamica I. pdf – V 2. 0– Chimica Generale – Prof. A. Mangoni– A. A. 2012/2013

Entalpie standard di formazione Il fatto che l'entalpia sia una funzione di stato permette anche di definire, per ogni Le entalpie standard di formazione di moltissimi composti sono tabulate, e questo permette di calcolare facilmente le entalpie standard di reazione grazie alla legge di Hess. Infatti l'entalpia di una reazione è uguale alla somma delle entalpie di formazione dei prodotti (ognuna moltiplicata per il coefficiente stechiometrico), meno la somma delle entalpie di formazione dei reagenti: ΔH° = Σ n ΔHf° (prodotti) – Σ n ΔHf° (reagenti) È come se la reazione seguisse il percorso: reagenti → elementi → prodotti 6 – Termodinamica I. pdf – V 2. 0– Chimica Generale – Prof. A. Mangoni– A. A. 2012/2013
 10 ordklasser
10 ordklasser La concorrenza imperfetta
La concorrenza imperfetta Suspense amount
Suspense amount Come rico, come sano
Come rico, come sano Come home come home jesus is calling
Come home come home jesus is calling Come holy ghost lyrics
Come holy ghost lyrics Come in come in and sit down
Come in come in and sit down E m m a n u e l
E m m a n u e l Vorrei essere al mare
Vorrei essere al mare He-y come on ou-t meaning
He-y come on ou-t meaning Come in come in and sit down
Come in come in and sit down Come mi chiamo?
Come mi chiamo? Come and listen
Come and listen Come thou fount come thou king
Come thou fount come thou king Come lord jesus come and be born in our hearts
Come lord jesus come and be born in our hearts