LA CHIMIE THORIQUE Chapitre 6 Rpartition thermique des











- Slides: 20

LA CHIMIE THÉORIQUE Chapitre 6 Répartition thermique des molécules entre les divers niveaux Guy Collin, 2014 -12 -29

Problématique n n n v=2 hn v=1 n La molécule diatomique, la plus simple, tourne et vibre le long de sa liaison inter atomique. Les niveaux d’énergie sont quantifiés. Ils portent donc des énergies bien précises. À la température normale, est-ce que tous ces niveaux sont peuplés ? Est-ce que les molécules ont les moyens, l’énergie requise, pour occuper l’un quelconque de ces niveaux ? Si non, quelles sont les lois qui s’appliquent ? v=0 2014 -12 -29

Comportement d’une molécule excitée M* Processus intramoléculaires Processus extra-moléculaires : v=2 hn v=1 n Transfert d’énergie par collision; n Réaction chimique. v=0 2014 -12 -29

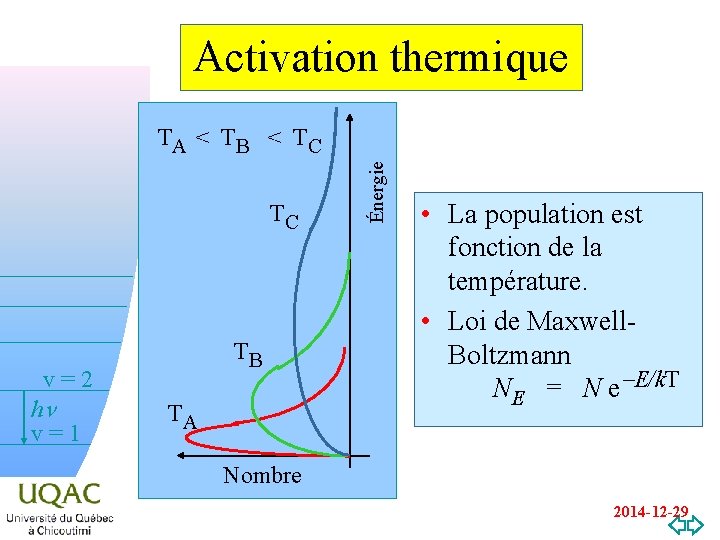
Activation thermique TC TB v=2 hn v=1 v=0 TA Énergie TA < T B < T C • La population est fonction de la température. • Loi de Maxwell. Boltzmann NE = N e-E/k. T Nombre 2014 -12 -29

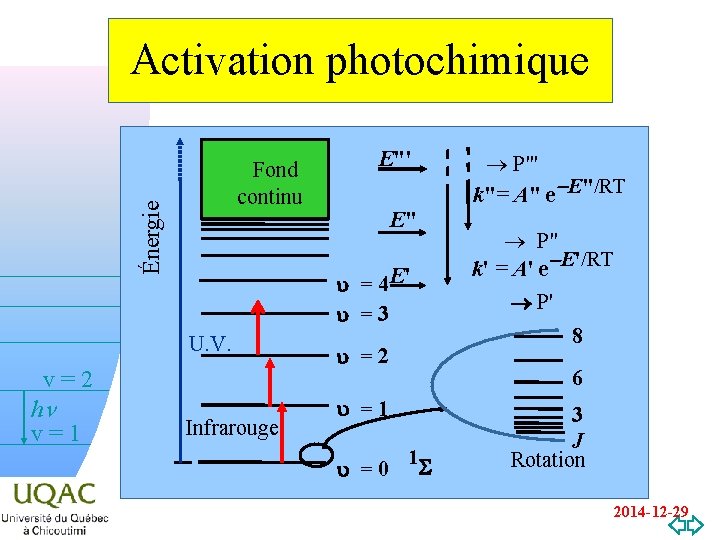
Activation photochimique Énergie Fond continu v=2 v=0 E" u = 4 E' u =3 U. V. hn v=1 E"' Infrarouge u =2 ® P" k' = A' e-E'/RT P' 8 6 u =1 u =0 ® P"' k"= A" e-E"/RT 1 S 3 J Rotation 2014 -12 -29

Processus physiques intra -moléculaires n Ionisation : u 5 n - 14 e. V ou 480 à 1350 k. J/mol. Dissociation : u 125 n à 500 k. J/mol. Saut électronique : à 1200 k. J/mol, (0, 05 à 0, 1 mm). u 240 n v=2 hn v=1 Vibration ( u = 0 à u = 1) : u 25 n à 60 k. J/mol (2 à 5 mm). Rotation (J = 0 à J = 1) : u 0, 13 à 2, 5 k. J/mol (1 nm à 50 mm). v=0 2014 -12 -29

Degrés de liberté d’une molécule quelconque n z n 0 x y v = 2 Molécule à n atomes hn v=1 n Chaque atome se meut dans les 3 directions : 3 n degrés de liberté. Déplacements groupés : 3 degrés de translation; 3 degrés de rotation. Degrés de liberté de vibration : 3 n – 6. v=0 2014 -12 -29

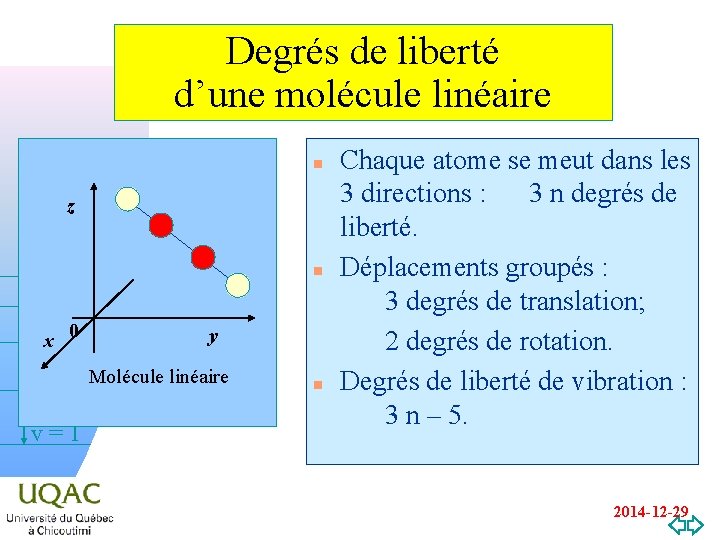
Degrés de liberté d’une molécule linéaire n z n x 0 y v = 2 Molécule linéaire hn v=1 n Chaque atome se meut dans les 3 directions : 3 n degrés de liberté. Déplacements groupés : 3 degrés de translation; 2 degrés de rotation. Degrés de liberté de vibration : 3 n – 5. v=0 2014 -12 -29

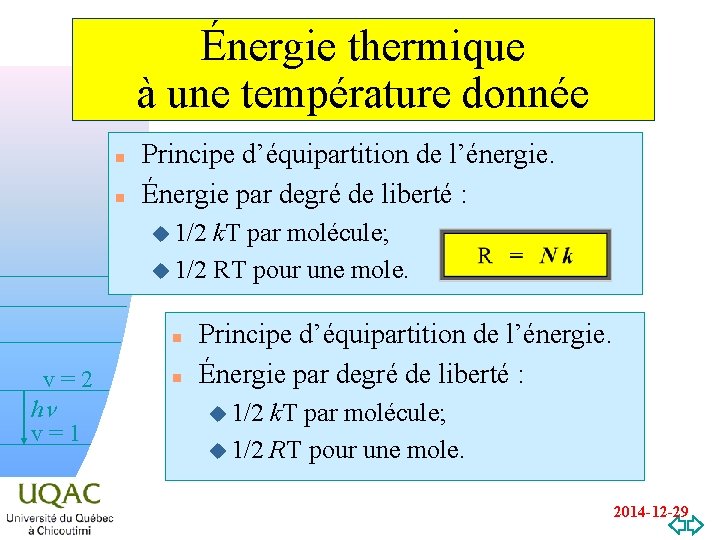
Énergie thermique à une température donnée n n Principe d’équipartition de l’énergie. Énergie par degré de liberté : u 1/2 k. T par molécule; u 1/2 RT pour une mole. n v=2 hn v=1 n Principe d’équipartition de l’énergie. Énergie par degré de liberté : u 1/2 k. T par molécule; u 1/2 RT pour une mole. v=0 2014 -12 -29

Excitation thermique de la molécule n n v = 2 n hn v=1 n Transformation Intramoléculaire Rotation Vibration 10 % dissociation 10 % saut électr. 10 % ionisation Énergie nécessaire Température à atteindre (k. J/mol) (K) 0, 10 - 2, 5 30 - 60 12 - 50 24 - 120 50 - 135 15 - 300 3 500 - 7 000 1 500 - 6 000 2 850 - 14 000 5 700 - 16 000 v=0 2014 -12 -29

Répartition thermique des molécules entre divers états énergétiques en vibration n La loi statistique de distribution de MAXWELL -BOLTZMANN montre que : Pour un niveau vibrationnel, l’énergie est : v =rapport 2 Le pour les niveaux u = 1 et u = 0 est : hn v=1 v=0 2014 -12 -29

Répartition thermique des molécules en vibration Populations relatives v=2 hn v=1 v=0 2014 -12 -29

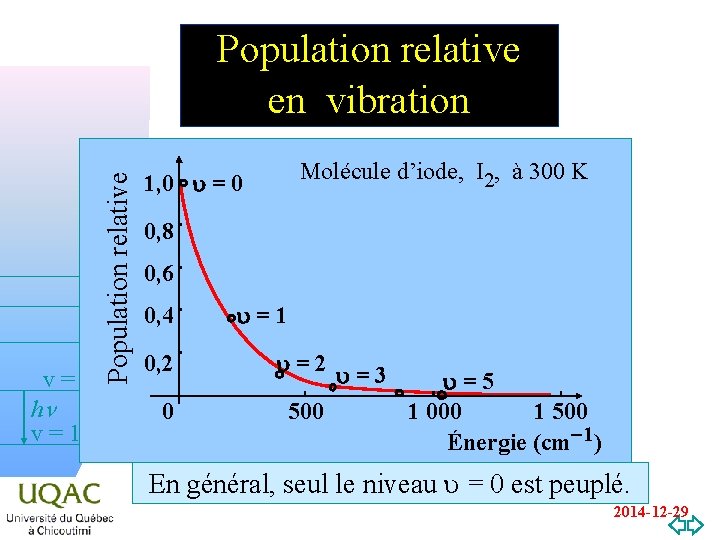
v=2 hn v=1 v=0 Population relative en vibration Molécule d’iode, I 2, à 300 K 1, 0 u = 0 0, 8 0, 6 0, 4 0, 2 0 u=1 u=2 u=3 500 u=5 1 000 1 500 Énergie (cm-1) En général, seul le niveau u = 0 est peuplé. 2014 -12 -29

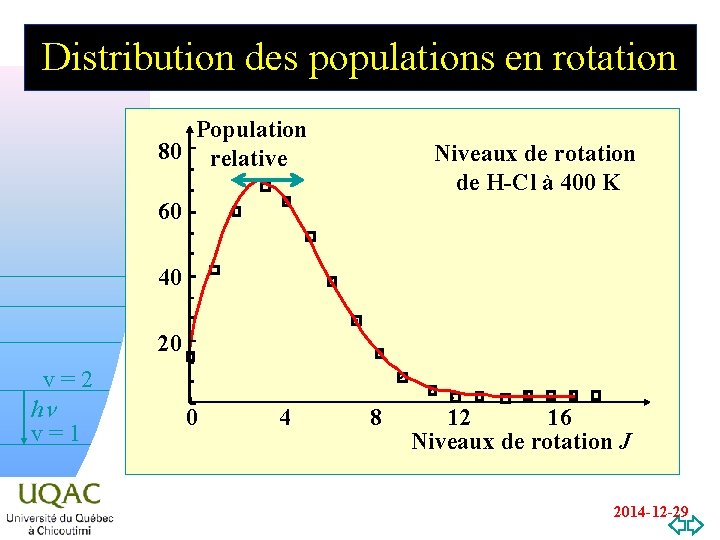
Distribution des populations en rotation Population 80 relative Niveaux de rotation de H-Cl à 400 K 60 40 20 v=2 hn v=1 0 4 8 12 16 Niveaux de rotation J v=0 2014 -12 -29

Intensité des raies spectrales n n L’intensité d’une transition : u. I = u Wnm n nnm m d’atomes = Nn Anm hnnm L’intensité d’une raie en absorption : u Iabs v=2 hn v=1 L’intensité d’une raie en émission : nombre u Iémis n Wnm hnnm = Nn Anm = Nm Bmn hnnm rn probabilité de transition densité du fond continu v=0 2014 -12 -29

Répartition thermique des molécules en rotation Populations relatives de H-Cl : v=2 hn v=1 v=0 2014 -12 -29

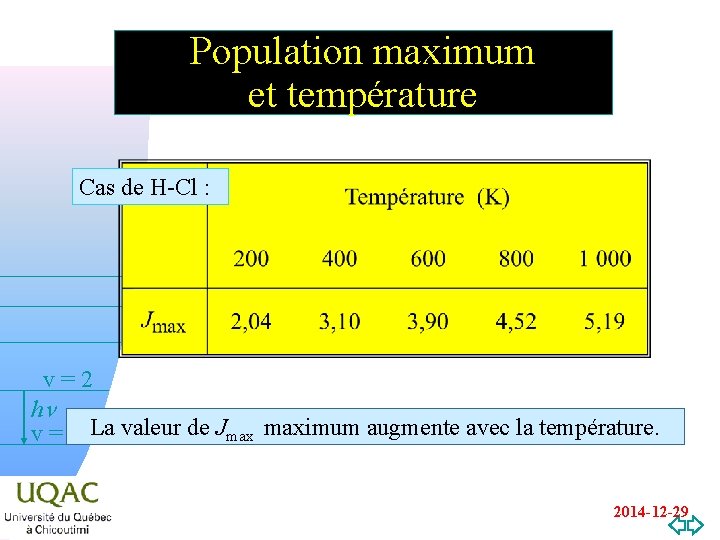
Population maximum et température Cas de H-Cl : v=2 hn v = 1 La valeur de Jmax maximum augmente avec la température. v=0 2014 -12 -29

Détermination de la température de rotation Loi de Maxwell-Boltzmann : n n L’intensité des raies est liée à la population de chacun des niveaux. N(J) est maximum pour d. Nj /d. J = 0 : v=2 hn v=1 v=0 n De Jmax on peut obtenir la valeur de la température de rotation. 2014 -12 -29

Intérêt des spectres d’absorption des molécules n Identification de la molécule (analyse) : u Analyse n Dosage : u Analyse n v=2 hn v=1 v=0 dans l’espace, les flammes, . . . Structure : u Moment n quantitative. Température de la molécule : u Espèces n qualitative. d’inertie, longueur de liaison. . . Théorie. 2014 -12 -29

Conclusion n n v=2 hn v=1 n À la température ordinaire, quelques dizaines (approximativement) de niveaux d’énergie de rotation sont peuplés. Dans le cas de la vibration, les molécules se retrouvent en très grande majorité dans le niveau de vibration fondamental. Les spectres de vibration - rotation sont de très grande utilité théorique et pratique. v=0 2014 -12 -29
 Définition bilan thermique du corps humain
Définition bilan thermique du corps humain Tirez pas sur le scarabée résumé complet
Tirez pas sur le scarabée résumé complet Le petit prince résumé chapitre par chapitre
Le petit prince résumé chapitre par chapitre Le petit prince résumé
Le petit prince résumé Lecture analytique petit pays incipit
Lecture analytique petit pays incipit Des des des
Des des des Lieux de fabrication des objets techniques
Lieux de fabrication des objets techniques Cartographie enceinte thermique
Cartographie enceinte thermique Mécanique des fluides
Mécanique des fluides Relais thermique symbole
Relais thermique symbole Spire de frager contacteur
Spire de frager contacteur Centrale thermique de mohammedia
Centrale thermique de mohammedia Volume cylindre creux
Volume cylindre creux Transfert thermique
Transfert thermique Thermogénèse
Thermogénèse Confort visuel et thermique
Confort visuel et thermique Bilan thermique douai
Bilan thermique douai Manometre
Manometre Tp transfert thermique correction
Tp transfert thermique correction Energie thermique
Energie thermique Circuit huile moteur diesel
Circuit huile moteur diesel