III SLOEN VCESLOKOVCH SOUSTAV Pklady vceslokovch soustav roztok








- Slides: 11

III. SLOŽENÍ VÍCESLOŽKOVÝCH SOUSTAV Příklady vícesložkových soustav: roztok soli ve vodě (složky Na. Cl, H 2 O); mosaz (složky měď , zinek).

SLOŽENÍ SOUSTAV vyjadřujeme: Ø zlomkem: S je soustava (roztok), B je složka hmotnostní (1) molární (2) objemový (pro plyny) (3) Ø molární koncentrací: (4)

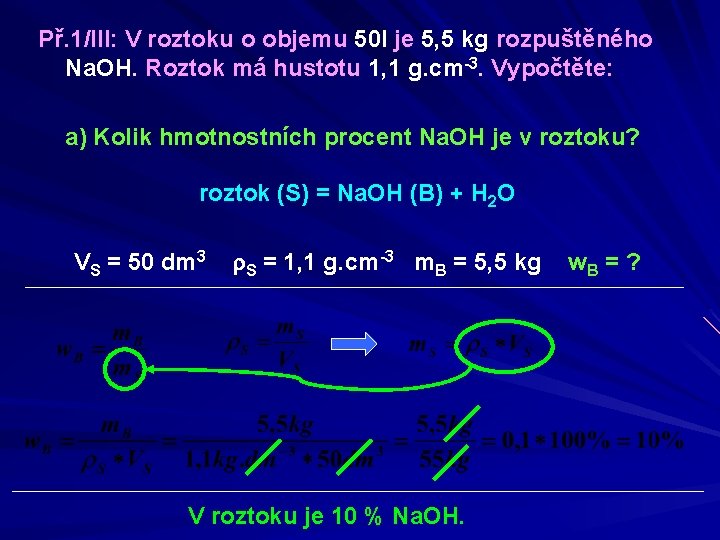
Př. 1/III: V roztoku o objemu 50 l je 5, 5 kg rozpuštěného Na. OH. Roztok má hustotu 1, 1 g. cm-3. Vypočtěte: a) Kolik hmotnostních procent Na. OH je v roztoku? b) Molární koncentraci roztok (S) = Na. OH (B) + H 2 O VS = 50 dm 3 r. S = 1, 1 g. cm-3 m. B = 5, 5 kg a) w = ? b) c = ?

Př. 1/III: V roztoku o objemu 50 l je 5, 5 kg rozpuštěného Na. OH. Roztok má hustotu 1, 1 g. cm-3. Vypočtěte: a) Kolik hmotnostních procent Na. OH je v roztoku? roztok (S) = Na. OH (B) + H 2 O VS = 50 dm 3 r. S = 1, 1 g. cm-3 m. B = 5, 5 kg V roztoku je 10 % Na. OH. w. B = ?

Př. 1/III: V roztoku o objemu 50 l je 5, 5 kg rozpuštěného Na. OH. Roztok má hustotu 1, 1 g. cm-3. Vypočtěte: a) Kolik hmotnostních procent Na. OH je v roztoku? VS = 50 dm 3 Výpočet úvahou r. S = 1, 1 g. cm-3 m. B = 5, 5 kg w. B = ? m. S = ρ S * V S m. S = 1, 1 kg. dm-3 * 50 dm 3 = 55 kg Na. OH 55 kg……. . 100 % 5, 5 kg 55 kg 5, 5 kg…………. x % V roztoku je 10% Na. OH.

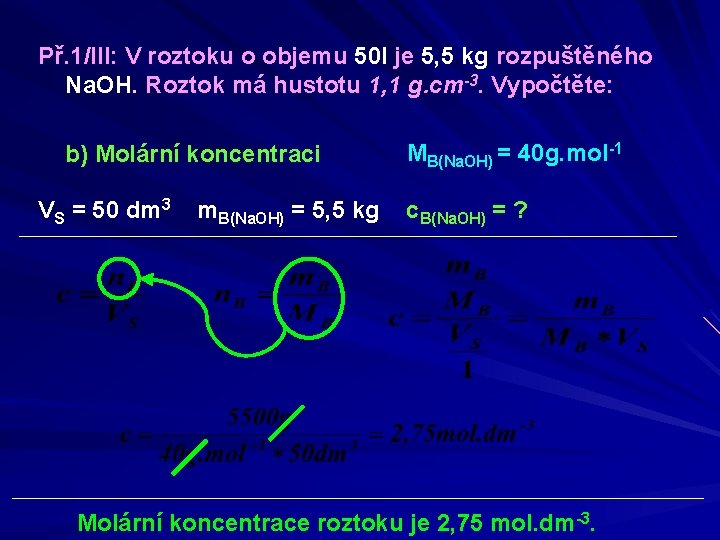
Př. 1/III: V roztoku o objemu 50 l je 5, 5 kg rozpuštěného Na. OH. Roztok má hustotu 1, 1 g. cm-3. Vypočtěte: b) Molární koncentraci VS = 50 dm 3 m. B(Na. OH) = 5, 5 kg MB(Na. OH) = 40 g. mol-1 c. B(Na. OH) = ? Molární koncentrace roztoku je 2, 75 mol. dm-3.

Př. 2/III: Vypočtěte koncentraci kyseliny chlorovodíkové HCl jestliže je ve 300 cm 3 roztoku rozpuštěno 5 g HCl. VS = 300 cm 3 m. B(HCl) = 5 g c. B(HCl) = ? [mol. dm-3] MB(HCl) = 36, 5 g. mol-1 Převod objemu: 300 cm 3 301 0, 3 m 3 d 1000 x zvětším jednotku, proto musím 1000 x zmenšit číslo Molární koncentrace roztoku je 0, 46 mol. dm-3.

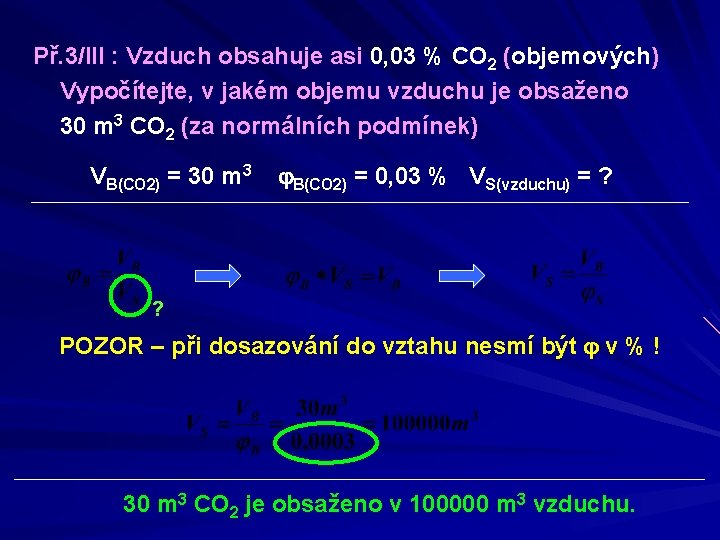
Př. 3/III : Vzduch obsahuje asi 0, 03 % CO 2 (objemových) Vypočítejte, v jakém objemu vzduchu je obsaženo 30 m 3 CO 2 (za normálních podmínek) VB(CO 2) = 30 m 3 B(CO 2) = 0, 03 % VS(vzduchu) = ? ? POZOR – při dosazování do vztahu nesmí být v % ! 30 m 3 CO 2 je obsaženo v 100000 m 3 vzduchu.

Př. 3/III : Vzduch obsahuje asi 0, 03 % CO 2 (objemových) Vypočítejte, v jakém objemu vzduchu je obsaženo 30 m 3 CO 2 (za NP) VÝPOČET ÚVAHOU VCO 2 = 30 m 3 CO 2 = 0, 03 % mvzduchu = ? CO 2 30 m 3 0, 03% 30 m 3……. . 0, 03 % x m 3. …………. 100 % Vzduch V=? 30 m 3 CO 2 je obsaženo v 100000 m 3 vzduchu.

Př. 4/III : VYPOČÍTEJTE DOMA a) Kolik gramů uhličitanu sodného je třeba k přípravě 5% -ního (hmotnostní %) roztoku, jehož objem je 2 dm 3. b) Hustota roztoku je 1 kg. dm-3. (100 g) c) Jaká bude molární koncentrace roztoku? (0, 472 mol. dm-3) Př. 5/III : VYPOČÍTEJTE DOMA Vzduch má objemové složení: 28, 09% dusíku, 20, 95% kyslíku, 0, 93% argonu a 0, 03% oxidu uhličítého. Vypočítejte objemy jednotlivých plynů v místnosti s rozměry 10 m x 3 m. Výpočet objemu místnosti V = a*b*c (300 m 3) (84, 3 m 3 N 2; 62, 3 m 3 O 2; 2, 79 m 3 Ar; 0, 09 m 3 CO 2)






















