Hukum Pertama Termodinamika 1 AMALIA SHOLEHAH JURUSAN TEKNIK












- Slides: 15

Hukum Pertama Termodinamika 1 AMALIA SHOLEHAH JURUSAN TEKNIK METALURGI FT - UNTIRTA Amalia Sholehah 2/16/2022

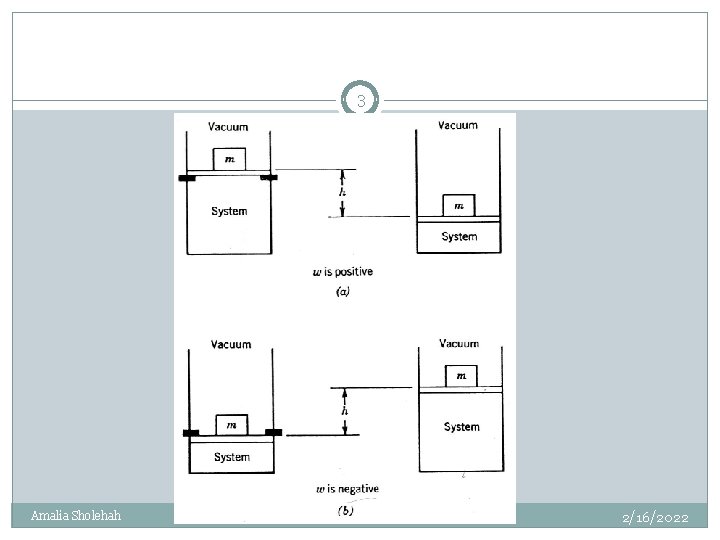
Kalor dan Kerja 2 Kalor (q) adalah bentuk energi yang berpindah akibat perbedaan suhu. Kerja (w) adalah energi (selain kalor) yang berpindah secara mekanis. w = - ∫ p d. V w bernilai positif bila lingkungan melakukan kerja terhadap lingkungan w bernilai negatif bila sistem melakukan kerja terhadap lingkungan Amalia Sholehah 2/16/2022

3 Amalia Sholehah 2/16/2022

Hukum Pertama Termodinamika 4 “Energi tidak dapat diciptakan dan tidak dapat dimusnahkan. ” Bentuk energi dapat berubah Energi total nilainya tetap Amalia Sholehah 2/16/2022

5 Amalia Sholehah 2/16/2022

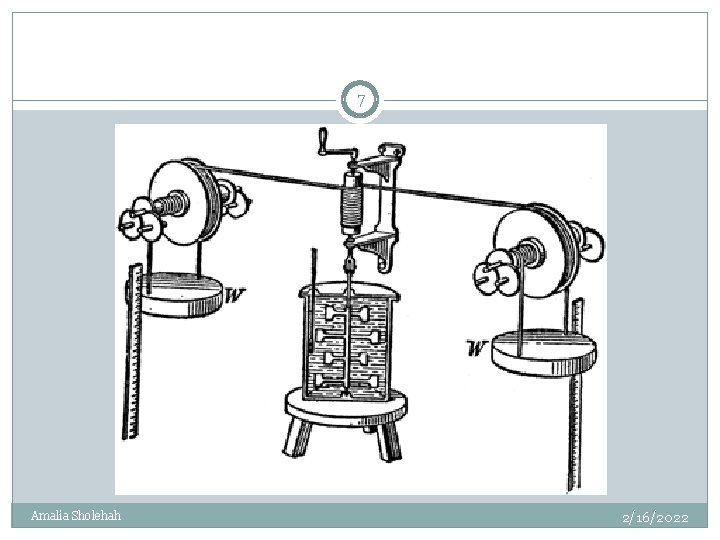
Percobaan Joule (1843 – 1878) 6 Water was heated by performing work on it No exchange of heat between system and surroundings Temperature rise depends only on the amount of work done on the system Amalia Sholehah 2/16/2022

7 Amalia Sholehah 2/16/2022

Energi Dalam (U) 8 Energi total yang dimiliki oleh sistem U = q + w d. U = đq + đw = đq - p d. V Untuk gas ideal, U = 0 Amalia Sholehah 2/16/2022

Entalpi (H) 9 Dalam proses kimia, umumnya perubahan keadaan berlangsung dalam tekanan atmosfir tetap Dari persamaan energi dalam d. U = đq - p d. V p diartikan sebagai tekanan dari sistem Bila perubahan berlangsung pada tekanan tetap, maka U = qp - p V qp = U + p. V Amalia Sholehah 2/16/2022

10 qp dinyatakan sebagai kalor reaksi pada tekanan tetap yang didefinisikan sebagai entalpi (H). Entalpi menyatakan energi yang terkandung dalam suatu sistem kimia pada suhu dan tekanan tertentu. qp = U + p. V H = U + p. V qp = H Amalia Sholehah 2/16/2022

Kapasitas Kalor (C) 11 Kalor yang dibutuhkan untuk menaikkan suhu sistem sebesar satu derajat. Ada dua macam kapasitas kalor Kapasitas kalor pada volume tetap (Cv) Kapasitas kalor pada tekanan tetap (Cp) Amalia Sholehah 2/16/2022

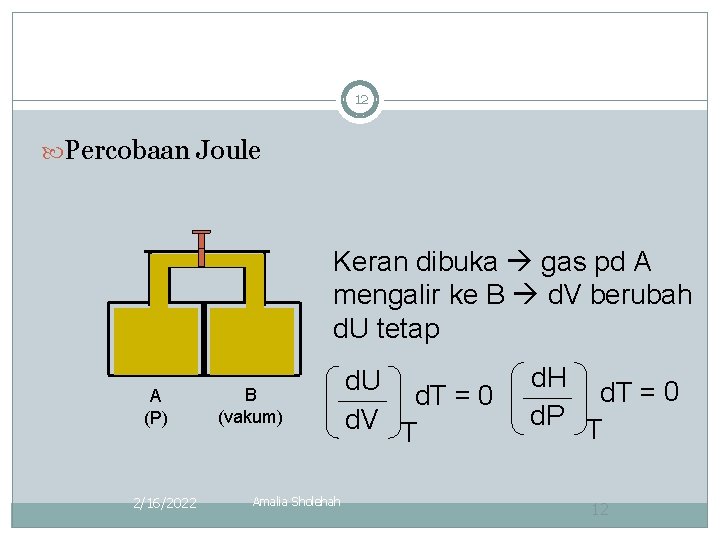
12 Percobaan Joule Keran dibuka gas pd A mengalir ke B d. V berubah d. U tetap A (P) 2/16/2022 B (vakum) Amalia Sholehah d. U d. T = 0 d. V T d. H d. T = 0 d. P T 12

PROSES ISOTERM 13 Pembahasan dibatasi untuk gas ideal Pada proses isoterm U = 0 q = -w Amalia Sholehah 2/16/2022

14 Persamaan – persamaan penting PV = n. RT w = -n. RT ln (V 2/V 1) ekspansi isotermal q = -w = n. RT ln (V 2/V 1) ekspansi isotermal Amalia Sholehah 2/16/2022

PROSES ADIABATIK 15 Pada kondisi adiabatik q=0 Persamaan penting : CP – C V = n R CP/CV = P 1 (V 1) = P 2 (V 2) Amalia Sholehah 2/16/2022
 Hukum pertama termodinamika
Hukum pertama termodinamika Hukum pertama termodinamika
Hukum pertama termodinamika 3 lapisan dalam ilmu hukum
3 lapisan dalam ilmu hukum Aplikasi hukum termodinamika 2
Aplikasi hukum termodinamika 2 Hukum termodinamik
Hukum termodinamik Prinsip carnot
Prinsip carnot Hukum termodinamika 1
Hukum termodinamika 1 Hukum termodinamika disebut juga sebagai
Hukum termodinamika disebut juga sebagai Hukum 1 termodinamika
Hukum 1 termodinamika Rumus perubahan entropi
Rumus perubahan entropi Hukum 2 termodinamika
Hukum 2 termodinamika Hukum termodinamika 2
Hukum termodinamika 2 Hukum ke nol termodinamika
Hukum ke nol termodinamika Termodinamika teknik kimia
Termodinamika teknik kimia Maksud hukum gerakan newton pertama
Maksud hukum gerakan newton pertama Maksud hukum gerakan newton pertama
Maksud hukum gerakan newton pertama