Dilatacin trmica o Expansin trmica de slidos y


















- Slides: 21

Dilatación térmica o Expansión térmica de sólidos y Líquidos

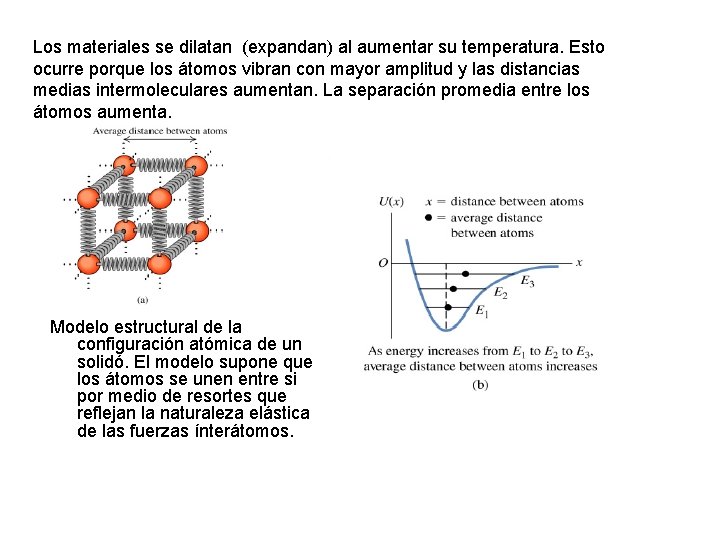
Los materiales se dilatan (expandan) al aumentar su temperatura. Esto ocurre porque los átomos vibran con mayor amplitud y las distancias medias intermoleculares aumentan. La separación promedia entre los átomos aumenta. Modelo estructural de la configuración atómica de un solidó. El modelo supone que los átomos se unen entre si por medio de resortes que reflejan la naturaleza elástica de las fuerzas ínterátomos.

Expansión lineal • Si la expansión térmica de un objeto es pequeña comparada con las dimensiones de objeto. • Si Li es la longitud inicial, la longitud L aumenta con cantidad ΔL, cuando la temperatura cambia con ΔT. Con experimentos se puede mostrar que:

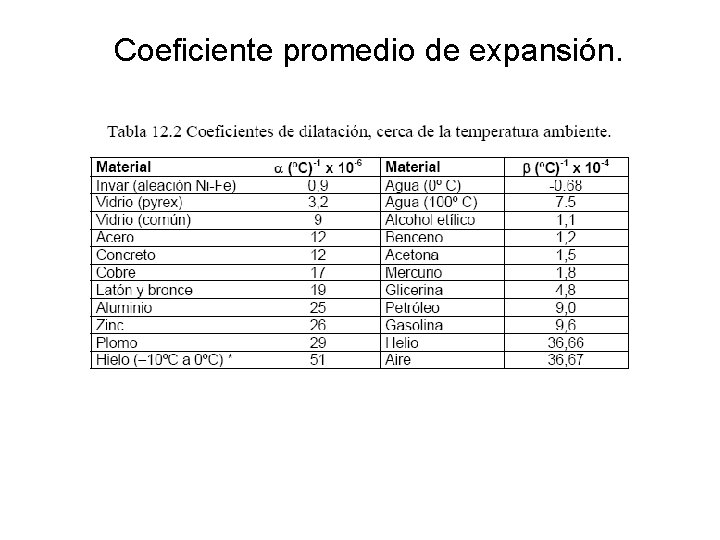
Coeficiente promedio de expansión.

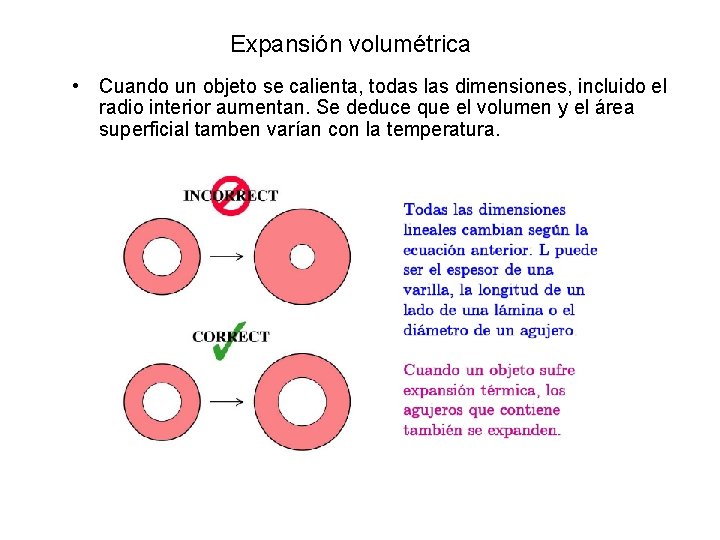
Expansión volumétrica • Cuando un objeto se calienta, todas las dimensiones, incluido el radio interior aumentan. Se deduce que el volumen y el área superficial tamben varían con la temperatura.

Expansión volumétrica • Vi=Li 3

• Se puede demonstar que: β =3 • La misma manera se define expansión de área.

DESCRIPCIÓN MACROSCÓPICA DE UN GAS IDEAL. • Tenemos un gas de masa m, contenido en un envase de volumen V a una presión P y a una temperatura T y se busca una relación entre estas variables, llamadas variables termodinámicas. • En general, la ecuación que relaciona las variables termodinámicas, que se llama ecuación de estado, es ecuación muy complicada, pero si el gas se mantiene a baja presión (baja densidad), se puede establecer en forma experimental una ecuación muy simple. • Un gas a baja densidad se le llama un gas ideal. • La mayoría de los gases a la temperatura ambiente y a la presión atmosférica, se comportan aproximadamente como gases ideales.

Se define un modelo de gas ideal: Es el gas formado por moléculas puntuales que no están sometidas a fuerzas de interacción.

• Para establecer la ecuación de estado de un gas ideal, considerar un gas encerrado en un envase cilíndrico, cuyo volumen puede variar por medio de un émbolo móvil, como se muestra en la figura. • Se supone que el cilindro no tiene fugas, por lo tanto la masa del gas permanece constante. • Para este sistema con experimentos se encuentra que:









S 10. Se corta un agujero cuadrado de 8. 00 cm de lado en una lamina de cobre. El coeficiente del cobre es 17. 0 x 10 -6 C-1. 1. Calcular el cambio del área del agujero cuando la temperatura de la lamina se incrementa 50. 0 K. 2. Representa este cambio un aumento o una disminución del área que abarca el agujero?

• S 12. A 20. 0 C, una arandela de aluminio tiene un radio interior de 5. 000 cm y una barra de latón tiene un diámetro de 5. 050 cm. • 1. Suponiendo que solo se calienta la arandela, que temperatura debería alcanzar para que puede deslazarse par la barra. • 2. Si se calientan los dos objetos, que temperatura deberán alcanzar ambos para que la arandela se puede deslizar por la bara. • 3. Puede funcionar este ultimo proceso.