Derivazione dellequazione di ClausiusClapeyron diagrammi di stato Diagramma





- Slides: 6

Derivazione dell’equazione di Clausius-Clapeyron (diagrammi di stato)

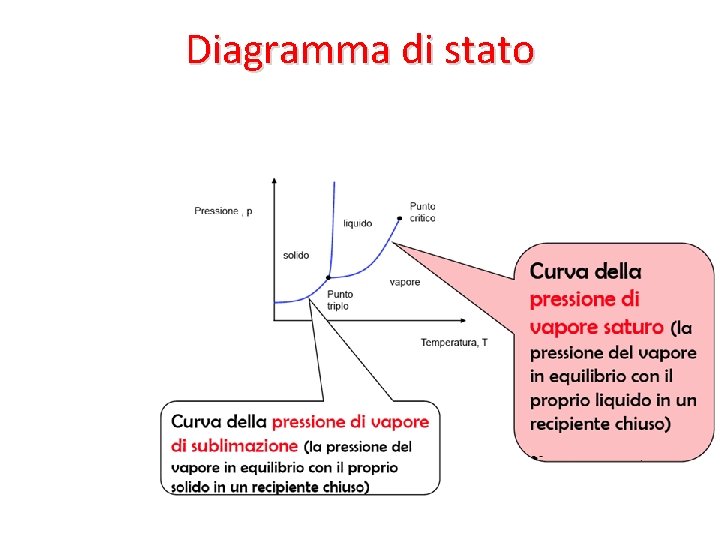
Diagramma di stato

Equazione di Clausius-Clayperon Il calore molare di vaporizzazione (ΔHvap) è l’energia richiesta per vaporizzare 1 mole di un liquido al punto di ebollizione. Consideriamo l’equilibrio liquido-vapore (ΔG=0): Gvap = Gliq In seguito ad una variazione infinitesima di T si ha un nuovo equilibrio a temperatura T + d. T e pressione P+d. P: Gvap+ d. Gvap = Gliq + d. Gliq Differenziano l’espressione dell’energia libera di Gibbs (G = H-TS): d. G = d. H – d(TS)

Equazione di Clausius-Clayperon d. G = d. H – d(TS) = d. H –Td. S – Sd. T Poichè l’entalpia è per definizione H = E + PV, introducendo questa espressione nella relazione precedente si ha: d. G = d. E + Pd. V + Vd. P – Td. S – Sd. T Dalla prima legge della termodinamica, per un processo reversibile: d. E = d. Q –d. L con d. Q = Td. S e d. L = Pd. V Quindi se d. E = Td. S - Pd. V si ha che: d. G =Td. S – Pd. V + Vd. P – Td. S - Sd. T

Equazione di Clausius-Clayperon d. G = Vd. P – Sd. T Se d. Gvap = d. Gliq allora Vvapd. P – Svapd. T = Vliqd. P – Sliqd. T (Vvap – Vlid)d. P = (Svap – Sliq)d. T d. P/d. T = (Svap – Sliq)/(Vvap – Vlid) d. P/d. T = DSvap/DV = DHvap/TDV essendo DSvap = DHvap/T Considerato che DV ~ Vvap (essendo Vvap >> Vliq) e Vvap = RT/P (comportamento ideale), Integrando: ln. P = - DHvap/ RT + c d. P/d. T = PDHvap/ RT 2 ln. P 2/P 1 = (- DHvap/ R)· (1/T 2 – 1/T 1)

Equazione di Clausius-Clayperon ln. P = - DHvap/ RT + c Riportando i valori di ln. P contro i valori di 1/T per un dato liquido, ottenuti sperimentalmente da misure di pressione di vapore a differenti temperature, si ottiene una retta dalla cui pendenza di ricava il DHvap ln. P 2/P 1 = - DHvap/ R· (1/T 2 – 1/T 1) Conoscendo il valore di P di vapore ad una certa temperatura T 1 è possibile calcolare quello della pressione ad un altro valore di T (T 2), ammettendo che il DHvap sia costante in quell’intervallo di T. Praticamente le due T non devono differire più di 10 -15 °C.