CTM Constitution et transformations de la matire CTM
















- Slides: 17

CTM Constitution et transformations de la matière

CTM 2 Composition des solutions aqueuses

I) Notion de concentration A) Solution aqueuse Une solution est un mélange. Le solvant est le composant majoritaire du mélange. Le soluté est l’espèce qui est dispersée dans le solvant. Solvant + Soluté(s) = Solution Remarque : On parle de solution aqueuse lorsque le solvant est l’eau. La limonade est une solution aqueuse. Les principaux solutés sont le sucre, le CO 2 et l’acide citrique.

B) Concentration en soluté La concentration en masse (en g·L-1) d’un soluté est la masse m (en g) de soluté dissous dans le volume V (en L) de la solution. γ= m/V ØExemple : si on dissout 1 g de sel dans 1/2 L de soupe, la concentration en sel de la soupe sera de: γsel= 1/0, 5=2 g/L. Remarque: La concentration d’un soluté en solution est à distinguer de la masse volumique de la solution. Les deux grandeurs s’expriment parfois dans la même unité mais ne représentent pas la même chose. La masse volumique d’une substance concerne la masse d’un ensemble. La concentration concerne la masse d’un soluté dans un ensemble. Exemple : concentration en sucre d’un sirop : γsucre=20 g/L. Masse volumique du sirop : ρsirop=1180 g/L.

B) Concentration maximum La solubilité est la concentration à partir de laquelle un soluté ne peut plus se dissoudre davantage. La solubilité est donc la concentration maximum d'un soluté dans un solvant donné. Application: La solubilité du chlorure de sodium (sel) est de s = 358 g⋅L-1. Quelle masse m de sel peut-on espérer récolter dans un marais salant à partir de 1, 2 m 3 d’une solution saturée?

Application: La solubilité du chlorure de sodium (sel) est de s = 358 g⋅L-1. Quelle masse m de sel peut-on espérer récolter dans un marais salant à partir de 1, 2 m 3 d’une solution saturée? Corrigé : 1, 2 m 3 =1, 2× 103 L m=s⋅V=358× 1, 2× 103 g m=4, 3× 105 g =4, 3× 102 kg. La masse du sel qu’on pourra espérer récolter est de 4, 3× 102 kg.

II) Préparation de solutions a) Dissolution: La dissolution est la dispersion d’un soluté dans un solvant. Agiter permet d’accélérer la dissolution ainsi que d’homogénéiser la solution finale. Chauffer permet souvent d’accélérer la dissolution et d'augmenter la solubilité en général. Attention toutefois à ne pas évaporer le solvant !

b) Dilution: Une dilution est la diminution de la concentration d’une solution par ajout de solvant sans ajout de soluté. VOCAVULAIRE: Ø Diluer : ajouter du solvant sans ajouter de soluté. Ø Dissoudre : disperser un soluté dans un solvant. Ø Solution fille : solution obtenue après dilution. Ø Solution mère : solution initiale qui va être diluée. Ø Trait de jauge : marque ou trait qui indique le volume.

c) Conservation de la masse: Quelle que soit la technique, la masse de soluté prélevée se retrouve toujours dans la solution préparée. Cas de la dissolution : La masse de soluté pesée est égale à celle qui se retrouve en solution: msoluté pesé=msoluté en solution =γsolution⋅Vsolution.

Cas de la dilution : La masse de soluté prélevée dans la solution mère est égale à la masse de soluté contenue dans la solution fille: mmère =mfille On a donc : γmère ⋅Vmère=γfille⋅Vfille. Soit : γmère /γfille =Vfille /Vmère =F = facteur de dilution.

Application Pour diluer par 5 une solution mère (F=5) dans une fiole de 100, 0 m. L, Vmère=Vfille/5 =100/5=20 m. L. Il faut donc prélever 20 m. L de solution mère à la pipette jaugée.

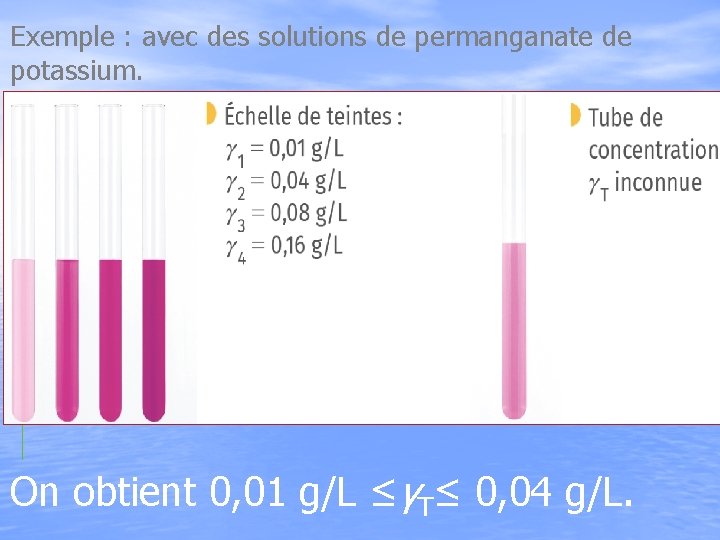
III) Détermination de concentrations A) Échelle de teintes: Lorsqu’une espèce colorée est diluée, sa couleur devient plus claire. Echelle de teintes

Exemple : avec des solutions de permanganate de potassium. On obtient 0, 01 g/L ≤γT≤ 0, 04 g/L.

B) Courbe d’étalonnage: Lorsque l’on peut mesurer une grandeur physique (notée G) en lien avec la concentration (notée γ), on peut montrer graphiquement ce lien. Graphiquement, on déduit γ=70 g/L

Dissolution : Un soluté est introduit en solution. Fiches méthode 14 et 15, p. 331 -332

Dilution : Ajout de solvant à une solution qui devient moins concentrée. Fiches méthode 14 et 15, p. 331 -332

FIN CTM 2