CHIMIE TS chapitre 7 suite des piles usuelles




- Slides: 6

CHIMIE TS chapitre 7 suite des piles usuelles

III/ Quelques piles usuelles 1/ Pile saline (Leclanché) (anode) Les deux couples redox de cette pile sont : Mn. O 2/Mn 2+ et Zn 2+/Zn. (cathode) A la borne positive (cathode), il y a réduction de Mn. O 2 en Mn 2+ : Mn. O 2 (s) + 4 H+ (aq) + 2 e- = Mn 2+ (aq) + 2 H 2 O (l) A la borne négative (anode) il y a oxydation de Zn en Zn 2+ : Zn (s) = Zn 2+ (aq) + 2 e-

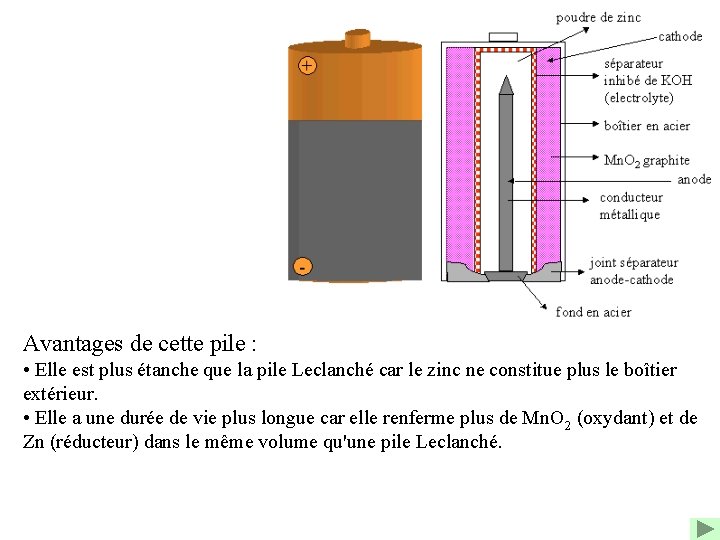
2/ Pile alcaline Il s'agit d'une variante de la pile Leclanché. Cette pile est appelée alcaline car elle fonctionne en milieu basique (KOH). A la borne positive (cathode), il y a réduction de Mn. O 2 en Mn 2+ : Mn. O 2 + 2 H 2 O + 2 e- = Mn(OH)2 + 2 OH- A la borne négative (anode), il y a oxydation de Zn en Zn(OH)2 : Zn + 2 OH- = Zn(OH)2 + 2 e-

Avantages de cette pile : • Elle est plus étanche que la pile Leclanché car le zinc ne constitue plus le boîtier extérieur. • Elle a une durée de vie plus longue car elle renferme plus de Mn. O 2 (oxydant) et de Zn (réducteur) dans le même volume qu'une pile Leclanché.

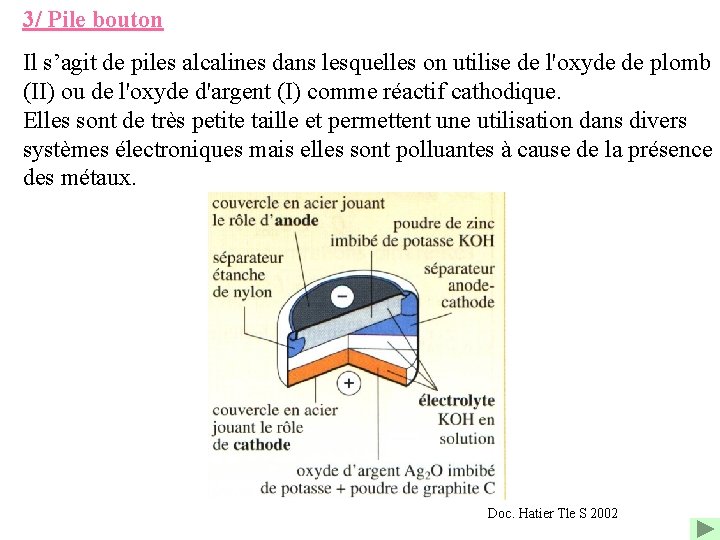
3/ Pile bouton Il s’agit de piles alcalines dans lesquelles on utilise de l'oxyde de plomb (II) ou de l'oxyde d'argent (I) comme réactif cathodique. Elles sont de très petite taille et permettent une utilisation dans divers systèmes électroniques mais elles sont polluantes à cause de la présence des métaux. Doc. Hatier Tle S 2002

4/ Pile à combustible Une pile à combustible réalise dans deux compartiments, séparés par un électrolyte, les demi-réactions d'oxydation du dihydrogène (combustible) et de réduction du dioxygène (comburant). Le bilan est la synthèse de l'eau. Cette synthèse peut être effectuée en milieu basique (pile alcaline) ou en milieu acide (pile acide). Voir animation flash, exercice et expérience du cours











