Aggregatszustand Aggregation Anordnung von Teilchen in einem Gegenstand






- Slides: 9

Aggregatszustand Aggregation: Anordnung von Teilchen in einem Gegenstand. (von lat. aggregare anhäufen, zusammensetzen) 3 Grundprinzipien der Teilchenanordnung: fest, flüssig, gasförmig Phasenübergänge 1

„fest“ Im Festkörper ist die räumliche Beziehung zwischen den Teilchen fixiert (näherungsweise harmonische Gitterschwingungen). • Anordnung „regelmäßig“: Kristall z. B. würfelförmig, tetragonal, orthorhombisch, monoklin, trigonal, hexagonal (7 Punktgruppen) charakteristische Größe: Gitterkonstante • Anordnung unstrukturiert ohne Translationssymmetrie: amorph (Glas gilt als „unterkühlte“ Flüssigkeit) Phasenübergänge 2

„flüssig“ In Flüssigkeiten liegen die Teilchen dicht an dicht, sind aber gegeneinander beweglich (kaum feste Gleichgewichtslagen der Schwingungen) - Glas besitzt eine Verteilung von Gleichgewichtslagen („Doppelmuldenpotential“) - Alle Materie ist kompressibel („Flüssigkeiten sind inkompressibel“ gilt nur als Abgrenzung zu den Gasen) - Flüssigkeiten nehmen jede vorgegebene Form an 3

„gasförmig“ Im idealen Gas sind die Teilchen frei gegeneinander beweglich. Sie haben nur durch elastische Stöße Kontakt miteinander (Die kinetische Energie der Teilchen ändert sich nicht durch die Stöße; die innere Energie eines Systems von vielen Teilchen ändert sich nicht). Zwischen den Stößen bewegen sie sich gleichförmig: v ist ein Maß für die innere Energie des Gases λ, die mittlere freie Weglänge, ein Maß für den Druck im Gas. Phasenübergänge 4

Sonderformen „Supraflüssigkeit“: § Flüssigkeit hat keine innere Reibung zwischen den Teilchen. (z. B. 4 He bei Temperaturen < 2. 16 K) § Supraflüssigkeit dringt durch engste Zwischenräume. „Plasma“: § gasförmiges Gemisch von geladenen und ungeladenen Teilchen (freien Elektronen, Ionen, Molekülen) § elektrisch leitendes Gas Phasenübergänge 5

Bindungsformen Wechselwirkung zwischen den Teilchen in Gasen, Flüssigkeiten und Festkörpern: „van der Waals“ Bindung: fluktuierende Elektronenhülle erzeugt elektr. Dipole zwischen zwei Gasatomen oder Flüssigkeitsmolekülen. Dipole ziehen sich an (gebogener Wasserstrahl nahe geladenem Luftballon) . Wasserstoffbrückenbindungen: kovalente Bindung: Gitteratome mit nicht aufgefüllten äußeren Elektronenschalen teilen sich die Valenzelektronen; z. B. Kohlenstoff im Diamant ionische Bindung: Elektrostatische Anziehung zwischen entgegengesetzt geladenen Ionen; z. B. Salze Na+Cl- 6

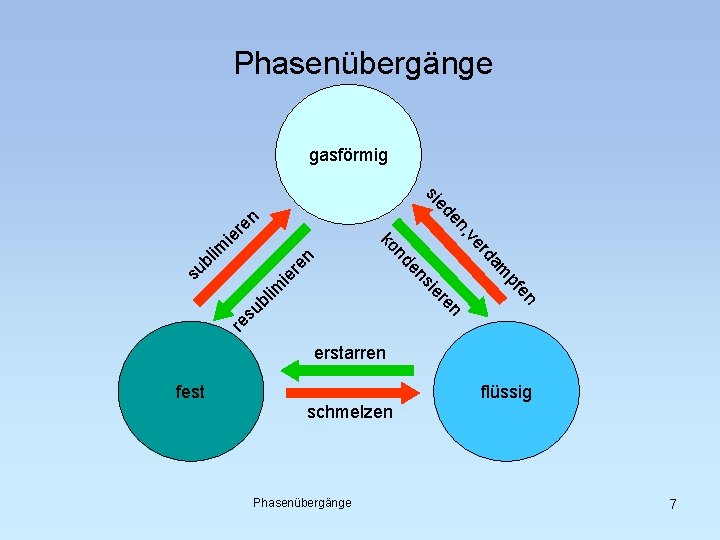
Phasenübergänge gasförmig sie re n ie re su en er bl im si en pf en am rd nd b u s ko i lim ve n, de en r e erstarren fest flüssig schmelzen Phasenübergänge 7

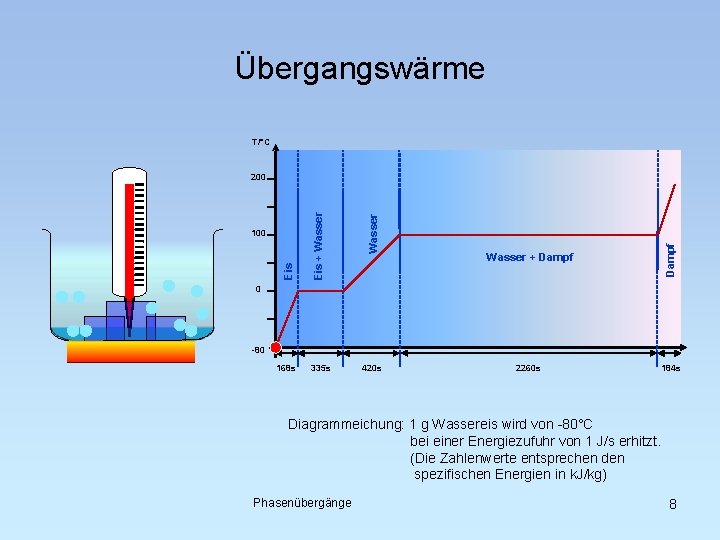
Übergangswärme T/°C 168 s 335 s 420 s 100 Wasser + Dampf Eis + Wasser Eis 200 2260 s 184 s 0 -80 Diagrammeichung: 1 g Wassereis wird von -80°C bei einer Energiezufuhr von 1 J/s erhitzt. (Die Zahlenwerte entsprechen den spezifischen Energien in k. J/kg) Phasenübergänge 8

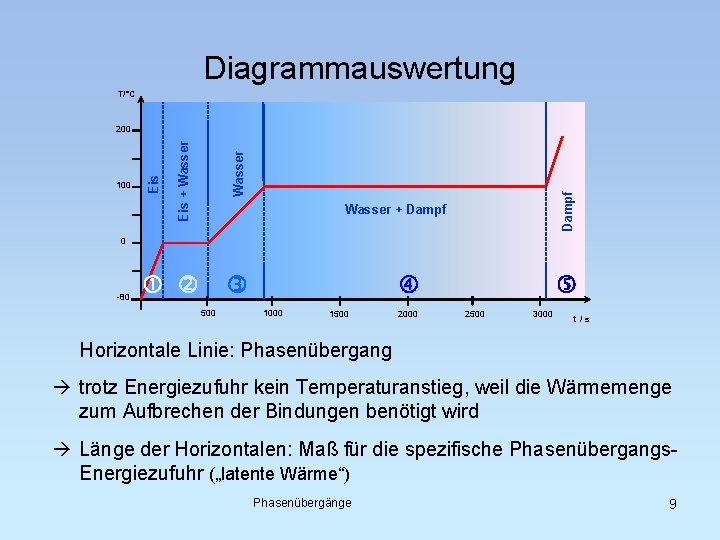
Diagrammauswertung T/°C Dampf Wasser Eis + Wasser 100 Eis 200 Wasser + Dampf 0 -80 500 1000 1500 2000 2500 3000 t/s Horizontale Linie: Phasenübergang à trotz Energiezufuhr kein Temperaturanstieg, weil die Wärmemenge zum Aufbrechen der Bindungen benötigt wird à Länge der Horizontalen: Maß für die spezifische Phasenübergangs. Energiezufuhr („latente Wärme“) Phasenübergänge 9