Adolygu Cemeg 2 Haen UWCH 1 2 1







































































































- Slides: 199

Adolygu Cemeg 2 Haen UWCH 1

2. 1 2. 2 2. 4 2. 6 2. 3 2. 5 2. 7 2

2. 1 Adeiledd Atomig 3

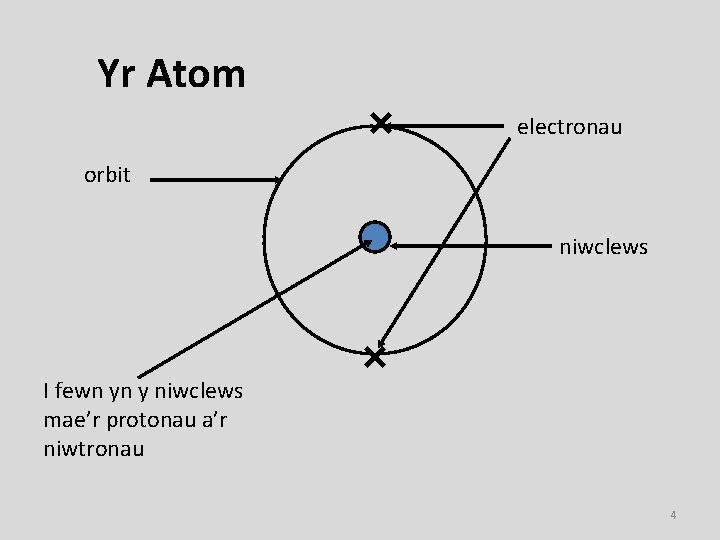
Yr Atom electronau orbit niwclews I fewn yn y niwclews mae’r protonau a’r niwtronau 4

Rhif Atomig • Darganfyddodd gwyddonwyr fod priodweddau elfennau’n ymddangos yn ddibynnol ar rif atomig. • Mae atomau’n cynnwys tri math o ronyn: Gronyn Gwefr Mas Cymharol Protonau +1 1 Niwtronau 0 1 Electronau -1 0. 0005 • Rhif Atomig = nifer y protonau mewn atom. 5

Rhif Atomig • Mae atomau o elfen arbennig bob tro yn cynnwys yr un nifer o brotonau. E. e. – 1 proton sydd gan atomau hydrogen – 6 proton sydd gan atomau carbon – 12 proton sydd gan atomau magnesiwm • Mae’r nifer o brotonau mewn atom yn cael ei adnabod fel ei rif atomig. • Hwn yw’r lleiaf o’r ddau rif a ddangosir yn y rhan fwyaf o dablau cyfnodol. 12 C 6 6

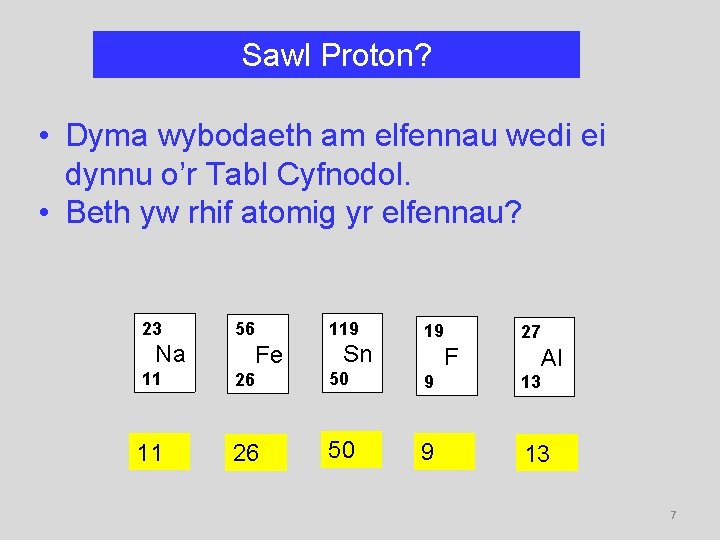
Sawl Proton? • Dyma wybodaeth am elfennau wedi ei dynnu o’r Tabl Cyfnodol. • Beth yw rhif atomig yr elfennau? 23 Na 56 Fe 119 Sn 19 F 27 Al 11 26 50 9 13 7

Sawl Proton? • Nodwch fod gan elfen nifer bendant o brotonau • Os yw’r nifer o brotonau yn cael ei newid, fe fydd yr atom yn newid i fod yn elfen wahanol. • Nid yw’r nifer o ronynnau yn y niwclews (brotonau neu niwtronau) yn newid o gwbl bron. Fe fydd hyn yn digwydd mewn adweithiau niwclear mewn adweithyddion niwclear a bomiau niwclear. 8

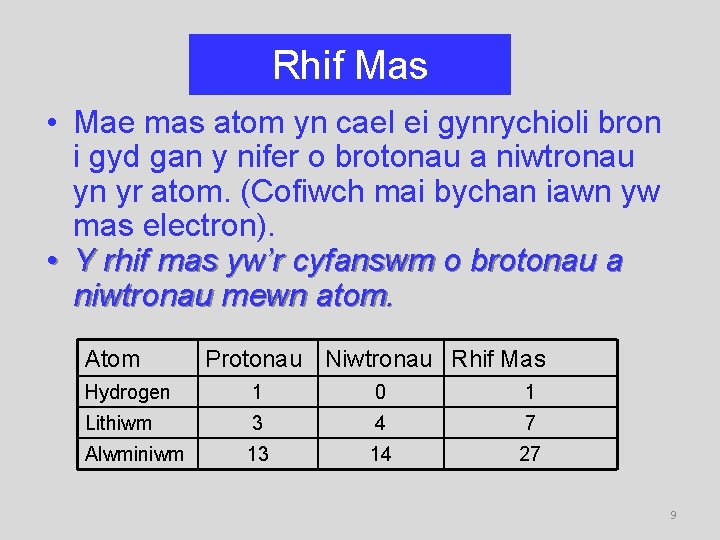
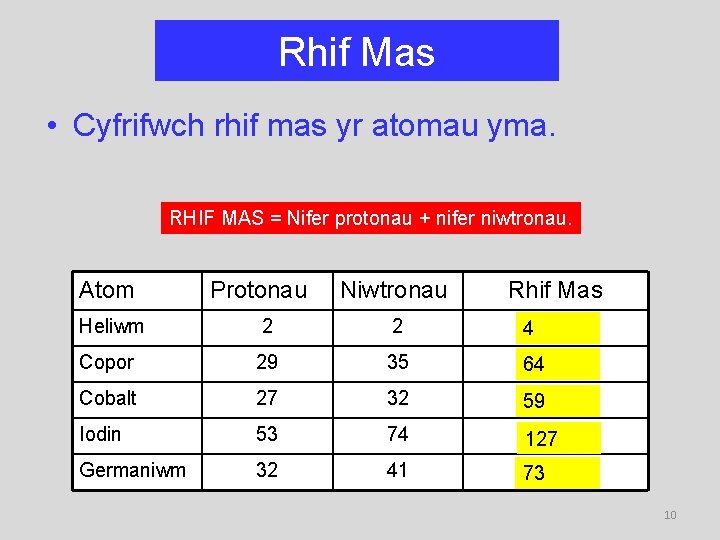
Rhif Mas • Mae mas atom yn cael ei gynrychioli bron i gyd gan y nifer o brotonau a niwtronau yn yr atom. (Cofiwch mai bychan iawn yw mas electron). • Y rhif mas yw’r cyfanswm o brotonau a niwtronau mewn atom. Atom Protonau Niwtronau Rhif Mas Hydrogen 1 0 1 Lithiwm 3 4 7 Alwminiwm 13 14 27 9

Rhif Mas • Cyfrifwch rhif mas yr atomau yma. RHIF MAS = Nifer protonau + nifer niwtronau. Atom Protonau Niwtronau Rhif Mas Heliwm 2 2 4 Copor 29 35 64 Cobalt 27 32 59 Iodin 53 74 127 Germaniwm 32 41 73 10

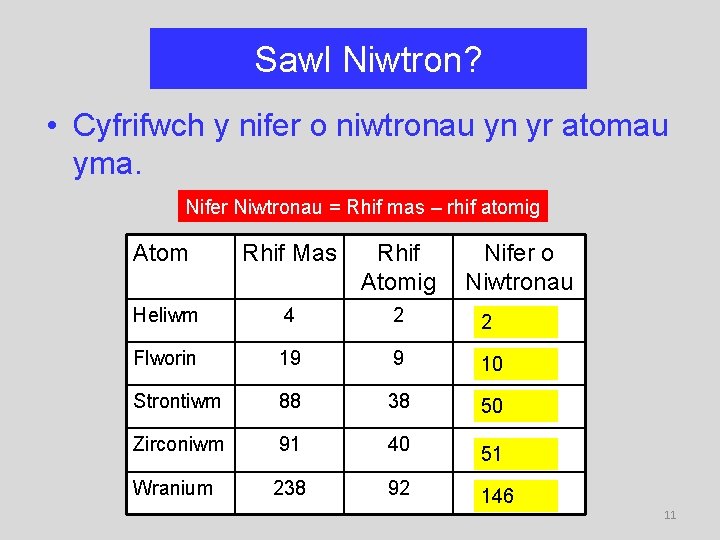
Sawl Niwtron? • Cyfrifwch y nifer o niwtronau yn yr atomau yma. Nifer Niwtronau = Rhif mas – rhif atomig Atom Rhif Mas Rhif Atomig Nifer o Niwtronau Heliwm 4 2 2 Flworin 19 9 10 Strontiwm 88 38 50 Zirconiwm 91 40 51 Wranium 238 92 146 11

Sawl Niwtron? 2 • Nid yw’n gyfan gwbl gywir i ddweud mai dim ond un math o atom sydd mewn elfen. • Er i’r nifer o brotonau mewn elfen fod yr un peth, gall atomau gynnwys nifer gwahanol o niwtronau. • Gelwir atomau gyda nifer gwahanol o niwtronau yn Isotopau. Cofiwch: Y nifer o brotonau sy’n diffinio elfen 12

Sawl Niwtron? 3 • Mae adweithiau cemegol isotopau yn debyg. (Efallai bydd ychydig o wahaniaeth mewn cyfradd adwaith). • Y rheswm am hyn yw bod ganddynt yr un nifer o brotonau ac electronau. • Nid yw’r niwtronau di-wefr yn effeithio priodweddau cemegol elfen, ond maent yn effeithio nodweddion ffisegol megys ymdoddbwynt a dwysedd. 13

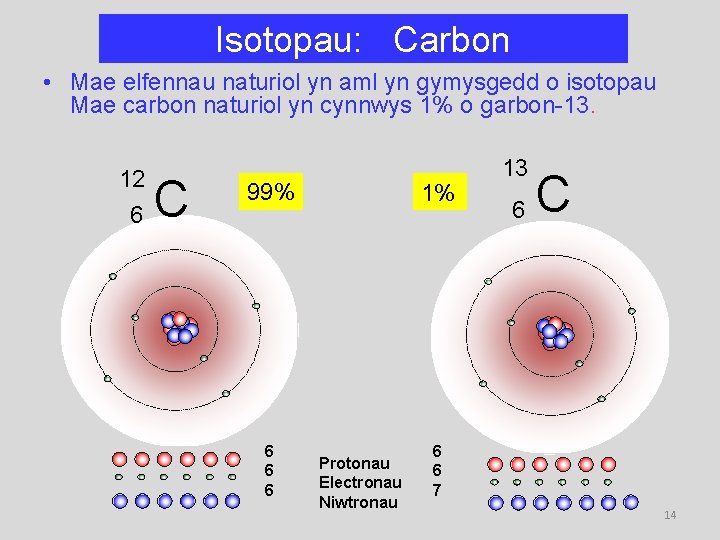
Isotopau: Carbon • Mae elfennau naturiol yn aml yn gymysgedd o isotopau Mae carbon naturiol yn cynnwys 1% o garbon-13. 12 6 C 99% 6 6 6 1% Protonau Electronau Niwtronau 13 6 C 6 6 7 14

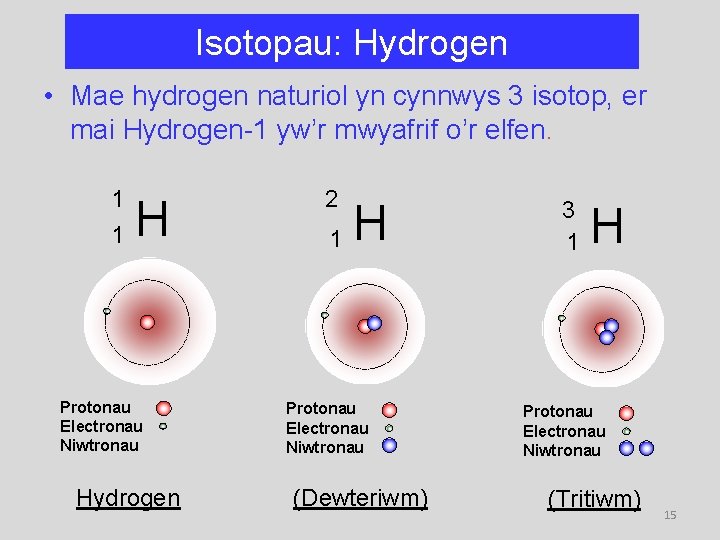
Isotopau: Hydrogen • Mae hydrogen naturiol yn cynnwys 3 isotop, er mai Hydrogen-1 yw’r mwyafrif o’r elfen. 1 1 H Protonau Electronau Niwtronau Hydrogen 2 1 H Protonau Electronau Niwtronau (Dewteriwm) 3 1 H Protonau Electronau Niwtronau (Tritiwm) 15

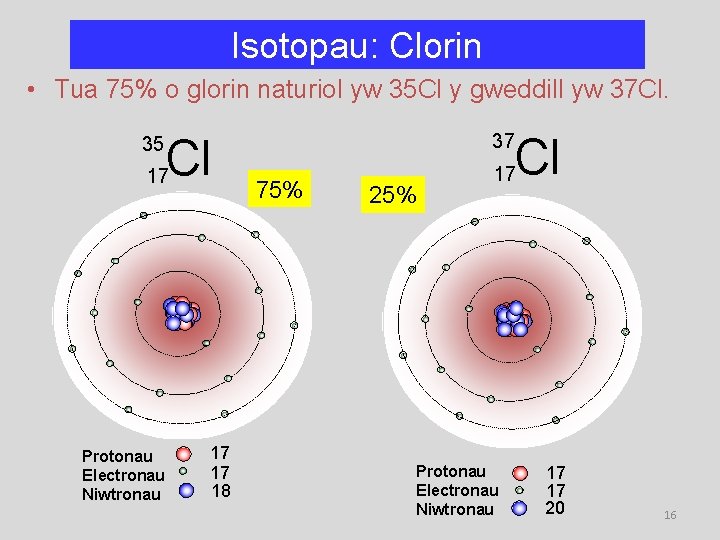
Isotopau: Clorin • Tua 75% o glorin naturiol yw 35 Cl y gweddill yw 37 Cl. 35 Cl 17 Protonau Electronau Niwtronau 17 17 18 37 75% 25% Cl 17 Protonau Electronau Niwtronau 17 17 20 16

Isotopau Ocsigen • Y rhan fwyaf o ocsigen yw O-16 ond mae tua 0. 2% yn O-18. • Ffurfiwch Dabl sy’n dangos y gronynnau ym mhob un isotop. Ocsigen -16 8 O 16 Ocsigen -18 Protonau 8 Electronau 8 Niwtronau 10 17

1. Pa un o’r canlynol sydd ddim yn ronnyn is-atomig? A. B. C. D. Proton Isotop Niwtron Electron 18

2. Mae gan yr elfen Cobalt mas atomig cymharol o 59 a rhif atomig 27. Pa un o’r gosodiadau yma sy’n wir am atom Cobalt? A. B. C. D. Mae ganddo 59 niwtron Mae ganddo 27 electron Mae ganddo 32 proton Mae’r nifer o niwtronau ac electronau yn hafal. 19

3. Mae’r Tabl Cyfnodol yn dangos haearn fel a ganlyn Dangosir fod atomau Fe: A. B. C. D. 56 yn cynnwys 56 niwtron Fe 26 yn cynnwys 30 electron yn cynnwys 26 proton yn cynnwys mwy o brotonau nag o niwtronau 20

4. Cymysgedd o isotopau yw Bromin: 80 Br Bromin-79 a Bromin-81 35 • Pa rai o’r canlynol sy’n gywir: A. Mae’r isotop yn cynnwys 35 proton B. Mae bromin 79 yn cynnwys 46 niwtron C. Mae bromin 81 yn cynnwys 44 niwtron D. Mae bromin-81 yn fwy adweithiol na bromin-79. 21

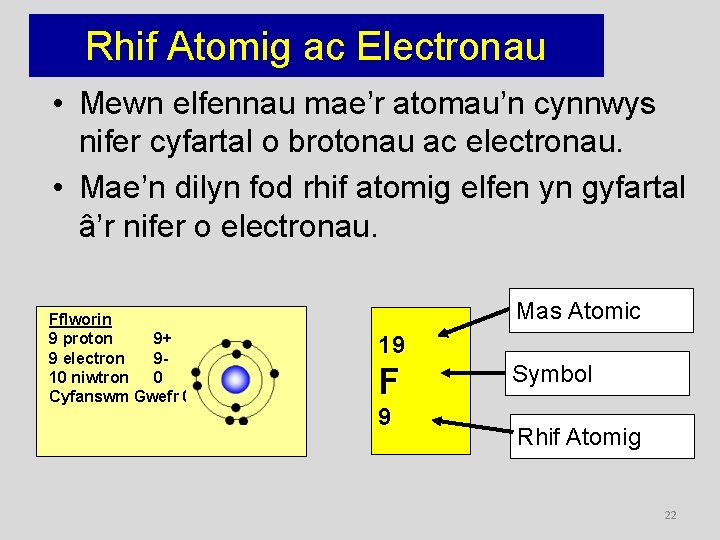
Rhif Atomig ac Electronau • Mewn elfennau mae’r atomau’n cynnwys nifer cyfartal o brotonau ac electronau. • Mae’n dilyn fod rhif atomig elfen yn gyfartal â’r nifer o electronau. Fflworin 9 proton 9+ 9 electron 910 niwtron 0 Cyfanswm Gwefr 0 Mas Atomic 19 F 9 Symbol Rhif Atomig 22

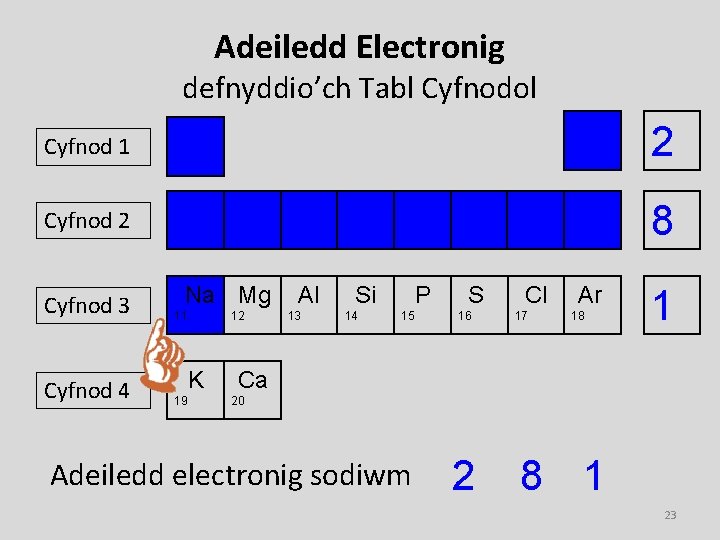
Adeiledd Electronig defnyddio’ch Tabl Cyfnodol Cyfnod 1 Cyfnod 2 Cyfnod 3 Cyfnod 4 H Li H Be H 1 4 H Mg Na 1 11 K 19 2 Ne H 8 2 1 1 3 1 He H 12 B H 5 1 C H 6 1 Al 13 H N 7 1 Si 14 1 8 P 15 O H FH 1 9 S 16 10 1 Cl 17 Ar 18 1 Ca 20 Adeiledd electronig sodiwm 2 8 1 23

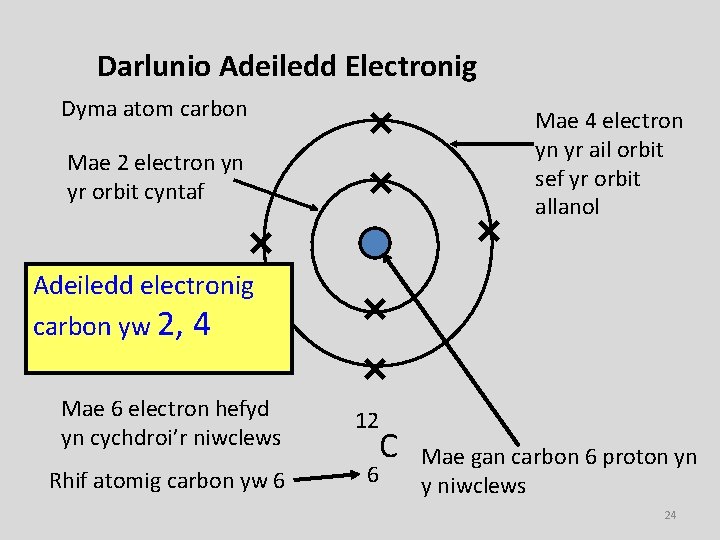
Darlunio Adeiledd Electronig Dyma atom carbon Mae 4 electron yn yr ail orbit sef yr orbit allanol Mae 2 electron yn yr orbit cyntaf Adeiledd electronig carbon yw 2, 4 Mae 6 electron hefyd yn cychdroi’r niwclews 12 Rhif atomig carbon yw 6 6 C Mae gan carbon 6 proton yn y niwclews 24

Electronau yn Cyfnod 1 1 2 3 4 5 6 7 8 1 1 2 25

Electronau yn Cyfnod 2 Mae elfennau yn yr ail gyfnod yn cynnwys 2 electron yn y plisgyn cyntaf (cyflawn) a llenwir yr ail blisgyn un electron ar y tro fel byddwch yn croesi’r cyfnod o’r chwith i’r dde. 1 2 3 4 5 6 7 2, 1 2, 2 2, 3 2, 4 2, 5 2, 6 2, 7 8 2 2, 8 Mae’r atom hwn yn arbennig am fod ganddo blisgyn allanol cyflawn. 26

Electronau yn Cyfnod 3 Mae gan elfennau yn y trydydd cyfnod blisg cyntaf ac ail cyflawn. Llenwir y trydydd plisgyn un electron ar y tro fel byddwch yn croesi’r cyfnod o’r chwith i’r dde. 1 2 3 4 5 6 7 8 3 2, 8, 1 2, 8, 2 2, 8, 3 2, 8, 4 2, 8, 5 2, 8, 6 2, 8, 7 2, 8, 8 27

2. 2 ADWEITHIAU METELAU ALCALÏAIDD A HALOGENAU 28
Metelau alcali grŵp 1 29

Dyma wybodaeth am elfennau Grŵp 1 Elfen Ymdoddbwynt Berwbwynt Adweithedd lithiwm 180 ºC 1330ºC Gweddol adweithiol sodiwm 98 ºC 890 ºC Adweithedd canolig potasiwm 64 ºC 760 ºC Adweithiol rwbidiwm 39 ºC 688 ºC Hynod adweithiol caesiwm 29 ºC 670 ºC Adweithio’n ffyrnig 30

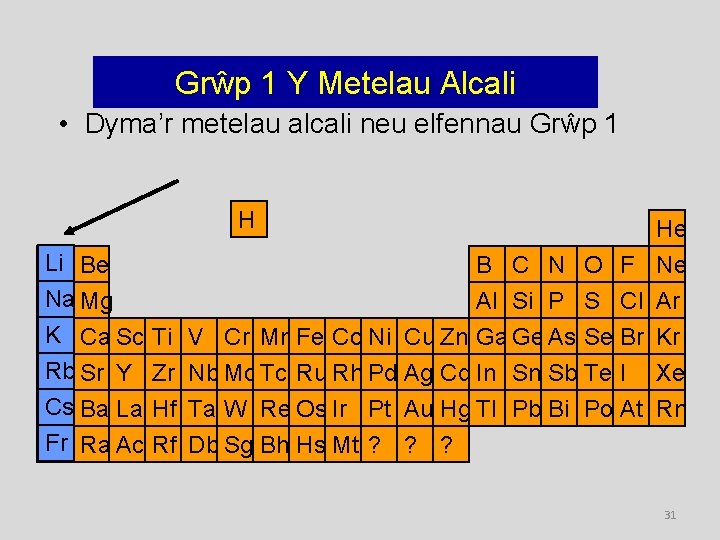
Grŵp 1 Y Metelau Alcali • Dyma’r metelau alcali neu elfennau Grŵp 1 H Li Be Na Mg K Ca Sc Rb Sr Y Cs Ba La Fr Ra Ac B C N O F Al Si P S Cl Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At He Ne Ar Kr Xe Rn Rf Db Sg Bh Hs Mt ? ? ? 31

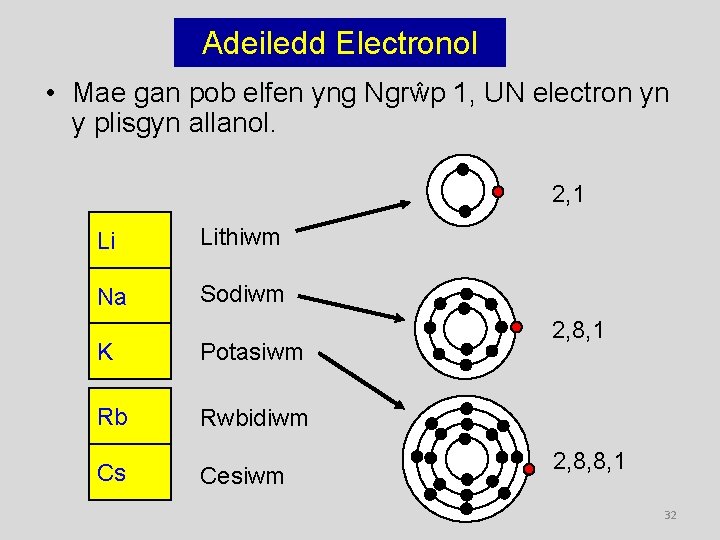
Adeiledd Electronol • Mae gan pob elfen yng Ngrŵp 1, UN electron yn y plisgyn allanol. 2, 1 Li Lithiwm Na Sodiwm K Potasiwm Rb Rwbidiwm Cs Cesiwm 2, 8, 1 2, 8, 8, 1 32

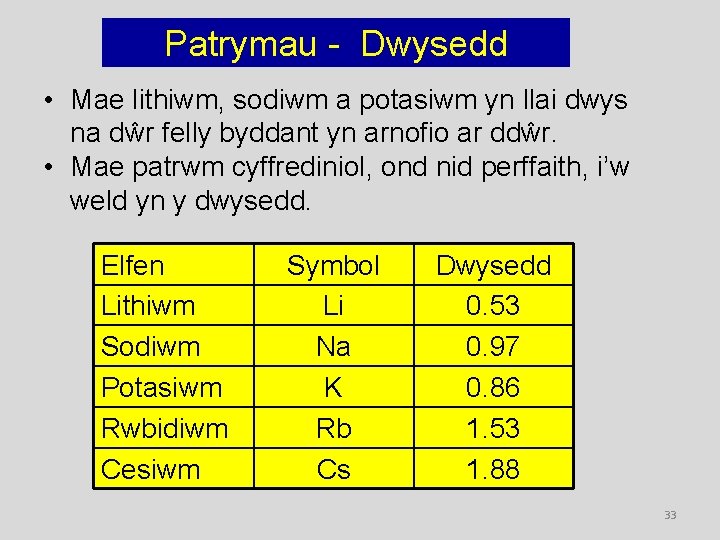
Patrymau - Dwysedd • Mae lithiwm, sodiwm a potasiwm yn llai dwys na dŵr felly byddant yn arnofio ar ddŵr. • Mae patrwm cyffrediniol, ond nid perffaith, i’w weld yn y dwysedd. Elfen Lithiwm Sodiwm Potasiwm Rwbidiwm Cesiwm Symbol Li Na K Rb Cs Dwysedd 0. 53 0. 97 0. 86 1. 53 1. 88 33

Gweithgaredd Ymdoddbwyntiau • Mae atomau Grŵp 1 yn bondio trwy ddefnyddio’r unig electron sydd yn y plisgyn allanol. • O ganlyniad mae ymdoddbwyntiau y metelau yn isel o gymharu â metelau eraill. Elfen Lithiwm Sodiwm Potasiwm Rwbidiwm Cesiwm Ymd’bwynt (o. C) 181 98 63 39 29 Rhagfynegwch yr ymdoddbwyntiau coll. 34

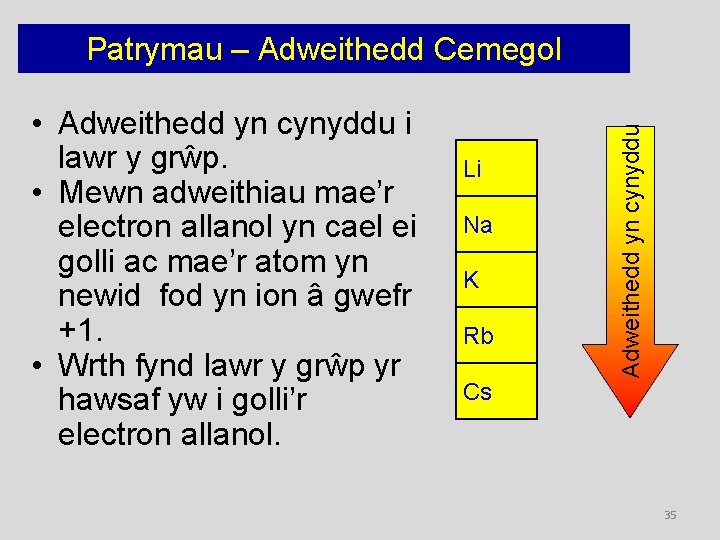
• Adweithedd yn cynyddu i lawr y grŵp. • Mewn adweithiau mae’r electron allanol yn cael ei golli ac mae’r atom yn newid fod yn ion â gwefr +1. • Wrth fynd lawr y grŵp yr hawsaf yw i golli’r electron allanol. Li Na K Rb Adweithedd yn cynyddu Patrymau – Adweithedd Cemegol Cs 35

Grwp 1 y metelau alcaliaidd Li Lithiwm Na Sodiwm K Potasiwm Elfen lleiaf adweithiol grwp 1. Mae’n adweithio gydag oscigen i ffurfio’r ocsid lithiwm + ocsigen lithiwm ocsid Mae sodiwm yn llosgi gyda fflam OREN. Wrth adweithio gyda dwr mae’n gwibio ar ben y dwr fel pelen. Gyda dwr mae sodiwm yn cynhyrchu’r nwy hydrogen ac yn creu’r alcali sodiwm hydrocsid sodiwm + dwr + hydrogen hydrocsid Elfen mwyaf adweithiol grwp 1. Mae’n tanio gyda fflam LELOG wrth gael ei roi ar ben dwr. Mae’r metelau hyn yn sgleiniog ar ol cael eu torri ac yn cael eu storio mewn olew rhag iddynt adweithio gydag ocsigen a dwr. 36

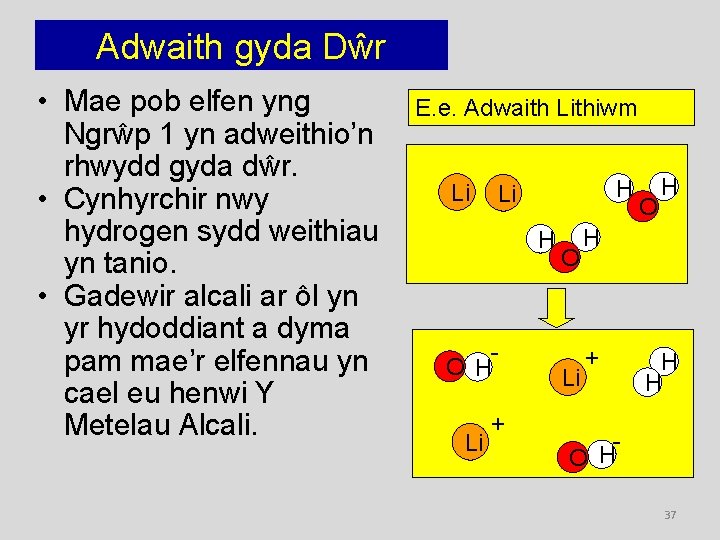
Adwaith gyda Dŵr • Mae pob elfen yng Ngrŵp 1 yn adweithio’n rhwydd gyda dŵr. • Cynhyrchir nwy hydrogen sydd weithiau yn tanio. • Gadewir alcali ar ôl yn yr hydoddiant a dyma pam mae’r elfennau yn cael eu henwi Y Metelau Alcali. E. e. Adwaith Lithiwm Li H O H Li + O Li O H H + H H H O 37

Adwaith Lithiwm gyda Dŵr • Mewn dŵr mae lithiwm yn ffisian yn gyflym a ffurfir lithiwm hydrocsid a hydrogen Lithiwm + dŵr Lithiwm hydrocsid + hydrogen 2 Li(s) + 2 H 2 O(h) 2 Li. OH(d) + H 2(n) • Mae’r hydoddiant a ffurfir yn alcali cryf. 38

Adwaith Sodiwm gyda Dŵr • Mae sodiwm yn ffisian yn gyflym gyda dŵr a bydd yn tanio os yw’n cael ei rwystro rhag symud. Sodiwm + dŵr Sodiwm hydrocsid + hydrogen 2 Na(s) + 2 H 2 O(h) 2 Na. OH(d) + H 2(n) sodiwm ar y dŵr Wedi chwyddo sodiwm yn tanio ar y dŵr 39

Gweithgaredd Potasiwm gyda Dŵr • Lithiwm yn ffisian. Adwaith sodiwm yn fwy ffyrnig. • Beth fydd yn digwydd gyda potasiwm? Beth fydd yr hafaliadau geiriol a symbol ar gyfer adwaith rhwng potasiwm â dŵr? Potasiwm + dwr Potasiwm + dŵr Potasiwm hydrocsid + hydrogen 2 K(s) + 2 H 2 O(h) 2 KOH(d) + H 2(n) 40

Brainiac Yn syth o’r rhyngrwyd http: //video. google. com/videoplay? docid=-2134266654801392897&q=brainiac+alkali+metals Os oes gennych Google Player 41

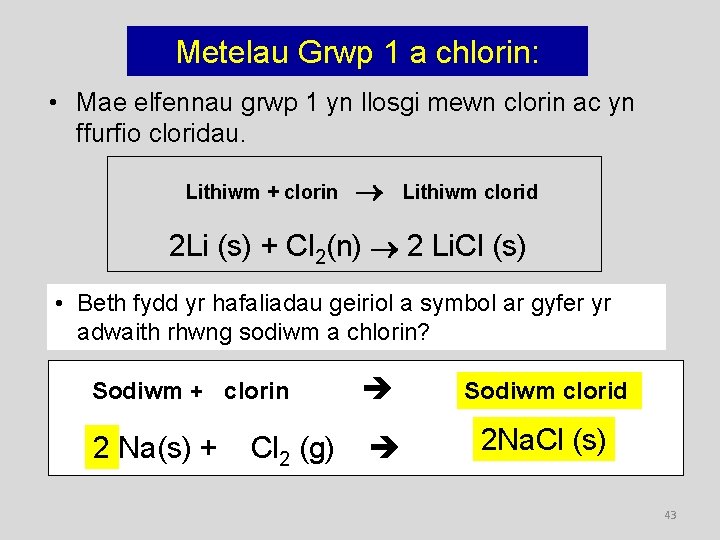
Gweithgaredd Metelau Grŵp 1 ac ocsigen: • Mae elfennau grŵp 1 yn llosgi mewn aer ac yn ffurfio ocsidau. Peidiwch a’u diffodd gyda dŵr! Lithiwm + ocsigen Lithiwm ocsid 4 Li (s) + O 2(n) 2 Li 2 O (s) • Beth fydd yr hafaliadau geiriol a symbol ar gyfer yr adwaith rhwng sodiwm ag aer? sodiwm + ocsigen 4 Na(s) + O 2 (n) sodiwm ocsid 2 Na 2 O (s) 42

Metelau Grwp 1 a chlorin: • Mae elfennau grwp 1 yn llosgi mewn clorin ac yn ffurfio cloridau. Lithiwm + clorin Lithiwm clorid 2 Li (s) + Cl 2(n) 2 Li. Cl (s) • Beth fydd yr hafaliadau geiriol a symbol ar gyfer yr adwaith rhwng sodiwm a chlorin? Sodiwm + clorin Sodiwm clorid 2 Na(s) + 2 Na. Cl (s) Cl 2 (g) 43

Y defnydd o Fetelau Grŵp 1 • Nid oes llawer o ddefnydd i’r metelau eu hunan ond mae anwedd sodiwm mewn lampau stryd yn cynhyrchu golau melyn. • Defnyddir metel lithiwm i gryfhau aloiau gwneud awyrennau a hefyd mewn batrïau trydanol. • Mae cyfansoddion cyffredin sodiwm yn cynnwys “halen” (sodiwm clorid), “bicarbonad” (sodiwm hydrogen carbonad), soda golchi (sodiwm carbonad) a soda costig (sodiwm hydrocsid). • Defnyddir cyfansoddion potasiwm mewn “gwrteithiau NPK”, chwynladdwyr, ffrwydron a llawer o gemegau eraill. Golau sodiwm potasiwm 44

Faint o electronau sydd yn orbit allanol y metelau alcali? A. B. C. D. 1 2 4 7 45

Beth yw’r gwefr ar ionau mae’r metelau alcali yn ffurfio? A. 4 B. 3 C. 2 D. 1 46

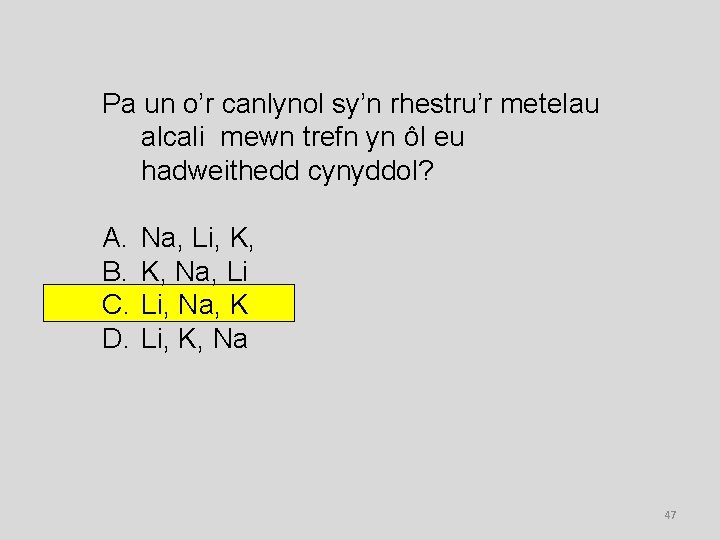
Pa un o’r canlynol sy’n rhestru’r metelau alcali mewn trefn yn ôl eu hadweithedd cynyddol? A. B. C. D. Na, Li, K, K, Na, Li Li, Na, K Li, K, Na 47

Pan mae’r metelau alcali yn adweithio gyda dŵr y cynhyrchion yw: A. B. C. D. Hydrogen + ocsid metel Ocsigen + ocsid metel Hydrogen + hydrocsid metel Ocsigen + hydrocsid metel 48

Amcangyfrifwch ymdoddbwynt Ffranciwm. A. -10 o. C B. 0 o. C C. 25 o. C D. 38 o. C 49

Anfetelau Halogenau grŵp 7 50

Dyma wybodaeth am anfetelau Grŵp 7 Elfen Ymdoddbwynt Berwbwynt Adweithedd fflworin -220 ºC -188 ºC Adweithio’n ffyrnig clorin -101 ºC -35 ºC Hynod adweithiol bromin -7 ºC 58 ºC Adweithiol iodin 114 ºC 184 ºC Adweithedd canolig astatin 302 ºC 337 ºC Gweddol adweithiol Mae dim hollol i’r gwrthwyneb i fetelau Maepob anweddau (vapours) elfennau Grŵp 7 yn: Opposite to metals LLIWGAR ac yn WENWYNIG 51

Yr Halogenau a’r Tabl Cyfnodol • Dyma’r Halogenau neu Elfennau Grŵp 7 H Li Be Na Mg K Ca Sc Rb Sr Y Cs Ba La Fr Ra Ac Ti Zr Hf Rf B C N O F Al Si P S Cl V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Db Sg Bh Hs Mt ? ? ? He Ne Ar Kr Xe Rn 52

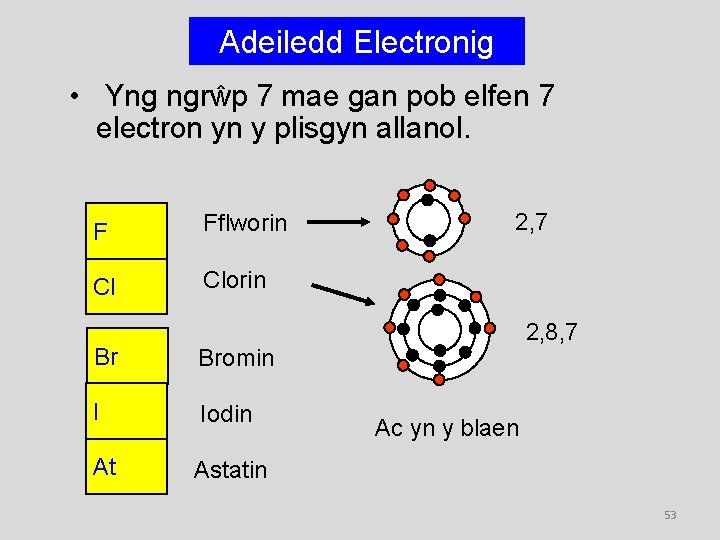
Adeiledd Electronig • Yng ngrŵp 7 mae gan pob elfen 7 electron yn y plisgyn allanol. F Fflworin Cl Clorin 2, 7 2, 8, 7 Br Bromin I Iodin At Astatin Ac yn y blaen 53

Gweithgaredd Patrymau: lliw • Mae lliw elfennau grŵp 7 yn tywyllu wrth fynd lawr y grŵp. Tywyllu F Cl Br I Hydoddiant Bromin Sylwch ar yr anwedd bromin uwchben yr hylif Pa liw y byddech yn disgwyl Astatin i fod 54

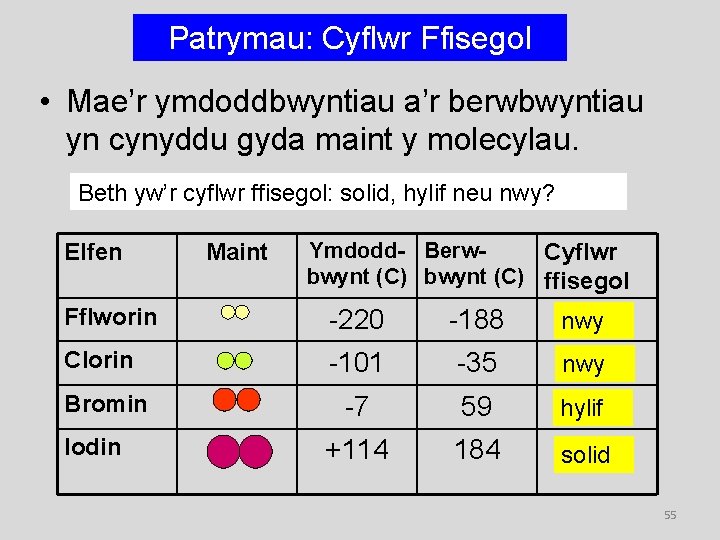
Patrymau: Cyflwr Ffisegol • Mae’r ymdoddbwyntiau a’r berwbwyntiau yn cynyddu gyda maint y molecylau. Beth yw’r cyflwr ffisegol: solid, hylif neu nwy? Elfen Maint Ymdodd- Berw. Cyflwr bwynt (C) ffisegol Fflworin -220 -188 nwy Clorin -101 -35 nwy -7 59 hylif +114 184 solid Bromin Iodin 55

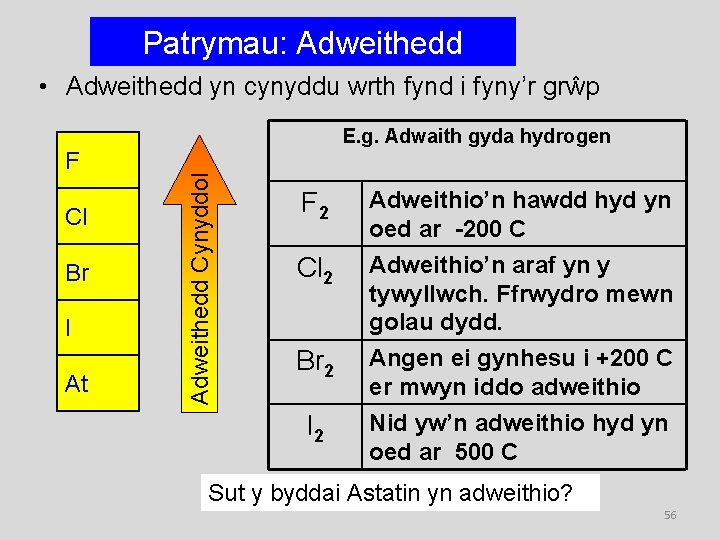
Patrymau: Adweithedd • Adweithedd yn cynyddu wrth fynd i fyny’r grŵp F Cl Br I At Adweithedd Cynyddol E. g. Adwaith gyda hydrogen F 2 Adweithio’n hawdd hyd yn oed ar -200 C Cl 2 Adweithio’n araf yn y tywyllwch. Ffrwydro mewn golau dydd. Angen ei gynhesu i +200 C er mwyn iddo adweithio Br 2 I 2 Nid yw’n adweithio hyd yn oed ar 500 C Sut y byddai Astatin yn adweithio? 56

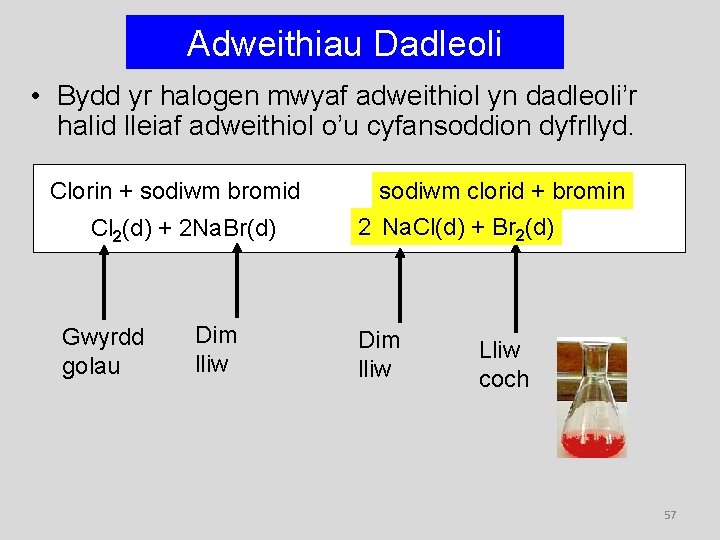
Adweithiau Dadleoli • Bydd yr halogen mwyaf adweithiol yn dadleoli’r halid lleiaf adweithiol o’u cyfansoddion dyfrllyd. Clorin + sodiwm bromid Cl 2(d) + 2 Na. Br(d) Gwyrdd golau Dim lliw sodiwm clorid + bromin 2 Na. Cl(d) + Br 2(d) Dim lliw Lliw coch 57

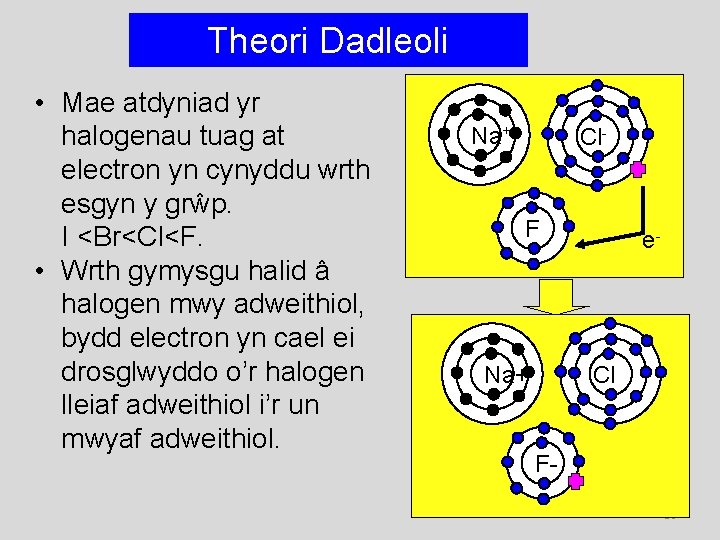
Theori Dadleoli • Mae atdyniad yr halogenau tuag at electron yn cynyddu wrth esgyn y grŵp. I <Br<Cl<F. • Wrth gymysgu halid â halogen mwy adweithiol, bydd electron yn cael ei drosglwyddo o’r halogen lleiaf adweithiol i’r un mwyaf adweithiol. Na+ Cl- F Na+ e- Cl F 58

Adweithiau gyda Metelau • Mae hoffter yr halogenau am electron ychwanegol yn golygu eu bod yn adweithio’n rhwydd gyda’r rhan fwyaf o fetelau • E. e. Mae clorin yn adweithio’n rhwydd gyda haearn er fod ganddo adweithedd isel. Clorin + haearn (III) clorid 3 Cl 2(n) + 2 Fe(s) 2 Fe. Cl 3 59

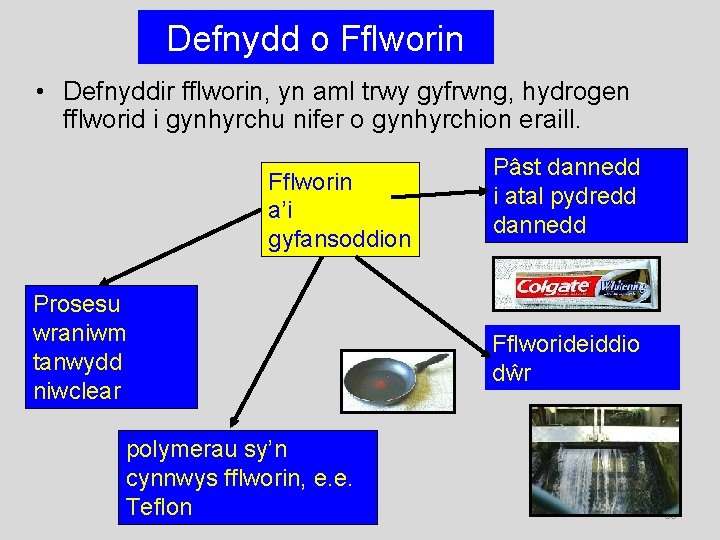
Defnydd o Fflworin • Defnyddir fflworin, yn aml trwy gyfrwng, hydrogen fflworid i gynhyrchu nifer o gynhyrchion eraill. Fflworin a’i gyfansoddion Prosesu wraniwm tanwydd niwclear polymerau sy’n cynnwys fflworin, e. e. Teflon Pâst dannedd i atal pydredd dannedd Fflworideiddio dŵr 60

Ychwanegu fflworid i gyflenwad dŵr yfed Mae rhai pobl yn meddwl bod ychwanegu sodiwm fflworid i gyflenwad dŵr yfed yn beth da gan fod y fflworid (F-) yn cryfhau dannedd plant ac yn atal pydredd (tooth decay). Mae eraill yn meddwl bod hi’n peth drwg gorfodi pawb i yfed dŵr gyda fflworid ynddo gan ei fod yn sylwedd wenwynig ar grynodiad uchel ac yn medru achosi cancr. 61

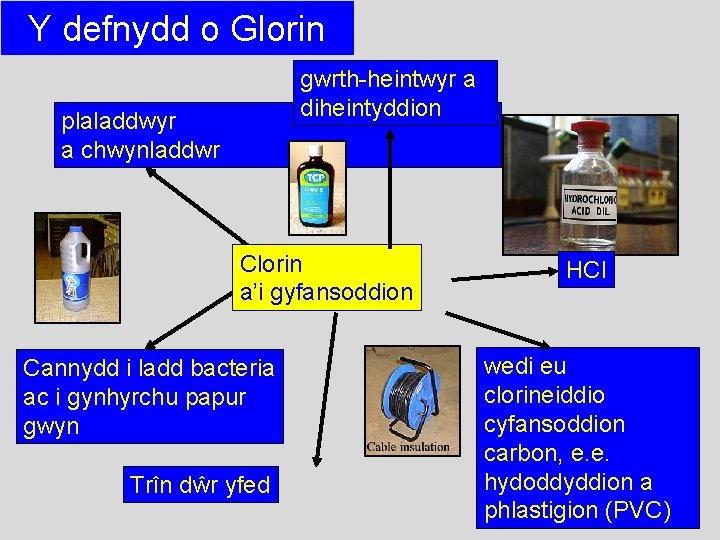
Y defnydd o Glorin gwrth-heintwyr a diheintyddion plaladdwyr a chwynladdwr Clorin a’i gyfansoddion Cannydd i ladd bacteria ac i gynhyrchu papur gwyn Trîn dŵr yfed HCl wedi eu clorineiddio cyfansoddion carbon, e. e. hydoddyddion a phlastigion (PVC)62

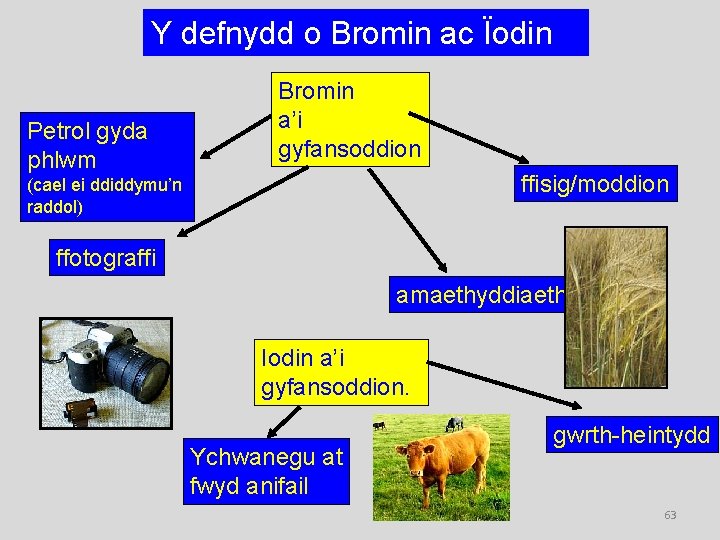
Y defnydd o Bromin ac Ïodin Petrol gyda phlwm Bromin a’i gyfansoddion ffisig/moddion (cael ei ddiddymu’n raddol) ffotograffi amaethyddiaeth Iodin a’i gyfansoddion. Ychwanegu at fwyd anifail gwrth-heintydd 63

Activity Y defnydd o’r Halogenau • Cysylltwch yr halogen â’i ddefnydd F I Cl Br 64

Na K Rb Cs Fr F Cl Br I As 65

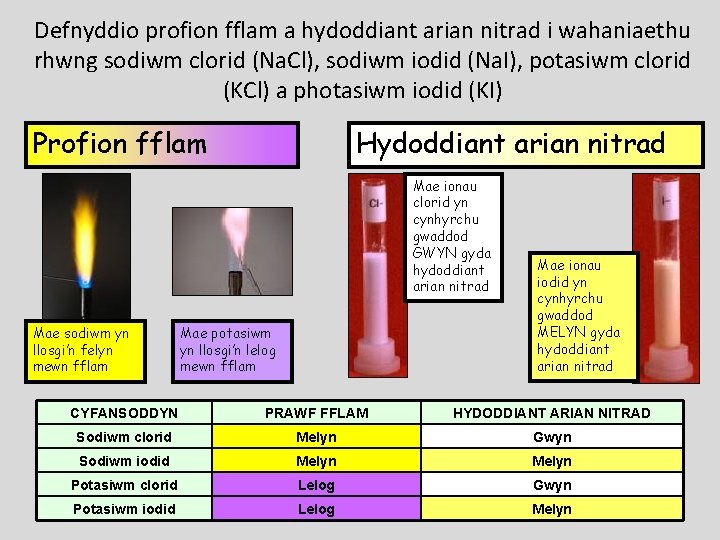
Defnyddio profion fflam a hydoddiant arian nitrad i wahaniaethu rhwng sodiwm clorid (Na. Cl), sodiwm iodid (Na. I), potasiwm clorid (KCl) a photasiwm iodid (KI) Profion fflam Hydoddiant arian nitrad Mae ionau clorid yn cynhyrchu gwaddod GWYN gyda hydoddiant arian nitrad Mae sodiwm yn llosgi’n felyn mewn fflam Mae potasiwm yn llosgi’n lelog mewn fflam Mae ionau iodid yn cynhyrchu gwaddod MELYN gyda hydoddiant arian nitrad CYFANSODDYN PRAWF FFLAM HYDODDIANT ARIAN NITRAD Sodiwm clorid Melyn Gwyn Sodiwm iodid Melyn Potasiwm clorid Lelog Gwyn Potasiwm iodid Lelog Melyn 66

Activity A draws: 1 Ei ddefnyddio mewn pwll nofio 4 Nifer o electronau allanol yr halogenau 5 Cael ei ychwanegu at fwyd anifeiliaid 6 Y math o gyfansoddion a ffurfir gydag anfetelau 8 Y math o gyfansoddion a ffurfir gyda metelau I lawr: 1 Mae’r adweithedd yn gwneud hyn wrth esgyn grŵp 7 2 Yr enw am elfennau grŵp 7 3 Ei ddefnyddio mewn ffotograffi 7 Yr halogen mwyaf adweithiol 67

Faint o electronau sydd gan yr halogenau yn y plisgyn allanol? A. B. C. D. 1 5 7 8 68

Mewn moleciwl halogen, faint o atomau sydd ynddo? A. 1 B. 2 C. 5 D. 7 69

Beth yw’r drefn adweithedd cynyddol yr halogenau? A. B. C. D. F, Cl, I, Br F, Cl, Br, I I, Cl, Br, F I, Br, Cl, F 70

Pa un o’r parau yma fydd ddim yn arwain at adwaith disodli? A. B. C. D. ïodin + sodiwm clorid fflworin + sodiwm clorid Clorin + sodiwm iodid Bromin + sodiwm iodid 71

Pa halogen a ddefnyddir i wneud padell nad yw’n glynu? A. B. C. D. F Cl Br I 72

Pa halogen a ddefnyddir fel antiseptig? A. B. C. D. F Cl Br I 73

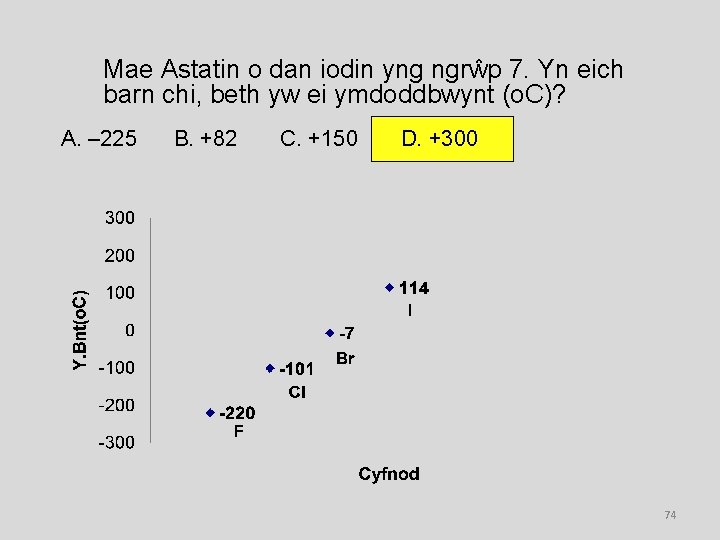
Mae Astatin o dan iodin yng ngrŵp 7. Yn eich barn chi, beth yw ei ymdoddbwynt (o. C)? A. – 225 B. +82 C. +150 D. +300 74

2. 3 Bondio, adeiledd a phriodweddau cemegol 75

BONDIO IONIG 76

BONDIO IONIG Mae’r mwyafrif o gyfansoddion ionig yn cynnwys metel ac anfetel. Pan fydd metelau’n adweithio collant electronau plisg allanol gan adael plisgyn electronig llawn. Cynhyrcha hyn atom wedi ei wefru (ion) a gwefr + arno. Colli 1 neu fwy o electronau Atom niwtral n+ Ion positif Pan fydd anfetelau’n adweithio gyda metel byddant yn ennill electronau i gyrraedd plisgyn electronig llawn. Ennill 1 neu fwy o electronau Atom niwtral n- Ion negatif 77

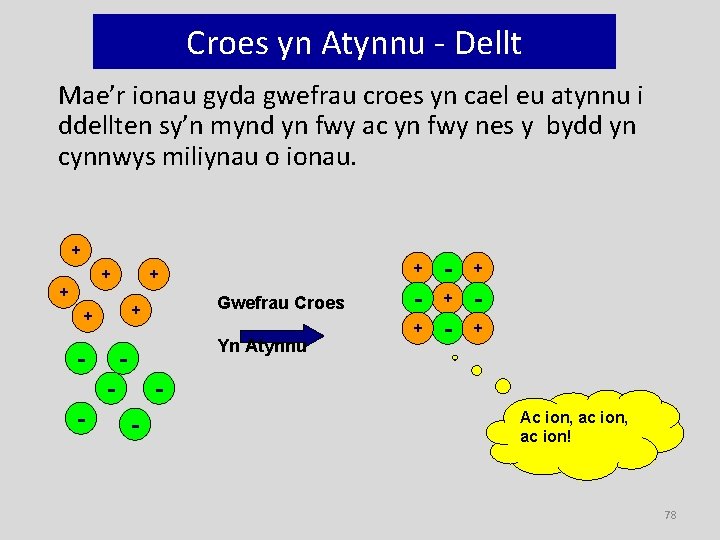
Croes yn Atynnu - Dellt Mae’r ionau gyda gwefrau croes yn cael eu atynnu i ddellten sy’n mynd yn fwy ac yn fwy nes y bydd yn cynnwys miliynau o ionau. + + + - Yn Atynnu - - Gwefrau Croes + + - + - + - Ac ion, ac ion! 78

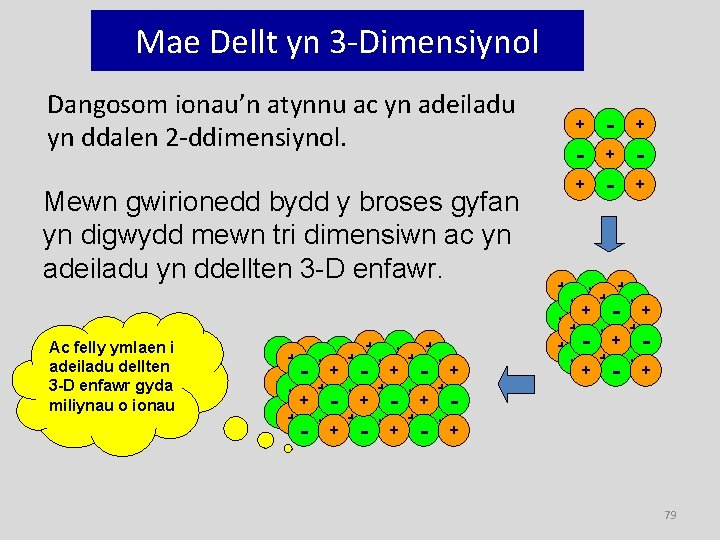
Mae Dellt yn 3 -Dimensiynol Dangosom ionau’n atynnu ac yn adeiladu yn ddalen 2 -ddimensiynol. Mewn gwirionedd bydd y broses gyfan yn digwydd mewn tri dimensiwn ac yn adeiladu yn ddellten 3 -D enfawr. Ac felly ymlaen i adeiladu dellten 3 -D enfawr gyda miliynau o ionau - + +- + - + + -+ -+ - + +- - + +- + - + + - +- + - + +- - + + -- ++ - + +- - + + 79

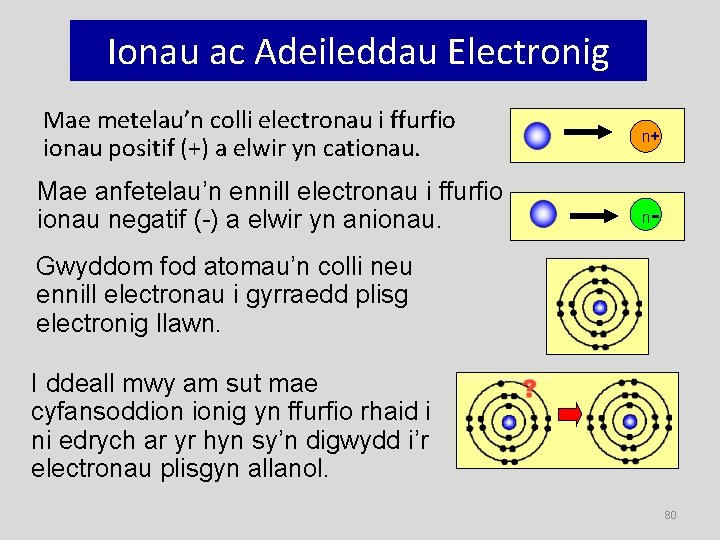
Ionau ac Adeileddau Electronig Mae metelau’n colli electronau i ffurfio ionau positif (+) a elwir yn cationau. Mae anfetelau’n ennill electronau i ffurfio ionau negatif (-) a elwir yn anionau. n+ n- Gwyddom fod atomau’n colli neu ennill electronau i gyrraedd plisg electronig llawn. I ddeall mwy am sut mae cyfansoddion ionig yn ffurfio rhaid i ni edrych ar yr hyn sy’n digwydd i’r electronau plisgyn allanol. 80

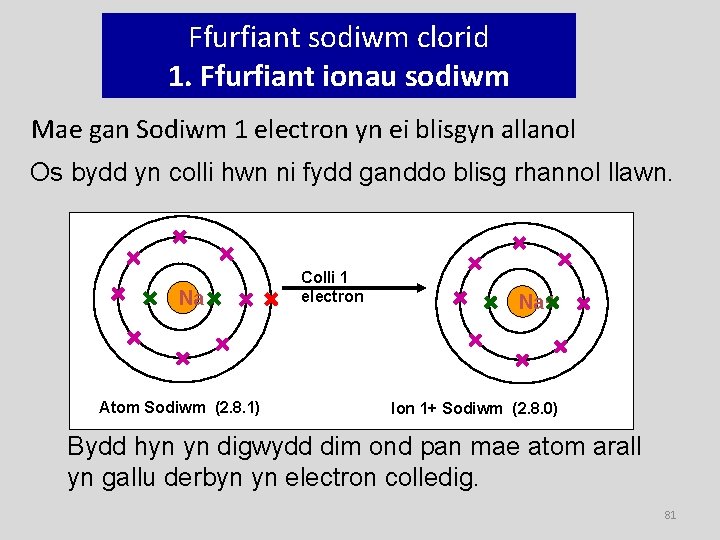
Ffurfiant sodiwm clorid 1. Ffurfiant ionau sodiwm Mae gan Sodiwm 1 electron yn ei blisgyn allanol Os bydd yn colli hwn ni fydd ganddo blisg rhannol llawn. Na Atom Sodiwm (2. 8. 1) Colli 1 electron Na+ Ion 1+ Sodiwm (2. 8. 0) Bydd hyn yn digwydd dim ond pan mae atom arall yn gallu derbyn yn electron colledig. 81

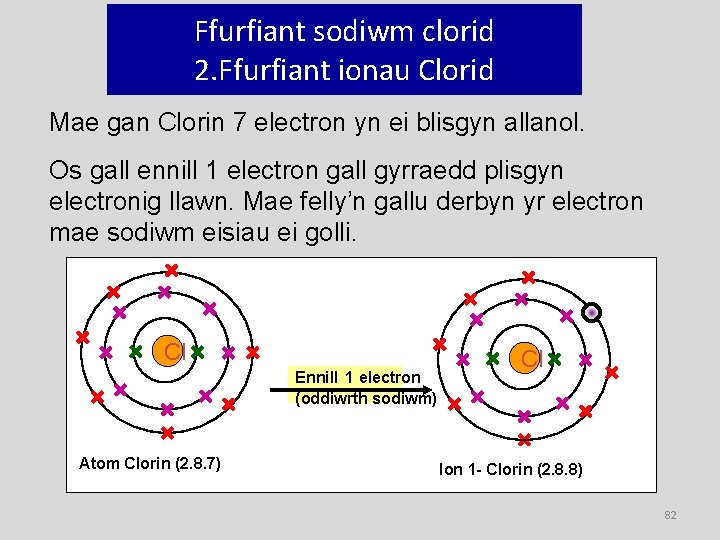
Ffurfiant sodiwm clorid 2. Ffurfiant ionau Clorid Mae gan Clorin 7 electron yn ei blisgyn allanol. Os gall ennill 1 electron gall gyrraedd plisgyn electronig llawn. Mae felly’n gallu derbyn yr electron mae sodiwm eisiau ei golli. Cl Ennill 1 electron (oddiwrth sodiwm) Atom Clorin (2. 8. 7) Cl Ion 1 - Clorin (2. 8. 8) 82

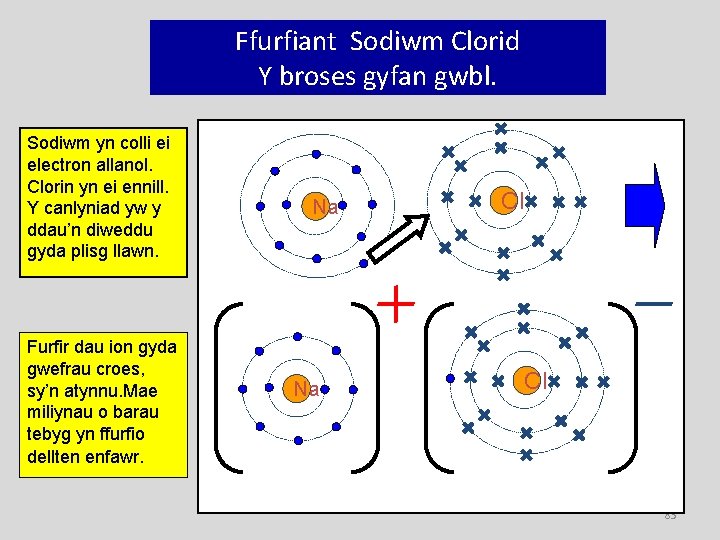
Ffurfiant Sodiwm Clorid Y broses gyfan gwbl. Sodiwm yn colli ei electron allanol. Clorin yn ei ennill. Y canlyniad yw y ddau’n diweddu gyda plisg llawn. Furfir dau ion gyda gwefrau croes, sy’n atynnu. Mae miliynau o barau tebyg yn ffurfio dellten enfawr. Na Na Cl Cl 83

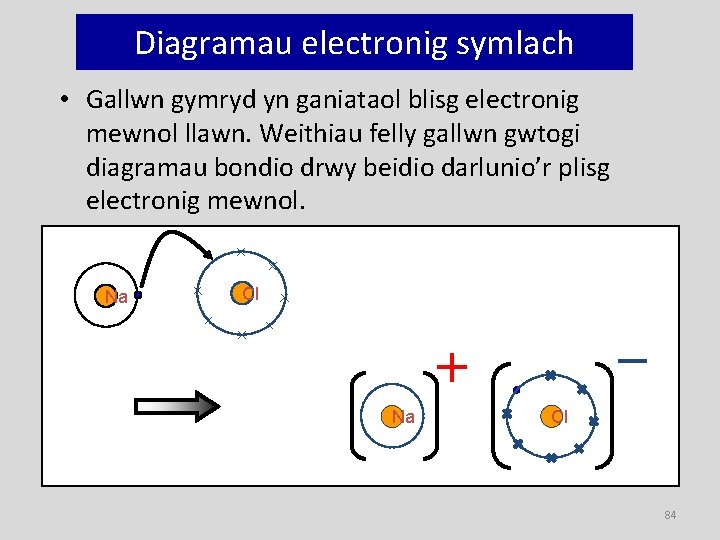
Diagramau electronig symlach • Gallwn gymryd yn ganiataol blisg electronig mewnol llawn. Weithiau felly gallwn gwtogi diagramau bondio drwy beidio darlunio’r plisg electronig mewnol. Na Cl 84

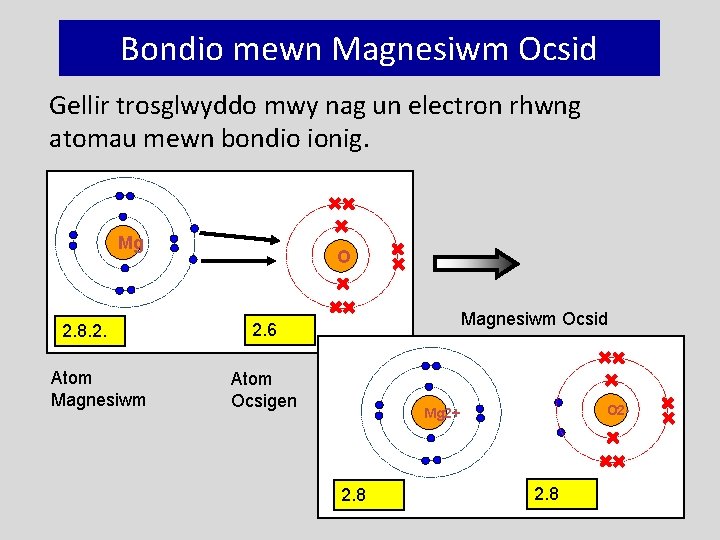
Bondio mewn Magnesiwm Ocsid Gellir trosglwyddo mwy nag un electron rhwng atomau mewn bondio ionig. Mg 2. 8. 2. Atom Magnesiwm Ocsid 2. 6 Atom Ocsigen O 2 - Mg 2+ 2. 8 85

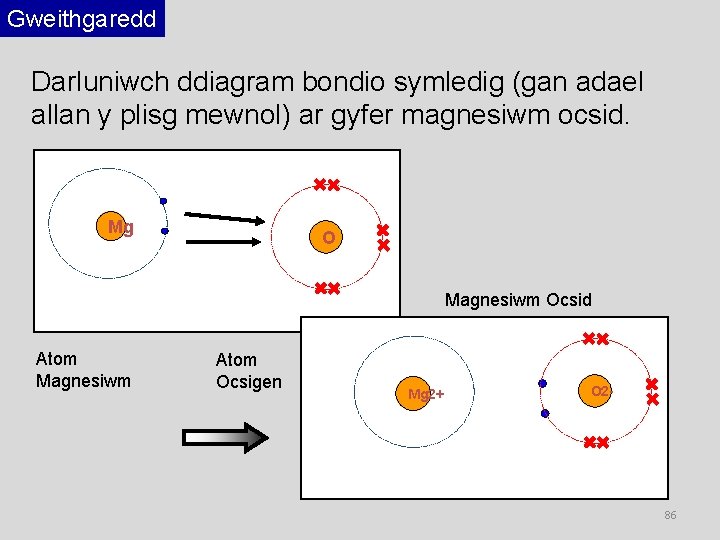
Gweithgaredd Darluniwch ddiagram bondio symledig (gan adael allan y plisg mewnol) ar gyfer magnesiwm ocsid. Mg O Magnesiwm Ocsid Atom Magnesiwm Atom Ocsigen Mg 2+ O 2 - 86

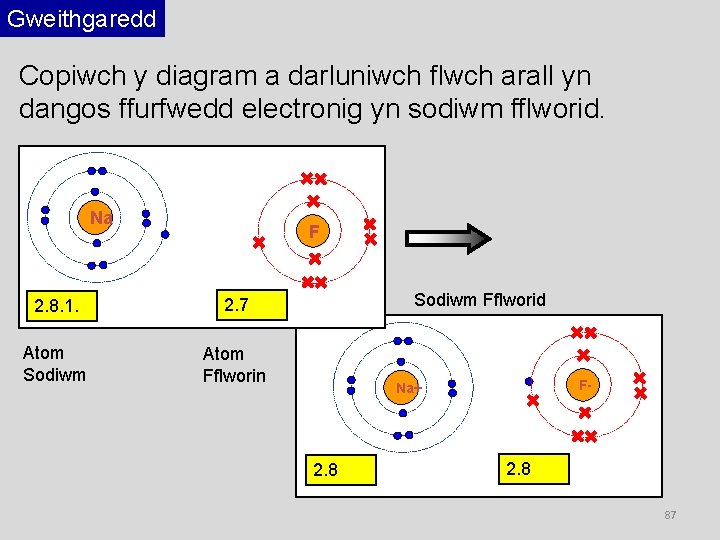
Gweithgaredd Copiwch y diagram a darluniwch flwch arall yn dangos ffurfwedd electronig yn sodiwm fflworid. Na F 2. 8. 1. 2. 7 Atom Sodiwm Atom Fflworin Sodiwm Fflworid F- Na+ 2. 8 87

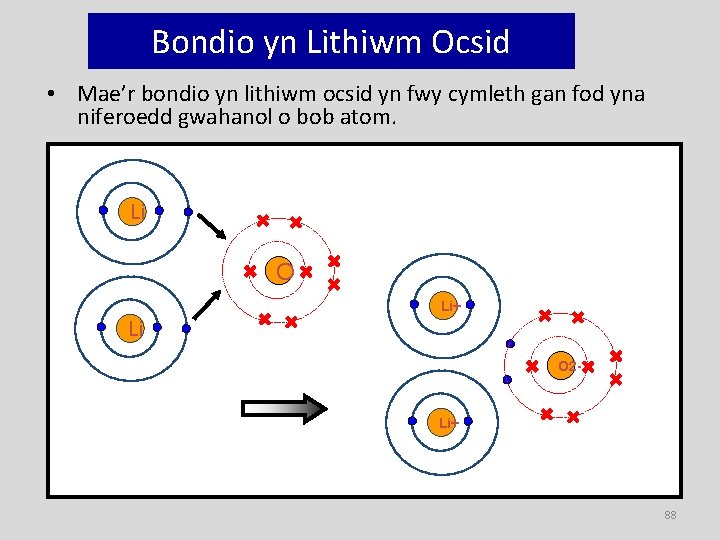
Bondio yn Lithiwm Ocsid • Mae’r bondio yn lithiwm ocsid yn fwy cymleth gan fod yna niferoedd gwahanol o bob atom. Li O Li+ Li O 2 - Li+ 88

Gwefrau ar ionau • Pan fydd atomau’n ffurfio ionau y nôd yw cyrraedd plisg electronig sydd unai’n hollol lawn neu’n hollol wag. • Os gwyddom ffurfwedd electronig atom gallwn fel rheol weithio allan faint o electronau mae’n rhaid colli neu ennill i gyrraedd ffurfwedd nwy nobl. • Dywed hyn wrthym beth yw’r wefr ar ei ion. 89

Gwefrau ac ionau metelig • Fel rheol bydd metelau’n colli electronau i wacau’r plisgyn allanol hwn. • Mae nifer yr electronau yn y plisgyn allanol fel rheol yn gyfartal i’r rhif grwp yn y Tabl Cyfnodol. e. e. Li Mg Al 2. 1 Li+ 2. 8. 2 Mg 2+ 2. 8. 3 Al 3+ 90

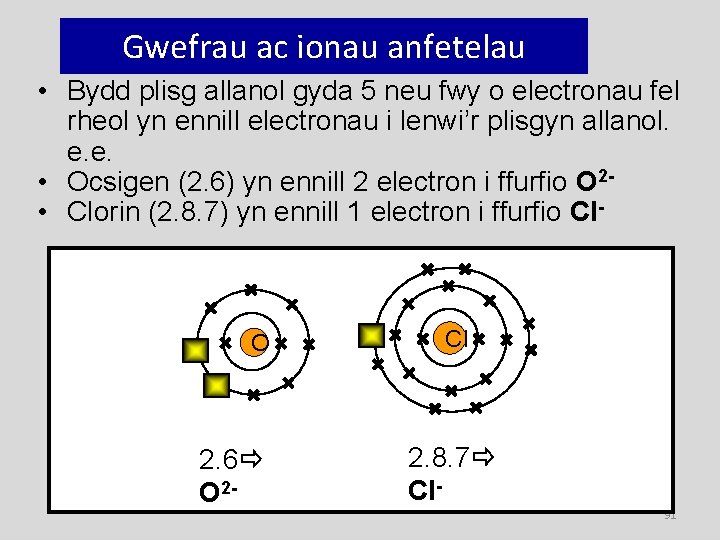
Gwefrau ac ionau anfetelau • Bydd plisg allanol gyda 5 neu fwy o electronau fel rheol yn ennill electronau i lenwi’r plisgyn allanol. e. e. • Ocsigen (2. 6) yn ennill 2 electron i ffurfio O 2 • Clorin (2. 8. 7) yn ennill 1 electron i ffurfio Cl- O 2. 6 O 2 - Cl 2. 8. 7 Cl 91

Pa un o’r canlynol fydd gyda bondio ionig? A. Copr clorid B. Haearn C. Pres D. Sylffwr deuocsid 92

Pa un o’r canlynol NAD yw’n wir am fondio ionig? A. B. C. D. Mae gan ionau metel wefr + Mae gan ionau anfetel wefr Maent yn ffurfio dellten 2 ddimensiynol Mae ganddynt adeileddau enfawr. 93

Pa un o’r canlynol sy’n wir am ion ocsid? A. B. C. D. Ffurfir wrth i atomau ocsigen golli 2 electron. Mae gan ionau ocsigen ail blisgyn gwag. Bodoli mewn parau Mae ganddo wefr 28 O 16 94

Pa un o’r canlynol sy’n wir am ion sodiwm? A. B. C. D. Mae ganddo drefniant electronig 2, 8, 1. Ffurfir wrth i atomau sodiwm ennill 1 electron. Mae gan ionau sodiwm ail blisgyn gwag. Mae ganddo wefr 1+. 11 Na 23 95

BONDIO COFALENT 96

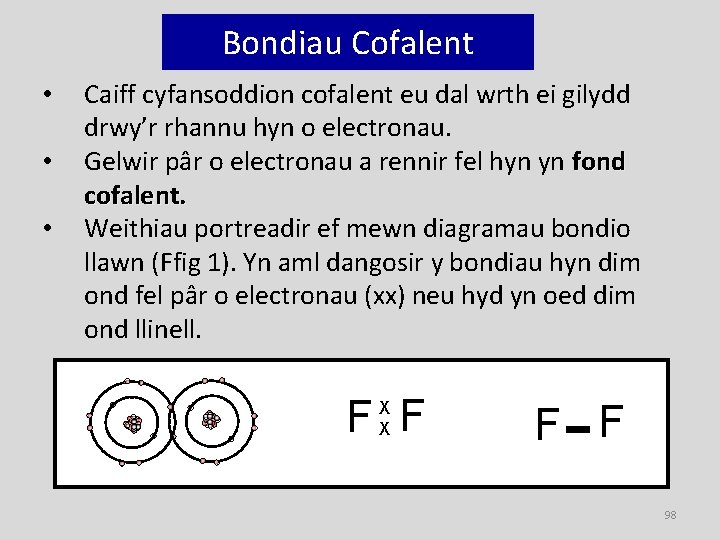
Cyfansoddion Cofalent • • • Ffurfir cyfansoddion cofalent pan fydd atomau anfetelau’n adweithio gyda’i gilydd. Fel fydd yr atomau hyn yn agosau atynnir eu electronau allanol gan niwclews y ddau atom a cânt eu rhannu gan yr atomau. Mae’r electronau a rennir yn cyfrif tuag at blisg y ddau atom ac felly’n helpu i lenwi plisg electronig anghyflawn. 97

Bondiau Cofalent • • • Caiff cyfansoddion cofalent eu dal wrth ei gilydd drwy’r rhannu hyn o electronau. Gelwir pâr o electronau a rennir fel hyn yn fond cofalent. Weithiau portreadir ef mewn diagramau bondio llawn (Ffig 1). Yn aml dangosir y bondiau hyn dim ond fel pâr o electronau (xx) neu hyd yn oed dim ond llinell. F F X X - F F 98

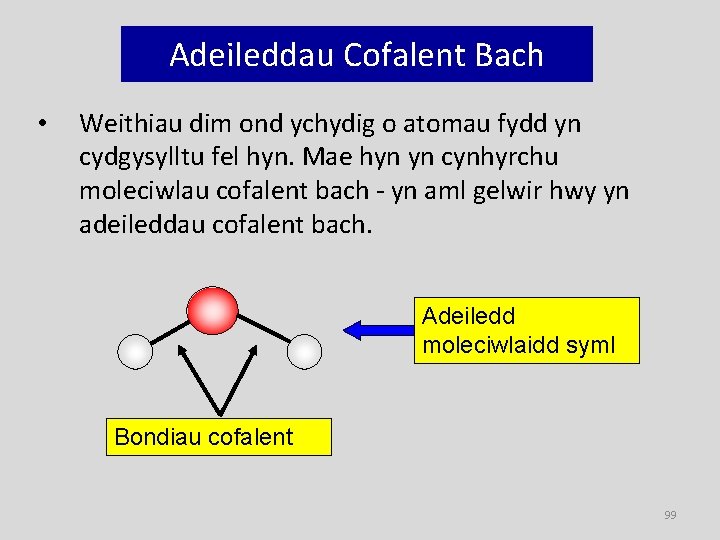
Adeileddau Cofalent Bach • Weithiau dim ond ychydig o atomau fydd yn cydgysylltu fel hyn. Mae hyn yn cynhyrchu moleciwlau cofalent bach - yn aml gelwir hwy yn adeileddau cofalent bach. Adeiledd moleciwlaidd syml Bondiau cofalent 99

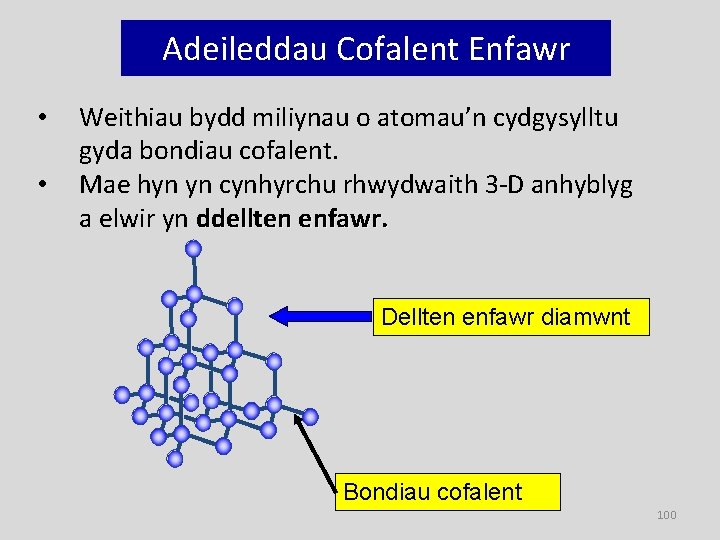
Adeileddau Cofalent Enfawr • • Weithiau bydd miliynau o atomau’n cydgysylltu gyda bondiau cofalent. Mae hyn yn cynhyrchu rhwydwaith 3 -D anhyblyg a elwir yn ddellten enfawr. Dellten enfawr diamwnt Bondiau cofalent 100

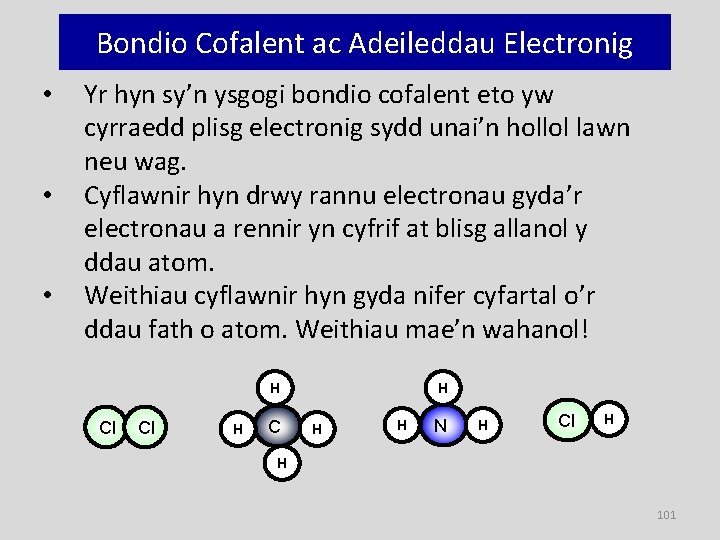
Bondio Cofalent ac Adeileddau Electronig • • • Yr hyn sy’n ysgogi bondio cofalent eto yw cyrraedd plisg electronig sydd unai’n hollol lawn neu wag. Cyflawnir hyn drwy rannu electronau gyda’r electronau a rennir yn cyfrif at blisg allanol y ddau atom. Weithiau cyflawnir hyn gyda nifer cyfartal o’r ddau fath o atom. Weithiau mae’n wahanol! H Cl Cl H C H H H N H Cl H H 101

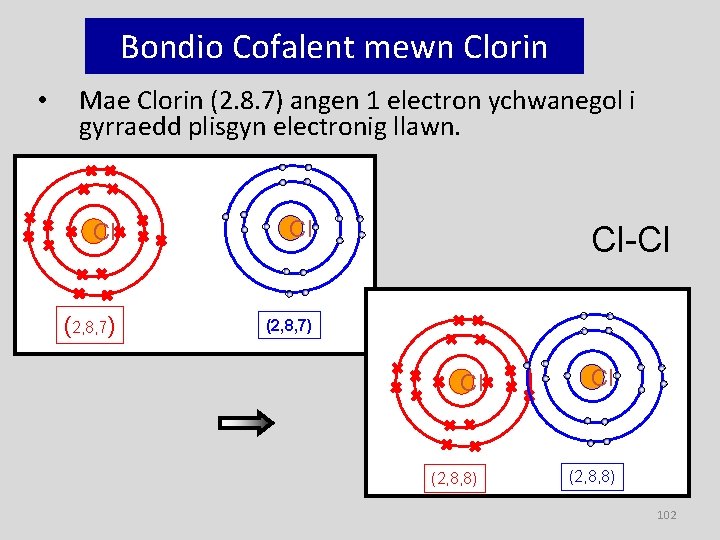
Bondio Cofalent mewn Clorin • Mae Clorin (2. 8. 7) angen 1 electron ychwanegol i gyrraedd plisgyn electronig llawn. Cl Cl (2, 8, 7) Cl-Cl Cl (2, 8, 8) 102

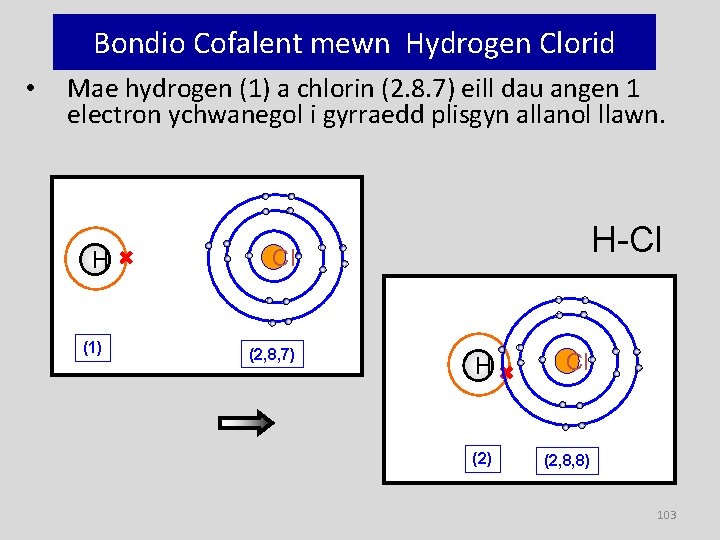
Bondio Cofalent mewn Hydrogen Clorid • Mae hydrogen (1) a chlorin (2. 8. 7) eill dau angen 1 electron ychwanegol i gyrraedd plisgyn allanol llawn. H (1) H-Cl Cl (2, 8, 7) H Cl (2) (2, 8, 8) 103

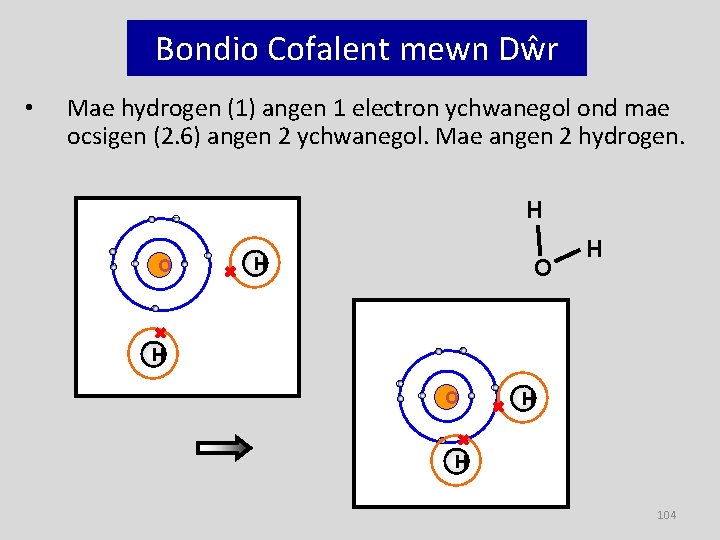
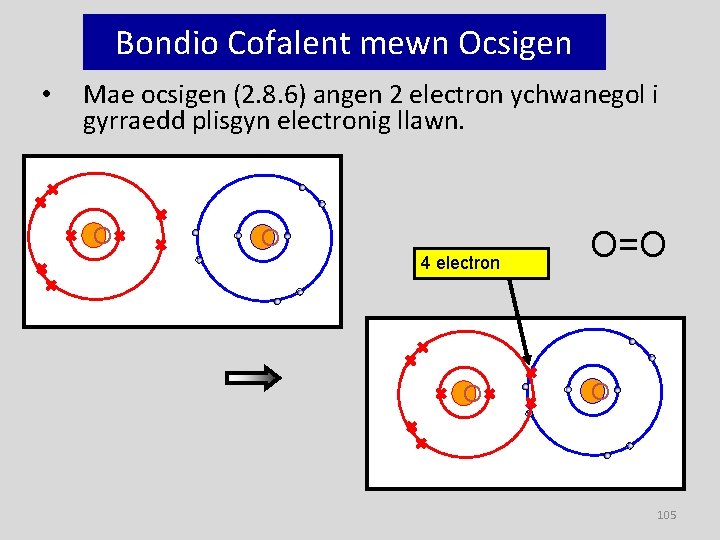
Bondio Cofalent mewn Dŵr • Mae hydrogen (1) angen 1 electron ychwanegol ond mae ocsigen (2. 6) angen 2 ychwanegol. Mae angen 2 hydrogen. H O H H 104

Bondio Cofalent mewn Ocsigen • Mae ocsigen (2. 8. 6) angen 2 electron ychwanegol i gyrraedd plisgyn electronig llawn. O O 4 electron O O=O O 105

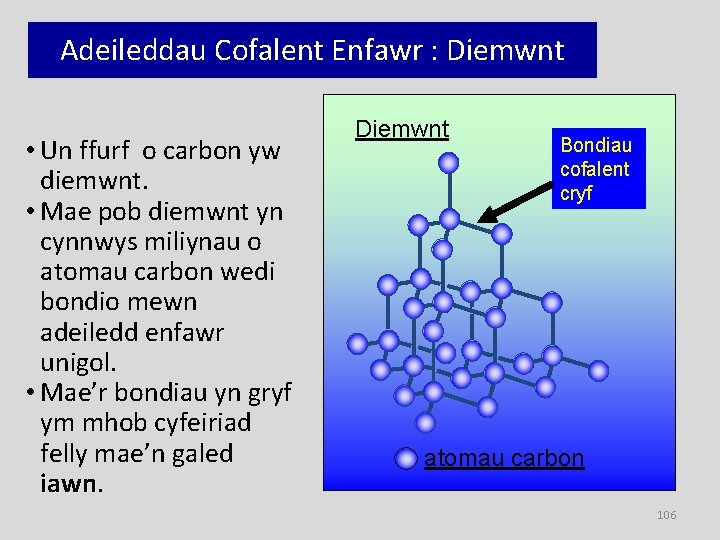
Adeileddau Cofalent Enfawr : Diemwnt • Un ffurf o carbon yw diemwnt. • Mae pob diemwnt yn cynnwys miliynau o atomau carbon wedi bondio mewn adeiledd enfawr unigol. • Mae’r bondiau yn gryf ym mhob cyfeiriad felly mae’n galed iawn Diemwnt Bondiau cofalent cryf atomau carbon 106

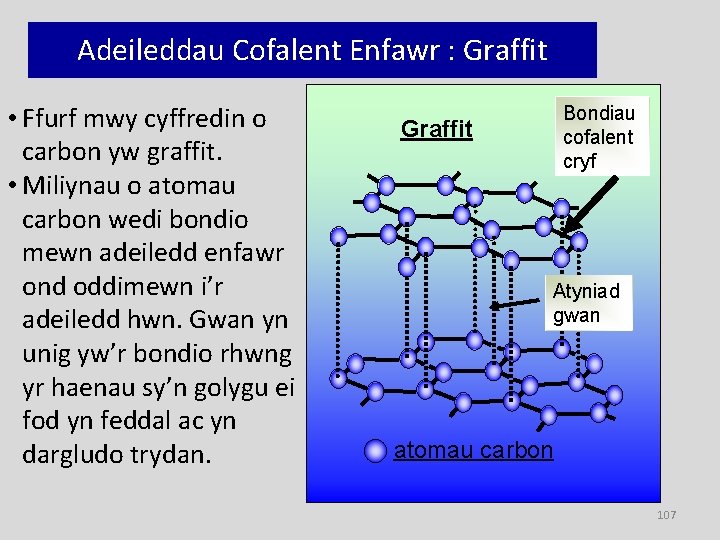
Adeileddau Cofalent Enfawr : Graffit • Ffurf mwy cyffredin o carbon yw graffit. • Miliynau o atomau carbon wedi bondio mewn adeiledd enfawr ond oddimewn i’r adeiledd hwn. Gwan yn unig yw’r bondio rhwng yr haenau sy’n golygu ei fod yn feddal ac yn dargludo trydan. Bondiau cofalent cryf Graffit Atyniad gwan atomau carbon 107

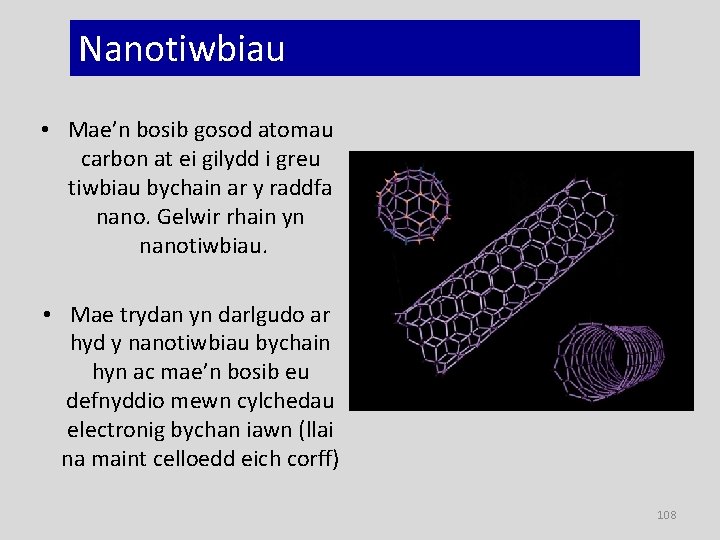
Nanotiwbiau • Mae’n bosib gosod atomau carbon at ei gilydd i greu tiwbiau bychain ar y raddfa nano. Gelwir rhain yn nanotiwbiau. • Mae trydan yn darlgudo ar hyd y nanotiwbiau bychain hyn ac mae’n bosib eu defnyddio mewn cylchedau electronig bychan iawn (llai na maint celloedd eich corff) 108

Adeiledd metel, aloi a gwydr metelig Dyma adeiledd metel arferol (fel sodiwm) sy’n dangos bod yr atomau (Na) yn cael eu gosod mewn patrwm penodol ar ffurf dellten (lattice) Dyma adeiledd aloi fel Ni. Tinol. Mae aloi yn gymysgedd o ddau wahanol elfen metelig – yn achos Ni. Tinol yr elfennau hyn yw nicel (Ni) a titaniwm (Ti). Mae’r patrwm dal yn un penodol ar ffurf dellten Mae math newydd o ddur wedi ei gynhyrchu sydd 3 gwaith cryfach na dur arferol. Nid yw’n rhydu nac yn fagnetig chwaith. Wrth adio’r atomau mawr melyn i’r aloi mae patrwm penodol y ddellten yn cael ei newid. Mae patrwm amhenodol y ddellten newydd yn debyg iawn i adeiledd gwydr ac felly mae’r metelau newydd hyn yn cael eu galw’n gwydr metelig. 109

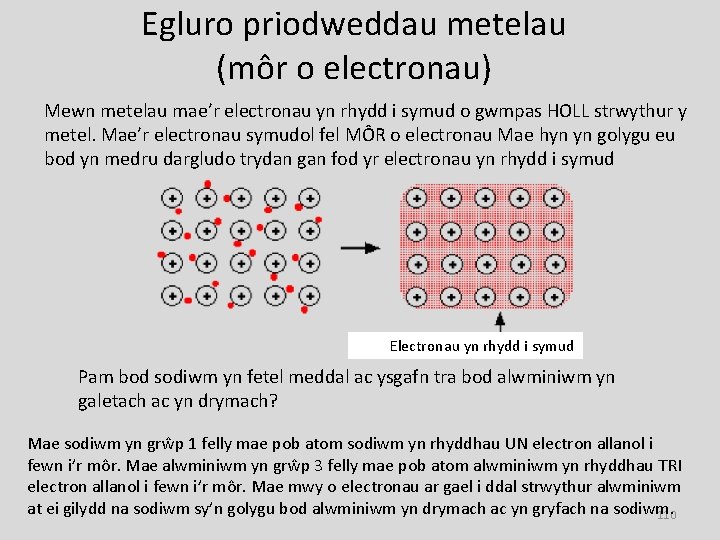
Egluro priodweddau metelau (môr o electronau) Mewn metelau mae’r electronau yn rhydd i symud o gwmpas HOLL strwythur y metel. Mae’r electronau symudol fel MÔR o electronau Mae hyn yn golygu eu bod yn medru dargludo trydan gan fod yr electronau yn rhydd i symud Electronau yn rhydd i symud Pam bod sodiwm yn fetel meddal ac ysgafn tra bod alwminiwm yn galetach ac yn drymach? Mae sodiwm yn grŵp 1 felly mae pob atom sodiwm yn rhyddhau UN electron allanol i fewn i’r môr. Mae alwminiwm yn grŵp 3 felly mae pob atom alwminiwm yn rhyddhau TRI electron allanol i fewn i’r môr. Mae mwy o electronau ar gael i ddal strwythur alwminiwm at ei gilydd na sodiwm sy’n golygu bod alwminiwm yn drymach ac yn gryfach na sodiwm. 110

BONDIO A PHRIODWEDDAU FFISEGOL 111

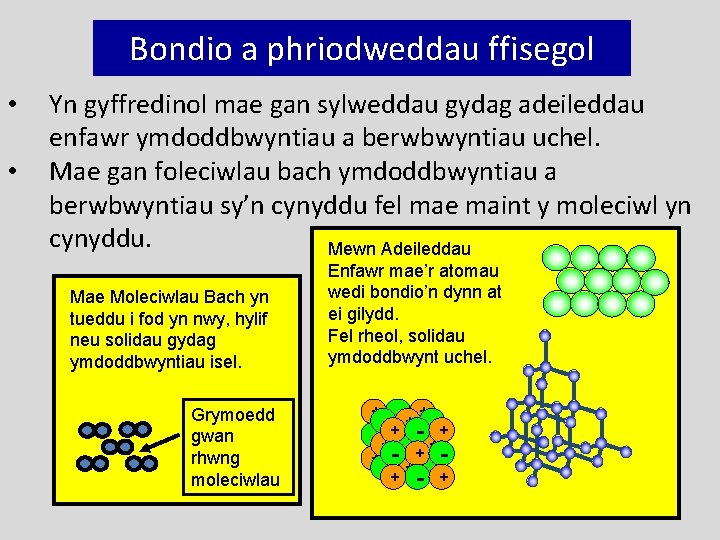
Bondio a phriodweddau ffisegol • • Mae’r math o adeiledd sydd gan sylweddau yn cael effaith anferth ar briodweddau ffisegol. Pethau fel: Dwysedd Dargludedd Hydrinedd/ breuder Ymdoddbwynt Mae’r ychydig sleidiau nesaf yn rhoi enghreifftiau o rywfaint o’r patrymau cyffredinol. 112

Bondio a phriodweddau ffisegol • • • Nid yw sylweddau ionig yn dargludo trydan pan yn solidau. Pan yn dawdd neu wedi hydoddi gallant ddargludo (a hefyd gymryd rhan mewn electrolysis). Mae hyn oherwydd fod y trydan yn cael ei gludo drwy’r toddiant gan yr ionau sy’n rhydd i allu symud (symudol). + + - + ++ - -- + + + -- ++ - + +- - + + Solid – nid yn rhydd i symud. Nid yw’n dargludo + - + - Tawdd - symudol. Yn dargludo 113

Bondio a phriodweddau ffisegol • • Yn gyffredinol mae gan sylweddau gydag adeileddau enfawr ymdoddbwyntiau a berwbwyntiau uchel. Mae gan foleciwlau bach ymdoddbwyntiau a berwbwyntiau sy’n cynyddu fel mae maint y moleciwl yn cynyddu. Mewn Adeileddau Mae Moleciwlau Bach yn tueddu i fod yn nwy, hylif neu solidau gydag ymdoddbwyntiau isel. Grymoedd gwan rhwng moleciwlau Enfawr mae’r atomau wedi bondio’n dynn at ei gilydd. Fel rheol, solidau ymdoddbwynt uchel. - +-++- - + -+ - -+ + -- ++ - + +- - + + + 114

Gweithgaredd Pa fath o adeiledd sydd gennyf? • • Yr wyf yn dargludo fel solid a hylif. metelig Yr wyf yn dargludo fel hylif ond nid fel solid. ionig Yr wyf yn nwy. Cofalent syml Yr wyf yn solid brau sy’n hydoddi mewn dŵr. ionig Yr wyf yn hydrin. metelig Nid wyf yn dargludo ond yr wyf yn anodd i ymdoddi. Cofalent Enfawr Yr wyf yn solid ond yn ymdoddi’n hawdd Cofalent syml 115

Gweithgaredd • Pa fath o fondio fydd gan y sylweddau? Sylwedd Pres (Aloi copr + sinc) Copr ocsid Sylffwr deuocsid Haearn Sodiwm fflworid Nitrogen clorid Bondio Metelig Ionig Cofalent 116

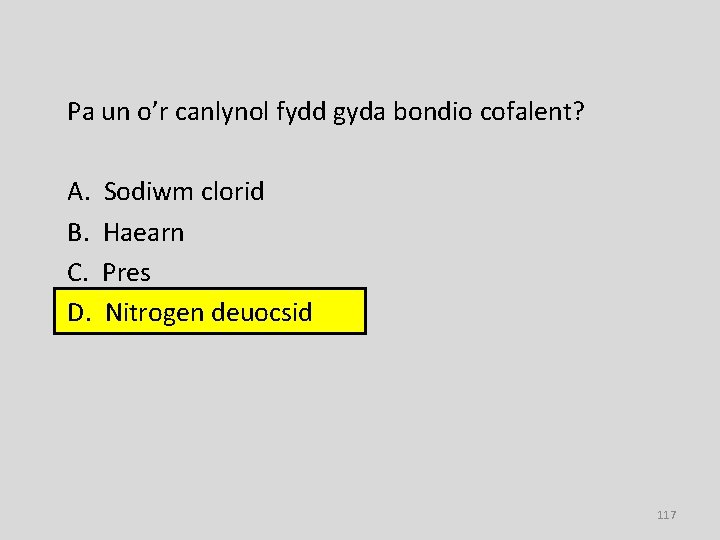
Pa un o’r canlynol fydd gyda bondio cofalent? A. B. C. D. Sodiwm clorid Haearn Pres Nitrogen deuocsid 117

Pa un sy’n ddatganiad cywir am fondiau cofalent? • • Fel rheol yn ffurfio rhwng metelau ac anfetelau. Golygu trosglwyddo electronau rhwng atomau. Ffurfio plisg electronig llawn drwy rannu electronau. Bob amser yn ymwneud â 2 electron i bob atom 118

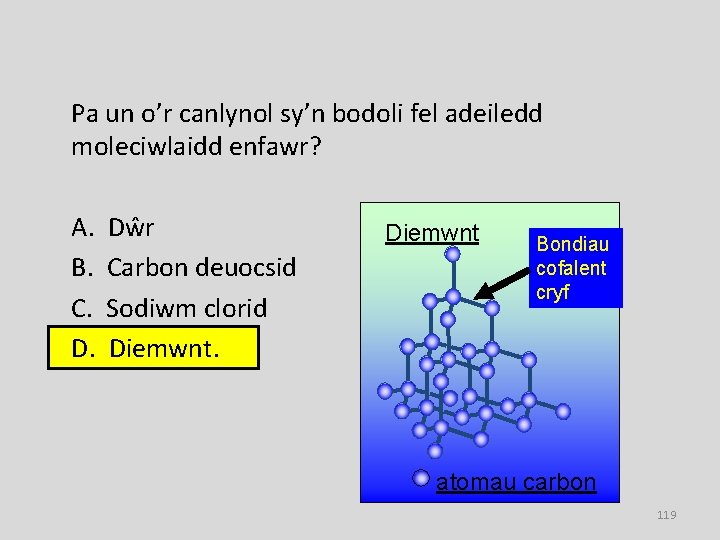
Pa un o’r canlynol sy’n bodoli fel adeiledd moleciwlaidd enfawr? A. B. C. D. Dŵr Carbon deuocsid Sodiwm clorid Diemwnt Bondiau cofalent cryf atomau carbon 119

Pa un o’r rhain fydd yn dargludo pan yn hylif ond nid pan yn solid? A. B. C. D. Moleciwlau Bach Moleciwlau Enfawr metel ionig 120

Pa un o’r rhain nad yw’n gallu dargludo o gwbl a sy’n hawdd i’w ymdoddi? A. B. C. D. Moleciwlau Bach Moleciwlau Enfawr metel ionig 121

DEFNYDDIAU CRAFF 122

defnydd craff = amrywiaeth o ddefnyddiau modern y mae eu priodweddau yn newid gyda newid yn yr amgylchoedd, megis newidiadau mewn tymheredd, golau, p. H ayb paent thermocromig, sy'n newid lliw wrth gael ei wresogi paent ffotocromig, sy'n newid lliw wrth i olau ddisgleirio arno. aloi sy'n cofio siâp, fel Ni. Ti neu nitinol, sef aloi o nicel a thitaniwm, sy'n gallu adennill ei siâp gwreiddiol wrth gael ei wresogi Stent i’w roi mewn gwythïen (vein) sy’n cadw ei siâp ar dymheredd y corff Cliciwch ar y ffilm uchod i’w weld Sbectol Ni. Ti sy’n cadw ei siâp 123

Geliau Polymer Mae gan geliau polymer, fel hydrogeliau, adeiledd polymer traws gysylltiedig (cross linked). Gydag hydoddydd, fel dŵr; mae'r gel yn gallu chwyddo neu grebachu (hyd at 1000 gwaith ei gyfaint) oherwydd newidiadau bach mewn, e. e. tymheredd neu p. H. Rhai o'r ffyrdd y gellid ei ddefnyddio yw ar gyfer cyhyrau artiffisial, ysgogwyr robotiaid ac amsugnyddion cemegau gwenwynig. Cliciwch ar y fideo er mwyn gweld hydrogel. Polymer sy’n cadw ei siâp Maent â'r gallu i adennill ei siâp gwreiddiol wrth gael eu poethi. Gellir eu defnyddio ar gyfer: 1. Pwythau llawfeddygol bioddiraddadwy a fydd yn tynhau yn awtomatig i'r tensiwn cywir (fel yn y llun i’r chwith) 2. Cyrff ceir hunan-drwsio a fydd yn adennill eu siâp wrth gael eu gwresogi yn ofalus ar ôl tolc. 124

2. 4 Cyfraddau Newid Cemegol 125

Cyfraddau Adwaith • Gall adweithiau fod yn gyflym iawn, fel tân gwyllt neu ffrwydriad, ond gallant fod yn araf iawn – afal yn troi’n frown. 126

Cyfraddau Adwaith • Os yw adwaith gemegol am ddigwydd mae’n rhaid i’r gronynnau wrthdaro gyda digon o egni. 127

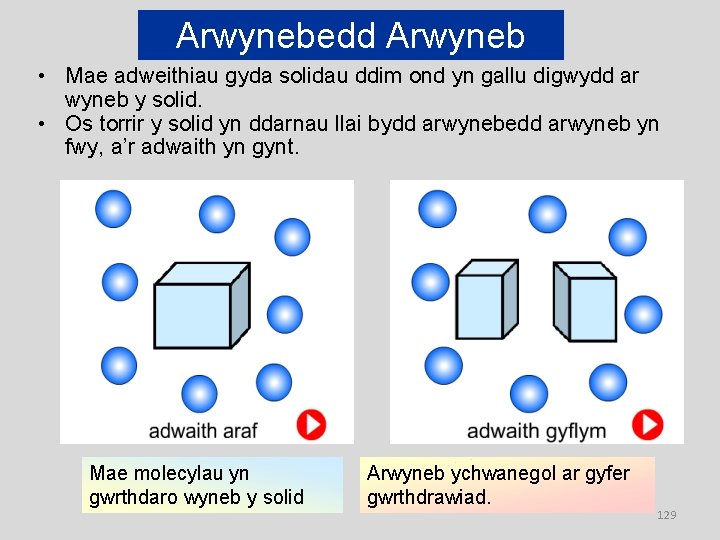
Cyflymu Adweithiau • Bydd unrhyw beth sy’n cynyddu’r siawns o gael gwrthdrawdiad llwyddiannus yn cynyddu cyflymder (cyfradd) adwaith. Ffactorau fel: • Cynyddu arwynebedd arwyneb • Cynyddu crynodiad • Cynyddu tymheredd • Defnyddio catalydd 128

Arwynebedd Arwyneb • Mae adweithiau gyda solidau ddim ond yn gallu digwydd ar wyneb y solid. • Os torrir y solid yn ddarnau llai bydd arwynebedd arwyneb yn fwy, a’r adwaith yn gynt. Mae molecylau yn gwrthdaro wyneb y solid Arwyneb ychwanegol ar gyfer gwrthdrawiad. 129

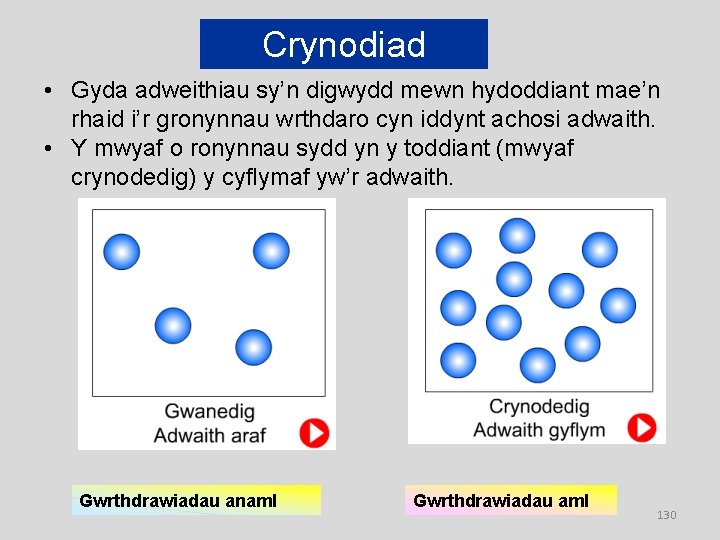
Crynodiad • Gyda adweithiau sy’n digwydd mewn hydoddiant mae’n rhaid i’r gronynnau wrthdaro cyn iddynt achosi adwaith. • Y mwyaf o ronynnau sydd yn y toddiant (mwyaf crynodedig) y cyflymaf yw’r adwaith. Gwrthdrawiadau anaml Gwrthdrawiadau aml 130

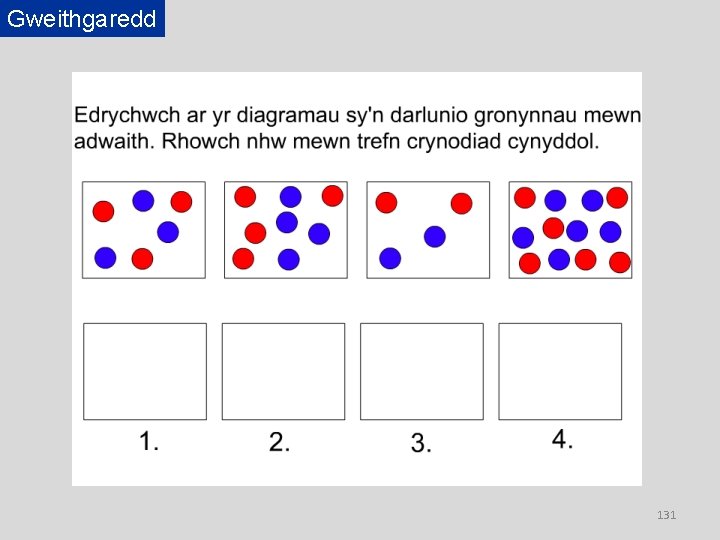
Gweithgaredd 131

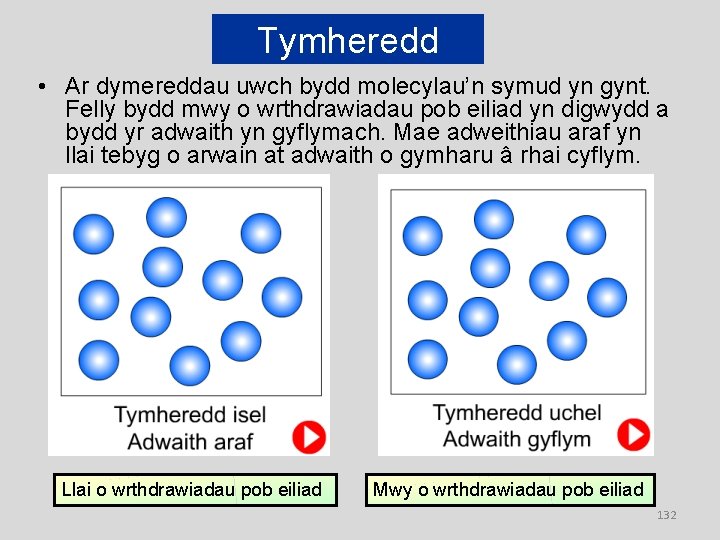
Tymheredd • Ar dymereddau uwch bydd molecylau’n symud yn gynt. Felly bydd mwy o wrthdrawiadau pob eiliad yn digwydd a bydd yr adwaith yn gyflymach. Mae adweithiau araf yn llai tebyg o arwain at adwaith o gymharu â rhai cyflym. Llai o wrthdrawiadau pob eiliad Mwy o wrthdrawiadau pob eiliad 132

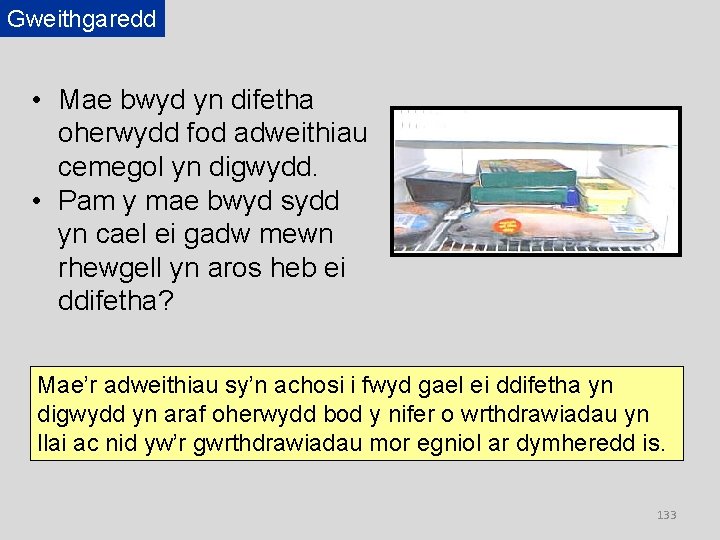
Gweithgaredd • Mae bwyd yn difetha oherwydd fod adweithiau cemegol yn digwydd. • Pam y mae bwyd sydd yn cael ei gadw mewn rhewgell yn aros heb ei ddifetha? Mae’r adweithiau sy’n achosi i fwyd gael ei ddifetha yn digwydd yn araf oherwydd bod y nifer o wrthdrawiadau yn llai ac nid yw’r gwrthdrawiadau mor egniol ar dymheredd is. 133

Catalyddion • Er mwyn i adweithiau cemegol ddigwydd: – Rhaid dechrau torri bondiau sy’n bodoli fel y gall bondiau newydd gael eu ffurfio. – Mae’n rhaid i’r molecylau wrthdaro yn y fath fodd fel bod i’r rhannau adweithiol o’r molecylau gyfarfod. • Gall catalyddion gynorthwyo gyda un neu ddau o’r prosesau yma. • Catalydd yw sylwedd sy’n cyflymu adwaith ond heb gael ei dreulio yn yr adwaith. Mae ensym yn gatalydd naturiol 134

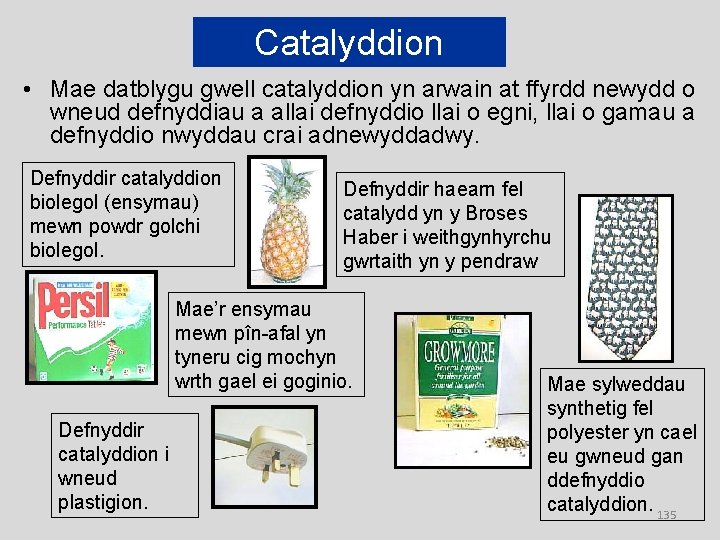
Catalyddion • Mae datblygu gwell catalyddion yn arwain at ffyrdd newydd o wneud defnyddiau a allai defnyddio llai o egni, llai o gamau a defnyddio nwyddau crai adnewyddadwy. Defnyddir catalyddion biolegol (ensymau) mewn powdr golchi biolegol. Defnyddir haearn fel catalydd yn y Broses Haber i weithgynhyrchu gwrtaith yn y pendraw Mae’r ensymau mewn pîn-afal yn tyneru cig mochyn wrth gael ei goginio. Defnyddir catalyddion i wneud plastigion. Mae sylweddau synthetig fel polyester yn cael eu gwneud gan ddefnyddio catalyddion. 135

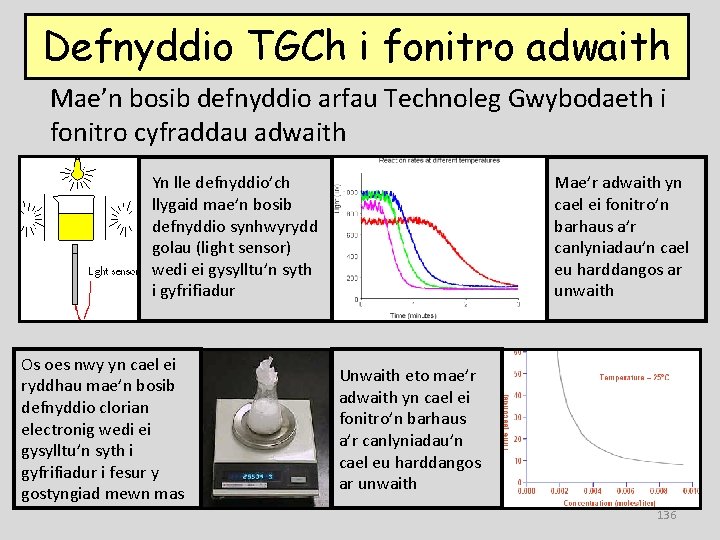
Defnyddio TGCh i fonitro adwaith Mae’n bosib defnyddio arfau Technoleg Gwybodaeth i fonitro cyfraddau adwaith Yn lle defnyddio’ch llygaid mae’n bosib defnyddio synhwyrydd golau (light sensor) wedi ei gysylltu’n syth i gyfrifiadur Os oes nwy yn cael ei ryddhau mae’n bosib defnyddio clorian electronig wedi ei gysylltu’n syth i gyfrifiadur i fesur y gostyngiad mewn mas Mae’r adwaith yn cael ei fonitro’n barhaus a’r canlyniadau’n cael eu harddangos ar unwaith Unwaith eto mae’r adwaith yn cael ei fonitro’n barhaus a’r canlyniadau’n cael eu harddangos ar unwaith 136

Pa un o rhain byddai’n cyflymu cyfradd adwaith magnesiwm gydag asid? A. B. C. D. Oeri’r asid Torri’r magnesiwm yn llai Ychwanegu dŵr Gorchuddio’r magnesiwm gydag olew. 137

Mae torri solidau yn ddarnau llai yn cyflymu cyfradd adwaith. Pam? A. B. C. D. Gweud mwy o solid Creu mwy o egni Cynyddu arwynebedd arwyneb Cynyddu’r crynodiad 138

Mae codi’r tymheredd yn cyflymu cyfradd adwaith. Pam? A. Gweithredu fel catalydd B. Cynyddu’r crynodiad C. Cynyddu’r nifer o folecylau D. Mae gwrthdrawiadau’n fwy aml ac yn fwy egniol. 139

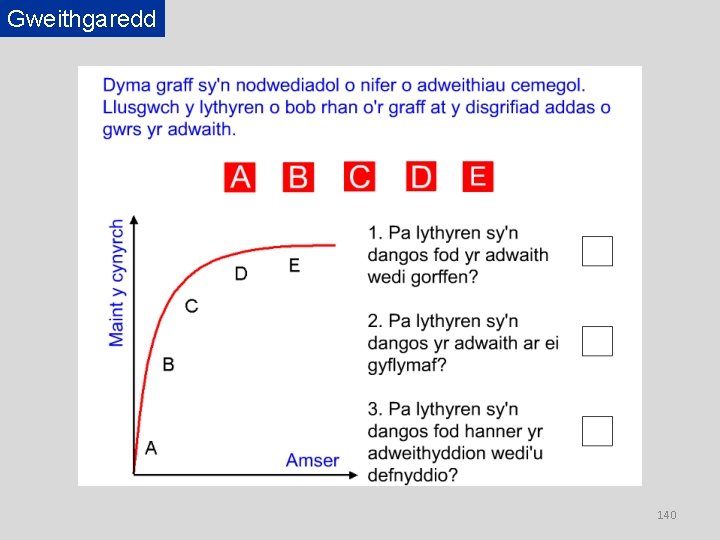
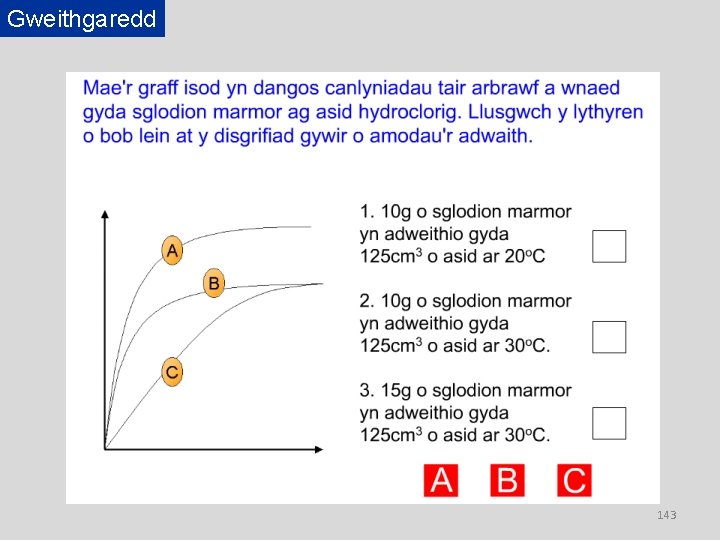
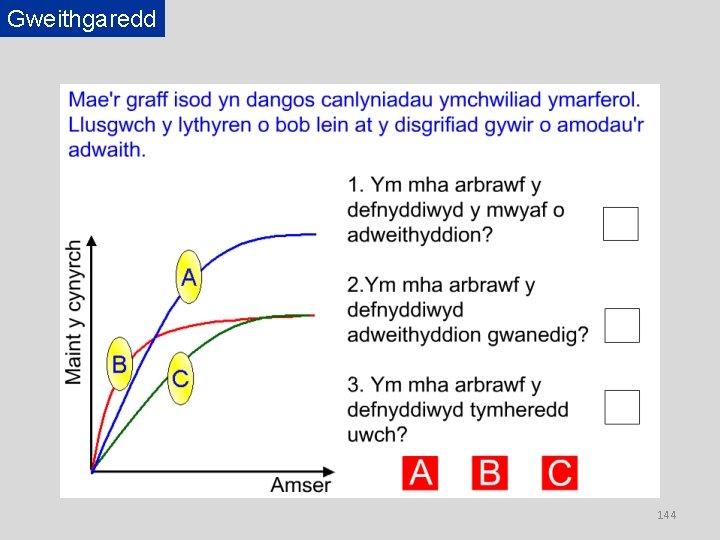
Gweithgaredd 140

Gweithgaredd 141

Gweithgaredd 142

Gweithgaredd 143

Gweithgaredd 144

2. 5 Cemeg organig syml 145

Tanwyddau ffosil Tanwydd yw rhywbeth sydd medru cael ei hylosgi i ryddhau egni e. e. petrol, nwy naturiol, papur, hen bobl. Ffosil yw rhywbeth sydd wedi cael ei ddal mewn craig Tanwydd ffosil felly yw tanwydd wedi ei ddal mewn craig. Y tri tanwydd ffosil mwyaf cyfarwydd yw Øolew crai Øglo Ønwy naturiol. Sut mae olew yn cael ei ffurfio + beth yw trap olew? http: //www. bbc. co. uk/cymru/tgau/cemeg/tanwyddau/olewcrai. shtml 146

Carbon: Cemeg Organig • • • Atom anarferol yw carbon oherwydd ei allu i ffurfio bondiau cofalent cryf gyda atomau eraill o carbon. Os ydym yn ystyried hefyd ei allu i gyfuno â nifer o elfennau eraill mae hyn yn agor byd o folecylau cymhleth ac amrywiol (e. e. DNA) sy’n arwain at gynnal bywyd. Dyma’r rheswm y mae’r astudiaeth o gyfansoddion carbon yn cael ei alw’n gemeg organig. 147

Hylosgiad hydrocarbonau • Mae gan hydrocarbonau un adwaith bwysig iawn: hylosgiad. • Gyda chyflenwad digonol o ocsigen maent yn adweithio i ffurfio carbon deuocsid a dŵr. E. e. Methan + ocsigen carbon deuocsid + dŵr CH 4 + 2 O 2 CO 2 + 2 H 2 O Ethan + ocsigen carbon deuocsid + dŵr 2 C 2 H 6 + 7 O 2 6 H 2 O + 4 CO 2 148

Hylosgiad Anghyflawn yr Alcanau • Mewn cyflenwad annigonol o aer, cynhyrchion hylosgiad yr hydrocarbonau fydd carbon monocsid a dŵr. • Mae carbon monocsid yn wenwynig iawn a dyma’r rheswm dros trin boeleri nwy yn rheolaidd. • Mae hylosgid anghyflawn hydrocarbonau hefyd yn cynhyrchu huddugl (soot) Canfodydd carbon monocsid 149

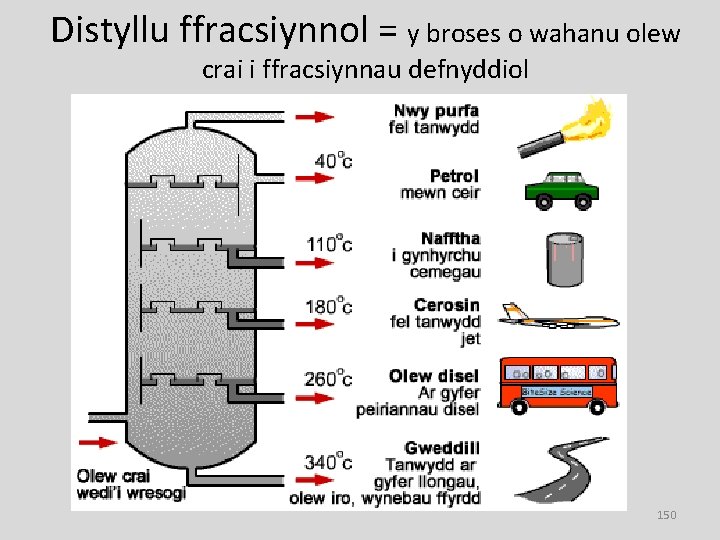
Distyllu ffracsiynnol = y broses o wahanu olew crai i ffracsiynnau defnyddiol 150

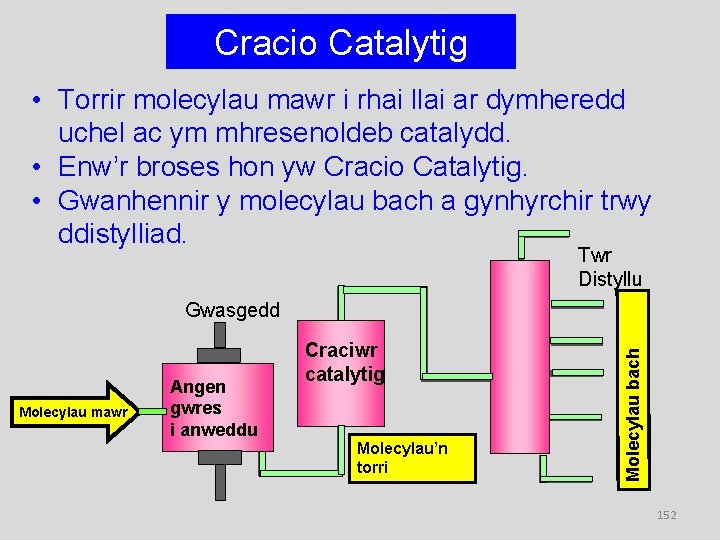
Sut i wneud well defnydd o’r ffracsiynau mwyaf • Mae olew crai yn cynnwys nifer o folecylau mawr. • I ddefnyddio rhain fel tanwyddau neu fel deunydd crai ar gyfer y diwydiant gemegol rhaid eu torri (cracio) i ffurfio molecylau llai. Molecylau bach Molecylau mawr Molecylau canolig 151

Cracio Catalytig • Torrir molecylau mawr i rhai llai ar dymheredd uchel ac ym mhresenoldeb catalydd. • Enw’r broses hon yw Cracio Catalytig. • Gwanhennir y molecylau bach a gynhyrchir trwy ddistylliad. Twr Distyllu Molecylau mawr Angen gwres i anweddu Craciwr catalytig Molecylau’n torri Molecylau bach Gwasgedd 152

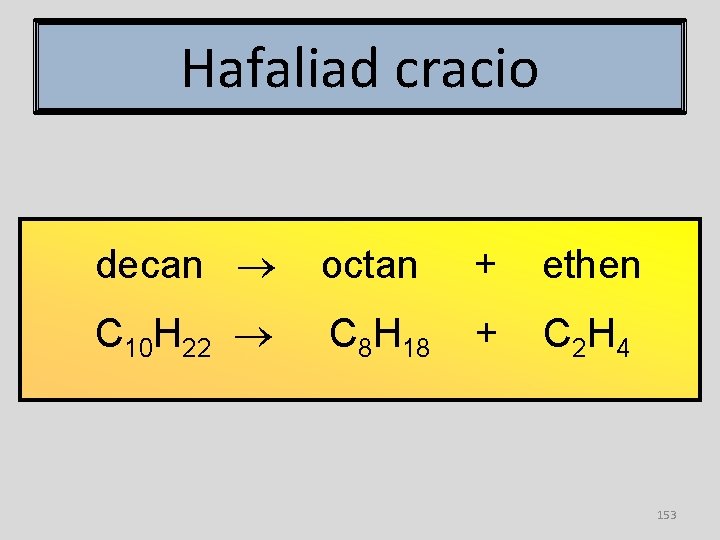
Hafaliad cracio decan octan + ethen C 10 H 22 C 8 H 18 + C 2 H 4 153

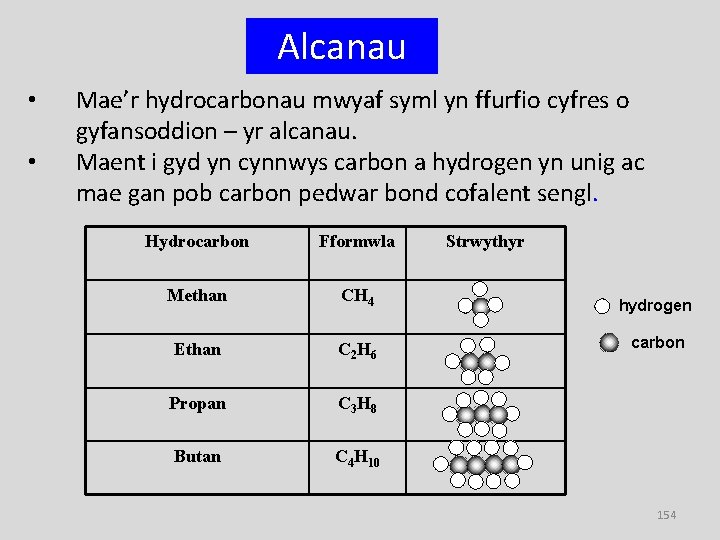
Alcanau • • Mae’r hydrocarbonau mwyaf syml yn ffurfio cyfres o gyfansoddion – yr alcanau. Maent i gyd yn cynnwys carbon a hydrogen yn unig ac mae gan pob carbon pedwar bond cofalent sengl. Hydrocarbon Fformwla Methan CH 4 Ethan C 2 H 6 Propan C 3 H 8 Butan C 4 H 10 Strwythyr hydrogen carbon 154

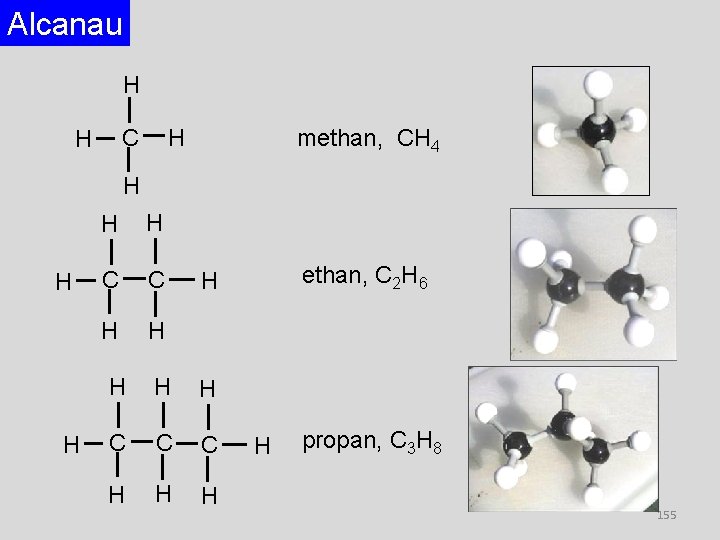
Alcanau H H C H methan, CH 4 H H H C C H H ethan, C 2 H 6 H H C C C H H propan, C 3 H 8 155

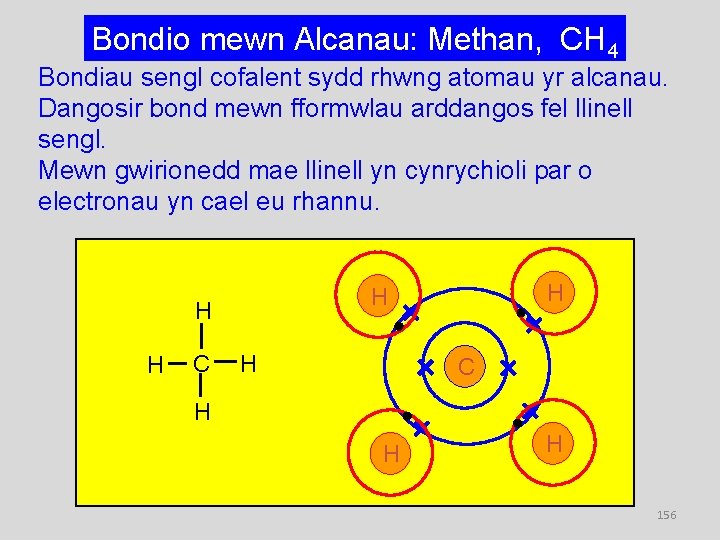
Bondio mewn Alcanau: Methan, CH 4 Bondiau sengl cofalent sydd rhwng atomau yr alcanau. Dangosir bond mewn fformwlau arddangos fel llinell sengl. Mewn gwirionedd mae llinell yn cynrychioli par o electronau yn cael eu rhannu. H H C H H H 156

Alcenau • Mae carbon yn ffurfio pedwar bond ym mhob un o’i gyfansoddion. • Ond nid yw hyn yn golygu fod pob carbon yn uno â phedwar atom arall. • Mae’n bosibl grwpio bondiau i barau. Bondiau dwbl yw rhain. • Mae alcenau yn cynnwys atomau carbon wedi’u huno gan fondiau cofalent dwbl. Bond cofalent sengl C C Bond cofalent dwbl C C 157

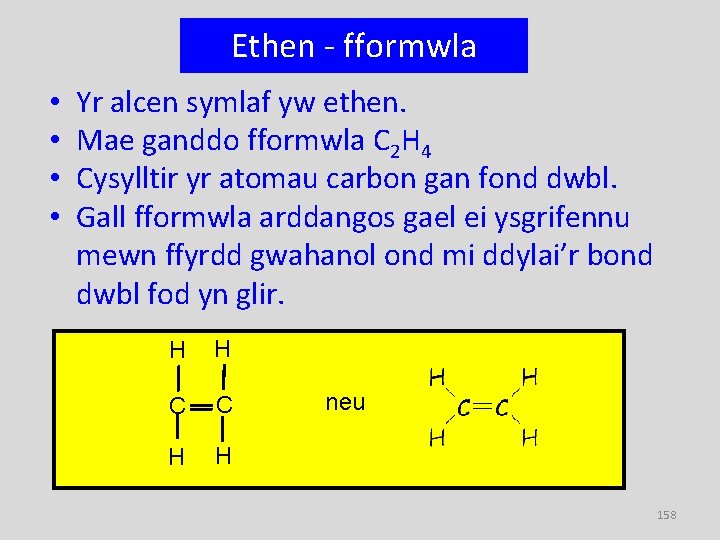
Ethen - fformwla • • Yr alcen symlaf yw ethen. Mae ganddo fformwla C 2 H 4 Cysylltir yr atomau carbon gan fond dwbl. Gall fformwla arddangos gael ei ysgrifennu mewn ffyrdd gwahanol ond mi ddylai’r bond dwbl fod yn glir. H H C C H H neu 158

Dirlawn neu Annirlawn • Ystyr dirlawn yw “yn llawn” • Mae’r Alcanau yn ddirlawn. • Mae pob atom o garbon eisioes wedi defnyddio’i bedwar bond i gysylltu â phedwar atom arall. Nid yw’n bosibl ychwanegu mwy o atomau. • Mae Alcenau yn annirlawn • Mae ganddynt fond dwbl a all newid i ddau fond sengl. Felly mae’n bosibl ychwanegu atomau eraill ato. Nid yw “yn llawn” 159

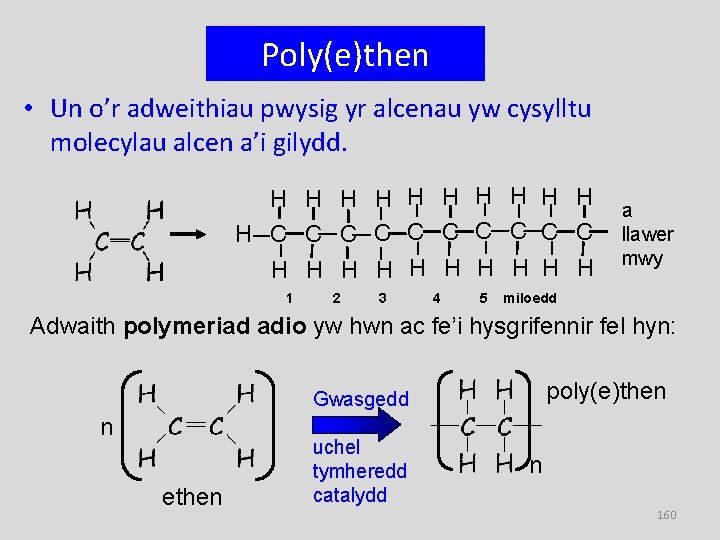
Poly(e)then • Un o’r adweithiau pwysig yr alcenau yw cysylltu molecylau alcen a’i gilydd. H H H C C C C C H H H H H 1 2 3 4 5 a llawer mwy miloedd Adwaith polymeriad adio yw hwn ac fe’i hysgrifennir fel hyn: poly(e)then Gwasgedd n ethen uchel tymheredd catalydd n 160

Polytetrafflworoethen (PTFE) Mae’n lleihau ffrithiant ac yn sylwedd “non stick” F F n Polycloroethen (PVC) Dillad e. e. lledr ffug (hawdd ei lanhau) Cl n Fframiau ffenestri (ddim yn pydru) 161

Y defnydd o thermoblastigau Poly(e)then Bagiau siopa Poteli Bwcedi Powlenni gochi llestri Mae’n bosib ail gynhesu ac ail fowldio thermoplastigion. Maent yn meddalu. Polypropen Crât llefrith Rhaff Ffibrau carped Polysteirin Deunydd pacio Ynysydd Beiros 162

Y defnydd o blastigion thermosodol Nid yw’n bosib ail gynhesu nac ail fowldio plastigion thermosodol. Mae’r rhain yn cael eu defnyddio os oes siawns bydd y sylwedd am fynd yn boeth. Ffitiadau goleuadau Handlan sosban 163

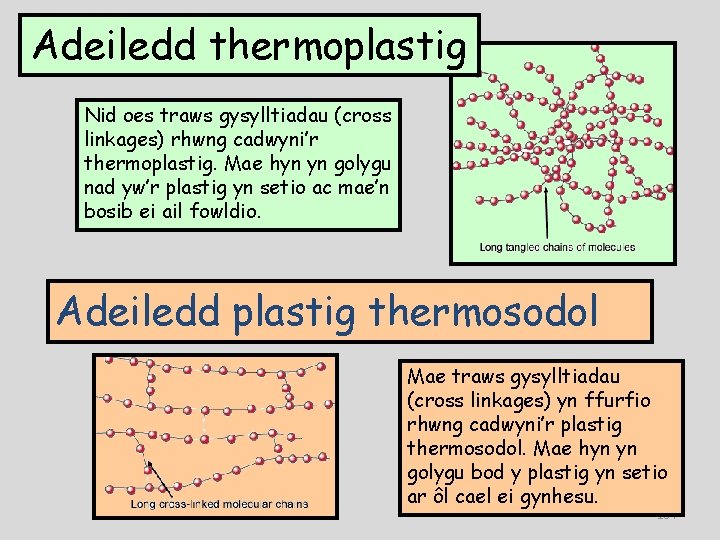
Adeiledd thermoplastig Nid oes traws gysylltiadau (cross linkages) rhwng cadwyni’r thermoplastig. Mae hyn yn golygu nad yw’r plastig yn setio ac mae’n bosib ei ail fowldio. Adeiledd plastig thermosodol Mae traws gysylltiadau (cross linkages) yn ffurfio rhwng cadwyni’r plastig thermosodol. Mae hyn yn golygu bod y plastig yn setio ar ôl cael ei gynhesu. 164

Pa un o rhain sy’n alcan? A. C 6 H 14 B. C 4 H 8 C. C 12 H 24 D. C 102 H 204 165

Pa un o rhain sy’n wir am yr alcenau? A. B. C. D. Nid ydynt yn troi dŵr bromin o goch i glir Mae ganddynt fond dwbl Un atom o garbon sydd gan yr alcen lleiaf Mae eu henwau yn gorffen gyda “an” 166

Pa un o’r gosodiadau yma sy’n wir am cracio? A. proses yw o wahanu molecylau i ffracsiynau o feintiau gwahanol. B mae’n cael ei wneud ar dymheredd isel C mae’n defnyddio catalydd D mae’n cynhyrchu polymerau 167

Pa un o’r gosodiadau yma sy’n wir am polymereiddio? A. cysylltu nifer fawr o folecylau bychan a’i gilydd B. proses ydyw o ddadelfeniad thermol plastigau C. mae angen molecylau dirlawn ar gyfer yr adwaith D. adwaith lluosogi ydyw 168

Pa un o rhain sy’n bolymer adiad? A. B. C. D. steirin ethen p. v. c. propan 169

2. 6 Cyfrifiadau Cemegol 170

Mas Fformiwla • Am nifer o resymau mae’n ddefnyddiol defnyddio’r hyn a elwir yn mas fformiwla. • I gyfrifo hwn byddwn yn syml yn adio gyda’i gilydd masau atomig yr holl atomau a ddangosir yn y fformiwla. (N=14; H=1; Na=23; O=16; Mg=24; Ca=40) Sylwedd Fformiwla Mas Fformiwla Amonia NH 3 14 + (3 x 1)=17 Sodiwm ocsid Na 2 O (2 x 23) + 16 =62 Magnesiwm hydrocsid Mg(OH)2 24+ 2(16+1)=58 Calsiwm nitrad Ca(NO 3)2 40+ 2(14+(3 x 16))=164 171

Beth yw fformiwla mas Mg. Cl 2 ? Mg=24 Cl=35. 5 1. 59. 5 2. 83. 5 3. 95 4. 119 172

Beth yw fformiwla mas Mg(OH)2 ? Mg=24 O=16 H = 1 1. 41 2. 42 3. 57 4. 58 173

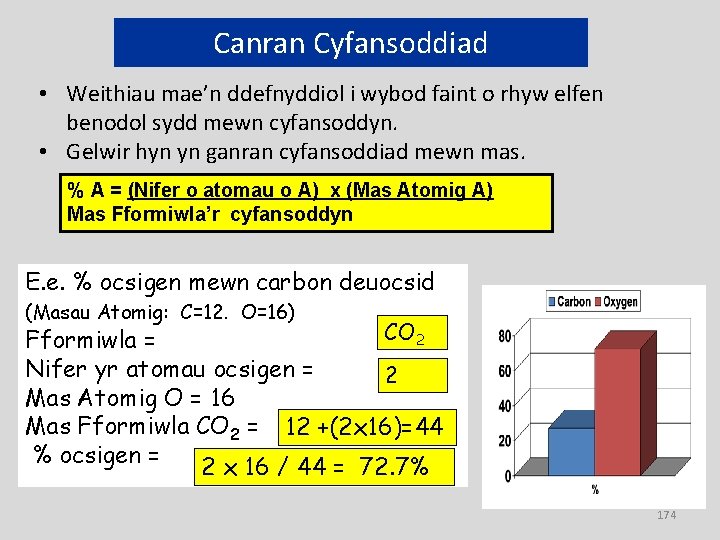
Canran Cyfansoddiad • Weithiau mae’n ddefnyddiol i wybod faint o rhyw elfen benodol sydd mewn cyfansoddyn. • Gelwir hyn yn ganran cyfansoddiad mewn mas. % A = (Nifer o atomau o A) x (Mas Atomig A) Mas Fformiwla’r cyfansoddyn E. e. % ocsigen mewn carbon deuocsid (Masau Atomig: C=12. O=16) CO 2 Fformiwla = Nifer yr atomau ocsigen = 2 Mas Atomig O = 16 Mas Fformiwla CO 2 = 12 +(2 x 16)=44 % ocsigen = 2 x 16 / 44 = 72. 7% 174

Beth yw canran nitrogen mewn amoniwm sylffad (NH 4)2 SO 4? 1. 2. 3. 4. 21% 42% 63% 84% 175

Mas Fformiwla • Pan ddarganfyddir cyfansoddyn newydd mae’n rhaid i ni weithio allan ei fformiwla. • Golyga hyn bob amser fod angen data am fasau’r elfennau sydd wedi cyfuno gyda’i gilydd. • Yr hyn sydd raid i ni ei wneud yw gweithio’n ôl o’r data hyn i gyfrifo’r nifer o atomau o bob elfen ac yna cyfrifo’r gymhareb. • Er mwyn gwneud hyn rhannwn mas pob atom gyda’i fas atomig. • Y ffordd orau i gyfrifo yw mewn 5 cam: 176

• Darganfyddom fod 3. 2 g o gopr yn adweithio gyda 0. 8 g o ocsigen. Beth yw fformiwla’r ocsid o gopr a ffurfir? (Mas atomig Cu=64: O=16) Sylwedd 1. Elfennau 2. Mas pob elfen (g) 3. Mas / Mas Atomig 4. Cymhareb 5. Fformiwla Copr ocsid Cu O 3. 2 0. 8 3. 2/64 =0. 05 0. 8/16 =0. 05 1: 1 Cu. O 177

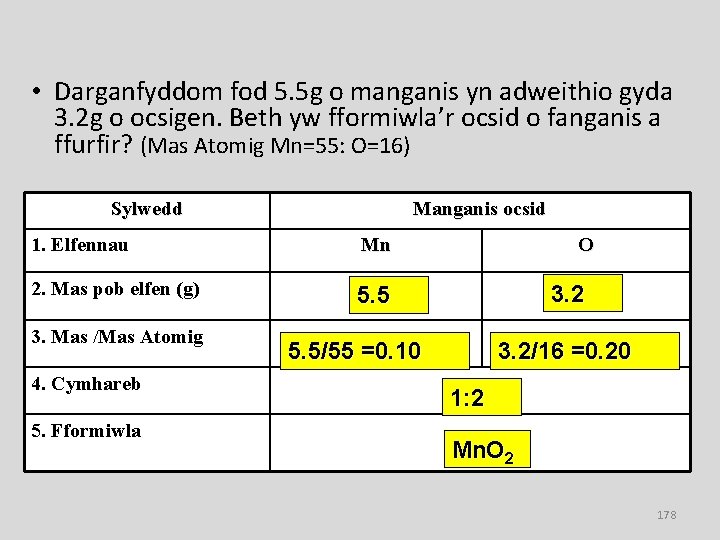
• Darganfyddom fod 5. 5 g o manganis yn adweithio gyda 3. 2 g o ocsigen. Beth yw fformiwla’r ocsid o fanganis a ffurfir? (Mas Atomig Mn=55: O=16) Sylwedd Manganis ocsid 1. Elfennau Mn 2. Mas pob elfen (g) 5. 5 3. Mas /Mas Atomig 4. Cymhareb 5. Fformiwla O 3. 2 5. 5/55 =0. 10 3. 2/16 =0. 20 1: 2 Mn. O 2 178

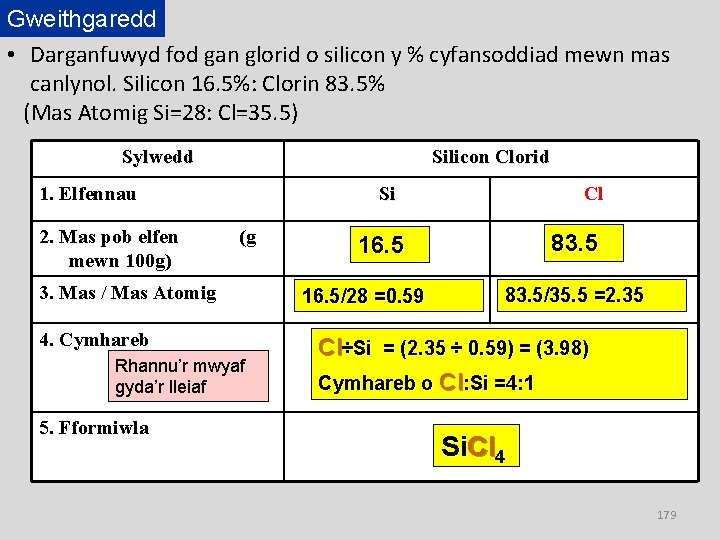
Gweithgaredd • Darganfuwyd fod gan glorid o silicon y % cyfansoddiad mewn mas canlynol. Silicon 16. 5%: Clorin 83. 5% (Mas Atomig Si=28: Cl=35. 5) Sylwedd Silicon Clorid 1. Elfennau 2. Mas pob elfen mewn 100 g) Si (g 3. Mas / Mas Atomig 4. Cymhareb Rhannu’r mwyaf gyda’r lleiaf 5. Fformiwla Cl 83. 5 16. 5/28 =0. 59 83. 5/35. 5 =2. 35 Cl÷Si = (2. 35 ÷ 0. 59) = (3. 98) Cymhareb o Cl: Si =4: 1 Si. Cl 4 179

Beth yw fformiwla cyfansoddyn sy’n cynnwys 1. 4 g o nitrogen a 3. 2 g o ocsigen? (N=14 O=16) 1. 2. 3. 4. N 2 O NO NO 2 N 2 O 3 180

Beth yw fformiwla cyfansoddyn sy’n cynnwys 6. 5 g o sinc a 1. 6 g o ocsigen? (Zn=65 O=16) 1. 2. 3. 4. Zn. O Zn 2 O 3 Zn. O 2 Zn 2 O 181

Mae hydrogen yn adweithio gyda clorin i ffurfio hydrogen clorid HCl. H 2 + Cl 2 2 HCl Pa fas o hydrogen clorid a gynhyrchir gan 4 g o nwy hydrogen? (H=1 Cl=35. 5) 1 2 3 4 36. 5 g 73 g 109. 5 g 146 g 182

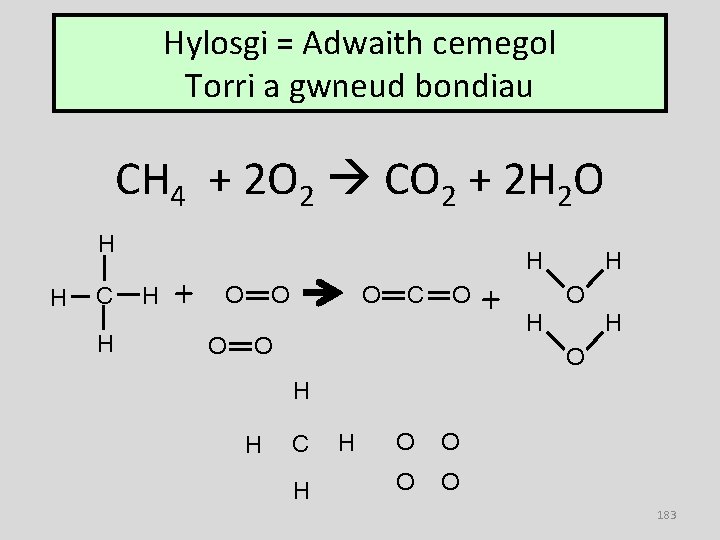
Hylosgi = Adwaith cemegol Torri a gwneud bondiau CH 4 + 2 O 2 CO 2 + 2 H 2 O H H C H H + O O C O O + H H O H H C H H O O 183

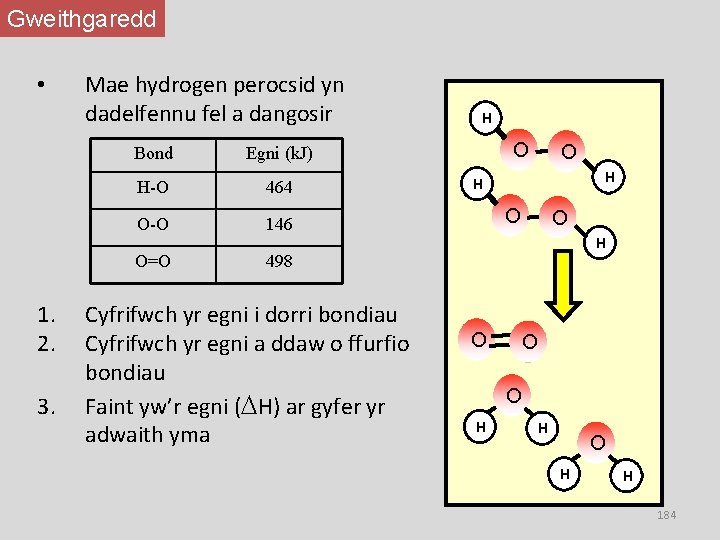
Gweithgaredd • Mae hydrogen perocsid yn dadelfennu fel a dangosir Bond Egni (k. J) H-O 464 O-O 146 H O O H O=O 1. 2. 3. 498 Cyfrifwch yr egni i dorri bondiau Cyfrifwch yr egni a ddaw o ffurfio bondiau Faint yw’r egni ( H) ar gyfer yr adwaith yma O O O H H 184

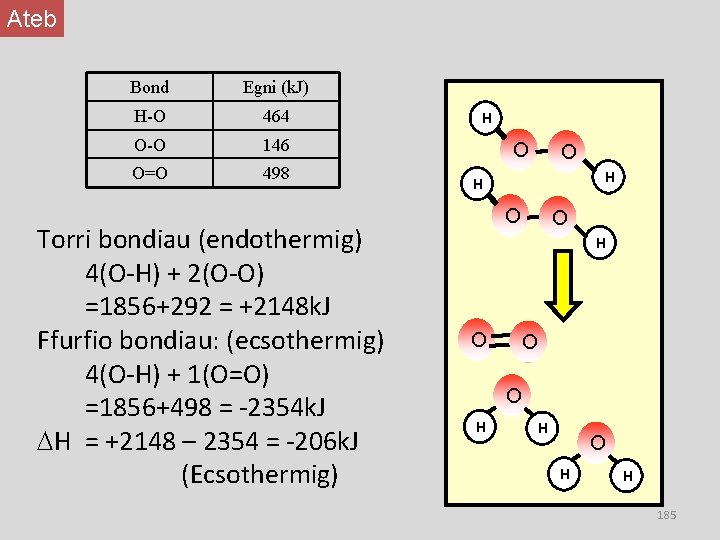
Ateb Bond Egni (k. J) H-O 464 O-O 146 O=O 498 Torri bondiau (endothermig) 4(O-H) + 2(O-O) =1856+292 = +2148 k. J Ffurfio bondiau: (ecsothermig) 4(O-H) + 1(O=O) =1856+498 = -2354 k. J H = +2148 – 2354 = -206 k. J (Ecsothermig) H O O O H H 185

2. 7 DWR 186

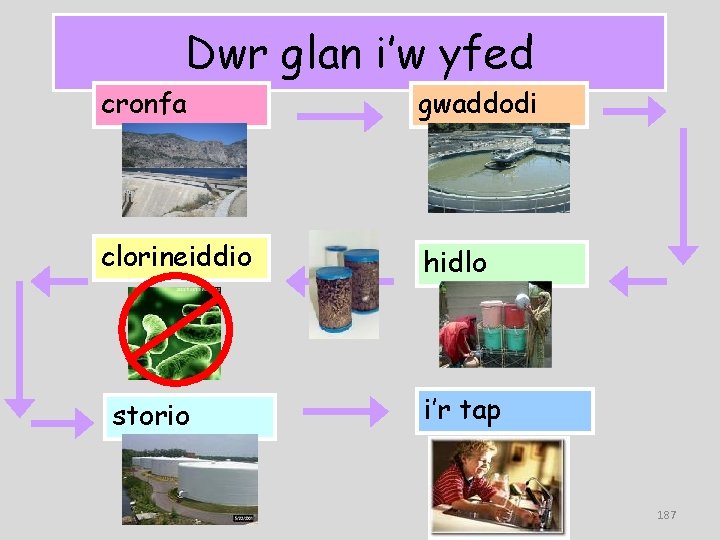
Dwr glan i’w yfed cronfa gwaddodi clorineiddio hidlo storio i’r tap 187

Hydoddedd: Rhai geiriau pwysig Hydoddyn: Hydoddydd: Hydoddiant: Hydawdd: Anhydawdd: Dirlawn: Annirlawn: y soled sy’n hydoddi yr hylif sy’n gwneud yr hydoddi y cymysgedd o hydoddyn a hydoddydd gallu hydoddi dim yn gallu hydoddi yn cynnwys cymaint o’r hydoddyn sy’n bosibl hydoddi ar y tymheredd hwn gallu hydoddi rhagor o hydoddyn. 188

Gweithgaredd 189

Gweithgaredd 190

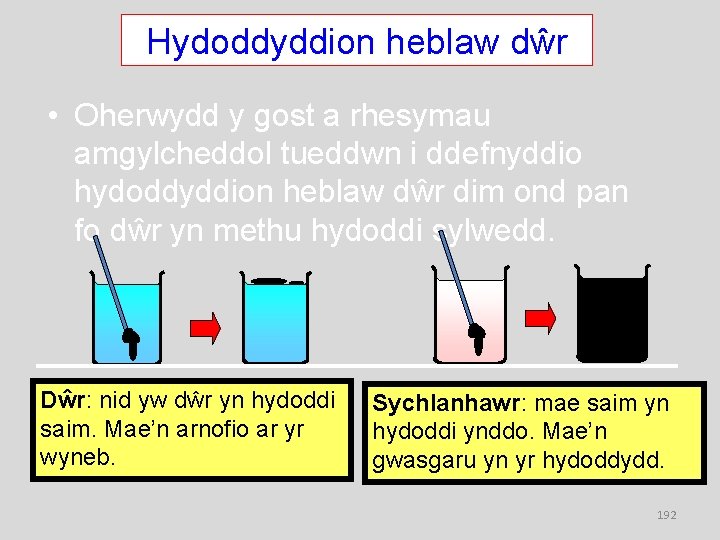
Hydoddyddion heblaw dŵr Dŵr yw un o’r hydoddyddion gorau, ond nid yr unig un. Gwirod methyl yn hydoddi saim Gwirod gwyn yn hydoddi paent 1. 1. 1 -tricloroethan Gwirod petroliwm yn yn hydoddi “tippex” hydoddi gludyddion 191

Hydoddyddion heblaw dŵr • Oherwydd y gost a rhesymau amgylcheddol tueddwn i ddefnyddio hydoddyddion heblaw dŵr dim ond pan fo dŵr yn methu hydoddi sylwedd. Dŵr: nid yw dŵr yn hydoddi saim. Mae’n arnofio ar yr wyneb. Sychlanhawr: mae saim yn hydoddi ynddo. Mae’n gwasgaru yn yr hydoddydd. 192

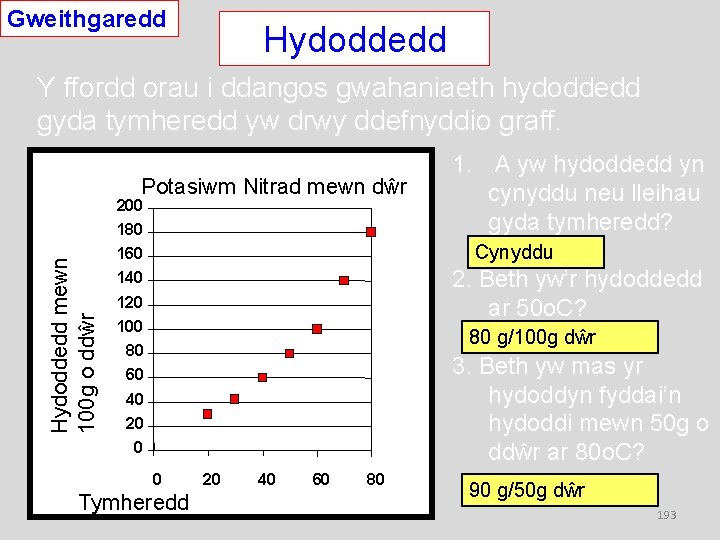
Gweithgaredd Hydoddedd Y ffordd orau i ddangos gwahaniaeth hydoddedd gyda tymheredd yw drwy ddefnyddio graff. Potasiwm Nitrad mewn dŵr 200 Hydoddedd mewn 100 g o ddŵr 180 1. A yw hydoddedd yn cynyddu neu lleihau gyda tymheredd? Cynyddu 160 2. Beth yw’r hydoddedd ar 50 o. C? 140 120 100 80 g/100 g dŵr 80 3. Beth yw mas yr hydoddyn fyddai’n hydoddi mewn 50 g o ddŵr ar 80 o. C? 60 40 20 0 0 Tymheredd 20 40 60 80 90 g/50 g dŵr 193

Gweithgaredd Mae’r cyfarwyddiadau ar sut i gael data ar gyfer graff hydoddedd yn ol tymheredd wedi eu rhestru isod. Rhowch hwynt yn y drefn gywir. 194

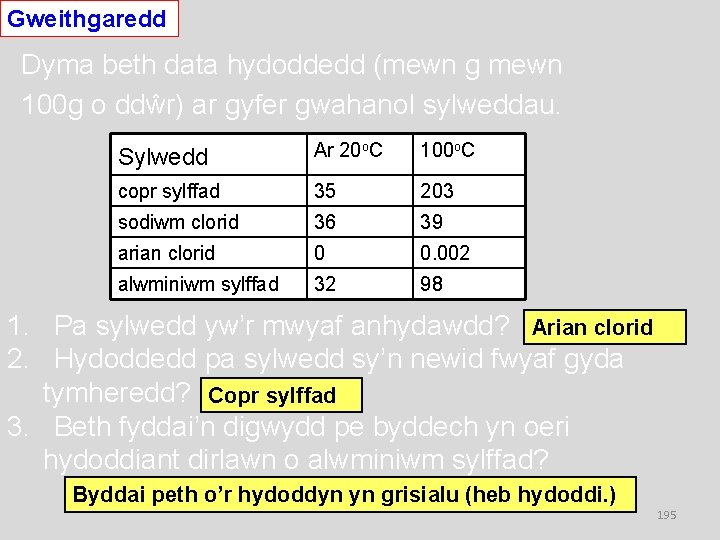
Gweithgaredd Dyma beth data hydoddedd (mewn g mewn 100 g o ddŵr) ar gyfer gwahanol sylweddau. Sylwedd Ar 20 o. C 100 o. C copr sylffad 35 203 sodiwm clorid 36 39 arian clorid 0 0. 002 alwminiwm sylffad 32 98 1. Pa sylwedd yw’r mwyaf anhydawdd? Arian clorid 2. Hydoddedd pa sylwedd sy’n newid fwyaf gyda tymheredd? Copr sylffad 3. Beth fyddai’n digwydd pe byddech yn oeri hydoddiant dirlawn o alwminiwm sylffad? Byddai peth o’r hydoddyn yn grisialu (heb hydoddi. ) 195

Dŵr caled a meddal Mae dŵr caled yn cynnwys cyfansoddion magnesiwm a chalsiwm. Mae’r rhain yn hydoddi yn y dŵr wrth i ddŵr glaw treiddio trwy gerrig sy’n cynnwys cemegau megis calsiwm carbonad a magnesiwm sylffad. Nid yw dŵr meddal yn cynnwys cyfansoddion magnesiwm a chalsiwm. Trochion (lather/suds) Mae sebon yn adweithio gyda’r cyfansoddion magnesiwm a chalsiwm mewn dŵr caled i gynhyrchu llysnafedd (scum) yn lle trochion (lather) Llysnafedd (scum) Mae 2 wahanol math o ddŵr caled. Ceir dŵr caled parhaol a dŵr caled dros dro. Mae’n bosib berwi dŵr caled dros dro i’w wneud yn feddal eto. Yn anffodus wrth i’r cyfansoddion calsiwm a magnesiwm droi’n soled wrth ferwi’r dŵr mae cen (haen o soled) yn ffurfio sy’n medru dinistrio offer sydd â dŵr caled dros dro ynddynt ac sy’n poethi e. e. peipiau dwr poeth, tegell, haearn smwddio, boileri, rhieddiaduron. 196

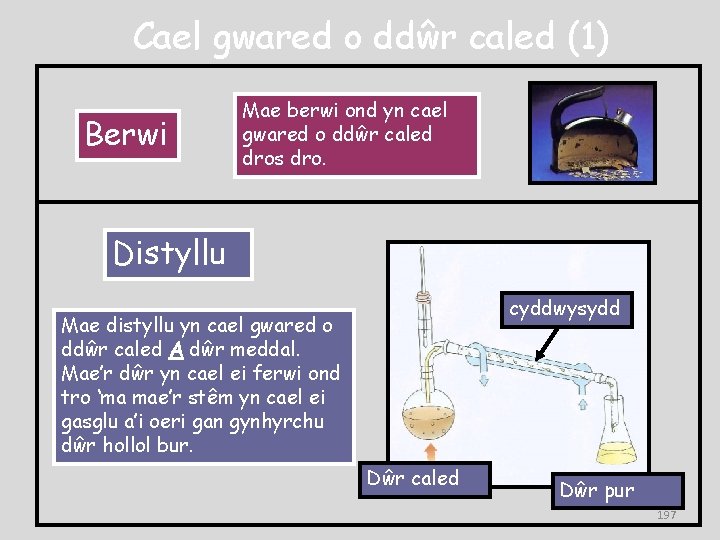
Cael gwared o ddŵr caled (1) Berwi Mae berwi ond yn cael gwared o ddŵr caled dros dro. Distyllu cyddwysydd Mae distyllu yn cael gwared o ddŵr caled A dŵr meddal. Mae’r dŵr yn cael ei ferwi ond tro ‘ma mae’r stêm yn cael ei gasglu a’i oeri gan gynhyrchu dŵr hollol bur. Dŵr caled Dŵr pur 197

Cael gwared o ddŵr caled (2) Sodiwm carbonad (soda golchi) Mae ychwanegu sodiwm carbonad (soda golchi) i ddŵr caled yn tynnu’r ddau fath o galedwch. Mae calsiwm carbonad solid yn ffurfio. Mae halwynau baddon (bath salts) yn cynnwys sodiwm carbonad er mwyn sicrhau nad yw’r sebon yn cynhyrchu llysnafedd gyda’r dŵr caled sodiwm carbonad + calsiwm sylffad sodiwm sylffad + calsiwm carbonad Cyfnewidiwr ionau Dŵr caled yn cynnwys ionau calsiwm a magnesiwm Mae cyfnewidiwr ionau yn tynnu’r ddau fath o galedwch trwy dynnu’r holl ionau calsiwm a magnesiwm o’r dŵr a’u cyfnewid gydag ionau sodiwm. Resin cyfnewid ionau Dŵr meddal yn cynnwys ionau sodiwm 198

Mesur Caledwch mewn Dwr Mae dwr meddal yn seboni'n hawdd gyda sebon ond nid yw dwr caled. Gallwch gael gwared ar galedwch dros dro trwy ferwi'r dwr ond nid felly gyda chaledwch parhaol. Cyfansoddion calsiwm neu fagnesiwm hydoddedig sy'n achosi caledwch Offer fflasg gonigol a chaead, bwred, silindr mesur 100 cm 3, samplau dwr wedi'u labelu'n 1, 2, a 3, samplau o 1, 2 a 3 wedi'u berwi, stopwats. Mae un yn ddŵr meddal, un arall yn ddŵr caled parhaol a’r olaf yn ddŵr caled dros dro. Dull (a) Mesurwch 50 cm 3 o sampl dwr 1 i fflasg gonigol. (b) Ychwanegwch 1 cm 3 o hydoddiant sebon, gosodwch y caead ac ysgwydwch am 5 eiliad. (c) Gwnewch (b) eto nes i drochion sebon ymffurfio sy'n aros am 30 eiliad. (ch) Cofnodwch gyfanswm cyfaint yr hydoddiant sebon sydd wedi'i ychwanegu. (d) Gwnewch (b) i (ch) eto gyda 50 cm 3 o'r sampl o 1 sydd wedi'i ferwi. (e) Gwnewch (a) i (d) eto gyda samplau dwr 2 a 3. Sut fath o ganlyniad buasech yn disgwyl gyda’r a) Dwr meddal? Buasai’r 2 sampl (yr un heb ei ferwi a’r un wedi ei ferwi) yn cynhyrchu trochion (lather) b) Dwr caled dros dro? Ni fuasai trochion yn cael eu cynhyrchu yn y sampl dwr heb ei ferwi ond mi fuasai trochion yn cael eu cynhyrchu yn y sampl wedi ei ferwi gan fod berwi’n cael gwared o’r caledwch c) Dwr caled parhaol? Ni fuasai trochion yn cael eu cynhyrchu yn y 2 sampl (heb ei ferwi ac wedi ei ferwi) 199