A Hatom kvantummechanikai trgyalsa Tanulsgok 1 A Hatom




































- Slides: 51

A H-atom kvantummechanikai tárgyalása Tanulságok 1

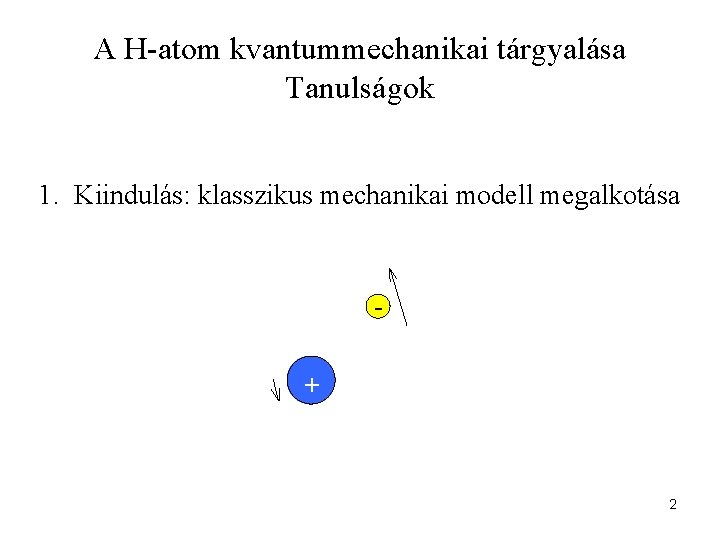
A H-atom kvantummechanikai tárgyalása Tanulságok 1. Kiindulás: klasszikus mechanikai modell megalkotása + 2

A H-atom kvantummechanikai tárgyalása Tanulságok 2. Schrödinger-egyenlet felírása: Hamilton-operátor összeállítása Ekin(elektron) Ekin(proton) Epot(pr. -el. vonzás) 3

A H-atom kvantummechanikai tárgyalása Tanulságok 3. A Schrödinger-egyenlet megoldása Sajátértékek: En Sajátfüggvények: n fő kvantumszám mellék-kvantumszám m mágneses kvantumszám 4

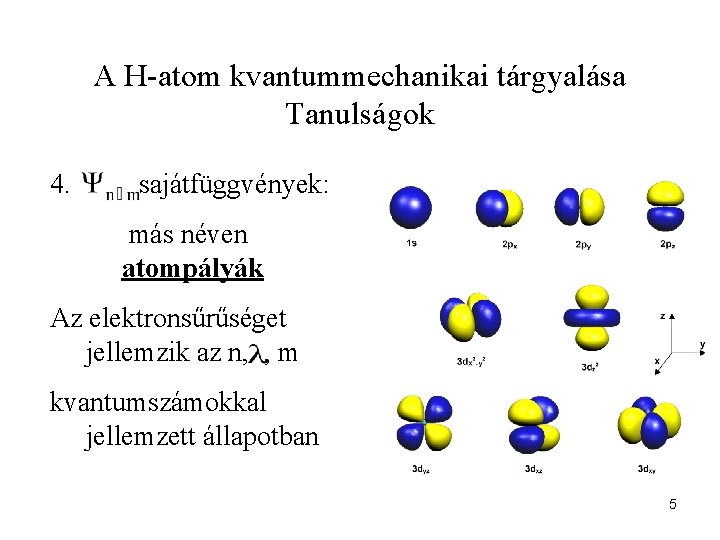
A H-atom kvantummechanikai tárgyalása Tanulságok 4. sajátfüggvények: más néven atompályák Az elektronsűrűséget jellemzik az n, , m kvantumszámokkal jellemzett állapotban 5

A H-atom kvantummechanikai tárgyalása Tanulságok 5. Az n, , m kvantumszámokkal jellemzett állapot jellemzői: En energia, En = - konst. 1/n 2 n m atompálya (elektronsűrűség-eloszlás) L imp. momentum absz. érték Lz imp. momentum z-komp. Lz = m M mág. momentum absz. érték Mz mág. momentum z-komp. Mz = m B 6

A H-atom kvantummechanikai tárgyalása Tanulságok 6. A mágneses momentum megnyilvánulása: mágneses térben a H-atom energiája: Enm = En + Vm, ahol 7

A H-atom kvantummechanikai tárgyalása Tanulságok 7. Spin: Relativisztikus hatás következménye. Akkor is van imp. momentum és mágn. momentum, ha = 0, m = 0. S imp. momentum absz. érték Sz imp. momentum z-komp. Sz = s MS mág. momentum absz. érték mág. momentum z-komp. 8

4. A TÖBBELEKTRONOS ATOMOK SZERKEZETE 9

4. 1 A többelektronos atomok Schrödinger-egyenlete 10

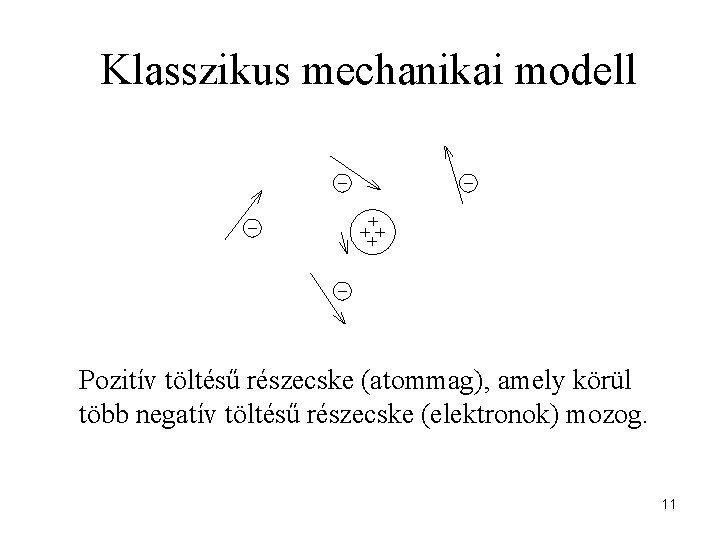
Klasszikus mechanikai modell Pozitív töltésű részecske (atommag), amely körül több negatív töltésű részecske (elektronok) mozog. 11

A Schrödinger-egyenlet általános formában 12

Többelektronos atomok Schrödinger-egyenlete Z : az atom töltése 13

Ezt a differenciál egyenletet nem lehet analitikusan megoldani, csak közelítő módszerrel (numerikusan). 14

A többelektronos atomok energiaszintjei Két közelítés: Független részecske modell Vektormodell 15

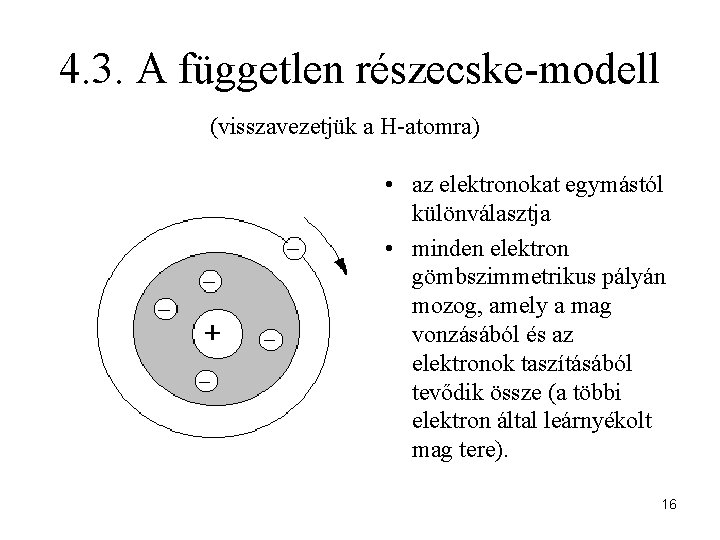
4. 3. A független részecske-modell (visszavezetjük a H-atomra) • az elektronokat egymástól különválasztja • minden elektron gömbszimmetrikus pályán mozog, amely a mag vonzásából és az elektronok taszításából tevődik össze (a többi elektron által leárnyékolt mag tere). 16

Eredmény: A többelektronos atom energiája az egyes atompályák elektronjai energiáinak összegeként adódik. 17

Atompálya jellemzi. Az energia csak n és függvénye. Atompályák energiájának sorrendje: E 1 s<E 2 p<E 3 s<E 3 p<E 4 s<E 3 d (kivétel pl. Cu-atom, E 3 d<E 4 s!) 18

A többelektronos atomok hullámfüggvénye

Legegyszerűbb: „szorzat-hullámfüggvény” A többelektronos atom hullámfüggvényét egyelektron hullámfüggvényeknek szorzataként írjuk fel. ahol egyelektron-hullámfüggvény (mint a H-atomnál): Ellentmond a 6. axiómának!!!

6. axióma Felcserélés

6. axióma Egy kvantummechanikai rendszer hullámfüggvénye • előjelet vált ha két nem egész spinű részecskét felcserélünk; • nem vált előjelet, ha a két egész spinű részecskét cserélünk fel.

Slater javaslata: determináns hullámfüggvény Egy sor: egy elektron (annak a koordinátái a változók) Egy oszlop: egyféle hullámfüggvény

Determináns kifejtése Két sort felcserélve megváltozik az előjel.

Felépítési elv („Aufbau”-principle) Az atomokat „felépítjük”, az atompályákra elektronokat helyezve. Alapállapotban a legkisebb energiájú atompályán 2 elektron, a következő atompályán 2 elektron stb. helyezkedik el. 25

Elektronkonfiguráció Az elektronok elhelyezkedése az atompályákon. Példa: alapállapotú foszfor: 1 s 22 p 63 s 23 p 3 26

Elektronhéj Azonos n és kvantumszámú atompályák. Elektronok maximális száma: Magyarázat: 27

Zárt és nyílt konfiguráció Zárt: csak teljesen betöltött és üres héjak vannak az atomban. Példa: alapállapotú Ca 1 s 22 p 63 s 23 p 64 s 2 Nyílt: van részlegesen betöltött héj. Példa: alapállapotú P 1 s 22 p 63 s 23 p 3 28

Elektrongerjesztés: Egy elektron kisebb energiájú pályáról nagyobb energiájú pályára lép. Kiválasztási szabály: Ionizáció: Egy elektron eltávolítása az egyik atompályáról. 29

Független részecske modell Előnye: szemléletes, elektronszerkezetet, ionizáció, gerjesztést könnyű elképzelni Hátránya: számítva az atomok energiáját az egyes állapotokban a kísérleti értékektől messze eltérő eredményt ad 30

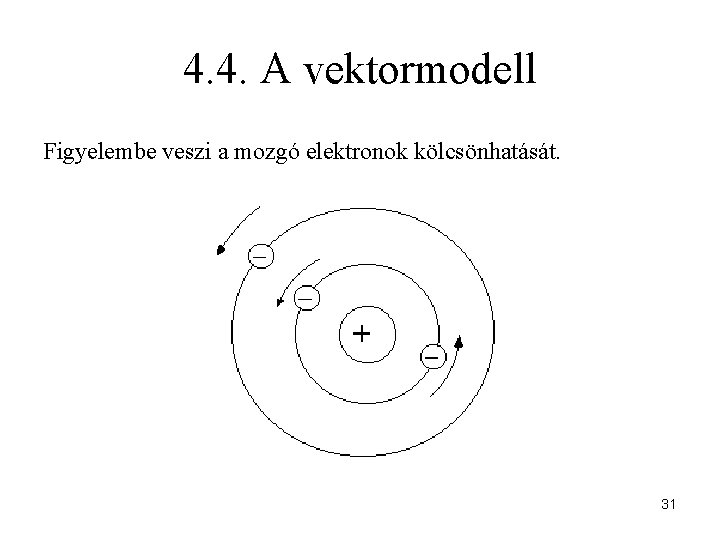
4. 4. A vektormodell Figyelembe veszi a mozgó elektronok kölcsönhatását. 31

Mire utal a vektormodell név? A H-atom elektronjának imp. momentuma A több elektronos atomban az el. -ok imp. momentumainak vektori összege adható meg: L a csoport-mellékkvantumszám 32

Eredmény: Egyes konfigurációkhoz egy állapot tartozik Más konfigurációkhoz több állapot, eltérő energiával 33

Az állapotokat jellemző kvantumszámok n fő kvantumszám és az ún. csoport-kvantumszámok L csoport mellékkvantumszám S csoport spinkvantumszám J csoport belső kvantumszám ML , MS, MJ csoport mágneses kvantumszámok 34

Az atomok energiája n-től nagyon, L-től, S-től közepesen, J-től kicsit függ. Mágneses térben ML , MS, MJ – től is függ. 35

Az állapotok szimbólumai Példa: 36

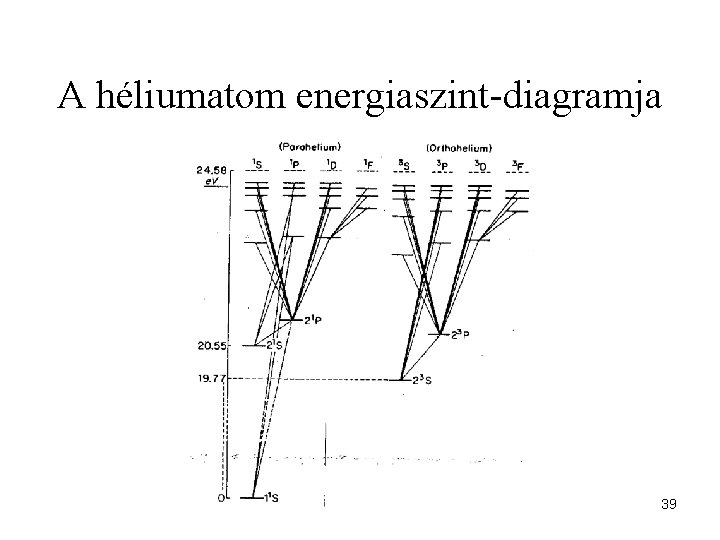
Példa: He-atom állapotai Konfiguráció Állapot 1 s 2 1 1 S 0 1 s 12 s 1 2 1 S 0 2 3 S 0 1 s 12 p 1 2 1 P 1 2 3 P 2 2 3 P 1 2 3 P 0 37

Az atomi színképekre vonatkozó kiválasztási szabályok tetszés szerint 38

A héliumatom energiaszint-diagramja 39

4. 6 Az atomi színképek mérése 40

Atomspektroszkópia Cél: az elemi összetétel meghatározása. Mintakészítés: magas hőmérsékletre hevítés. 41

A nap színképe 42

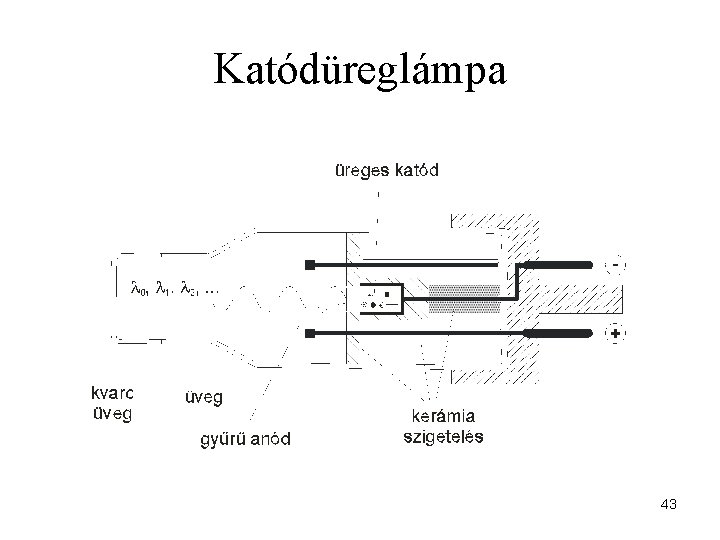
Katódüreglámpa 43

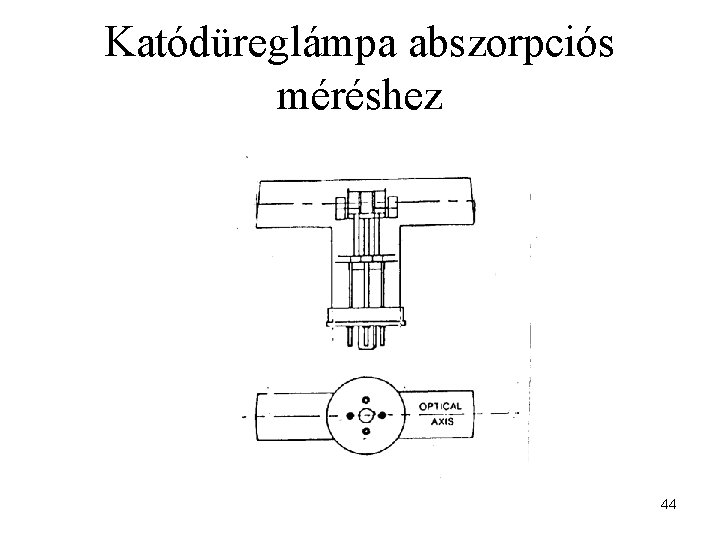
Katódüreglámpa abszorpciós méréshez 44

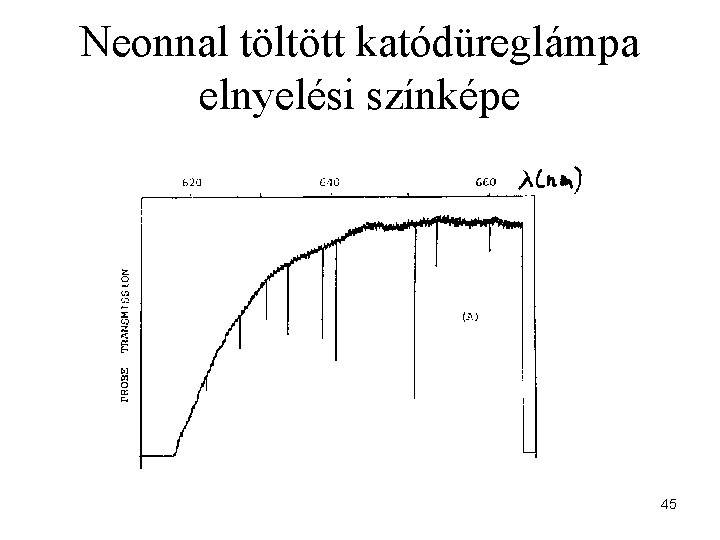
Neonnal töltött katódüreglámpa elnyelési színképe 45

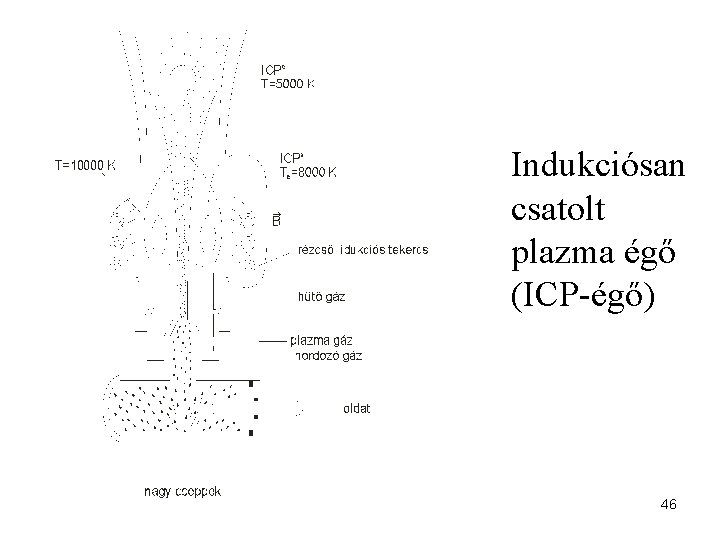
Indukciósan csatolt plazma égő (ICP-égő) 46

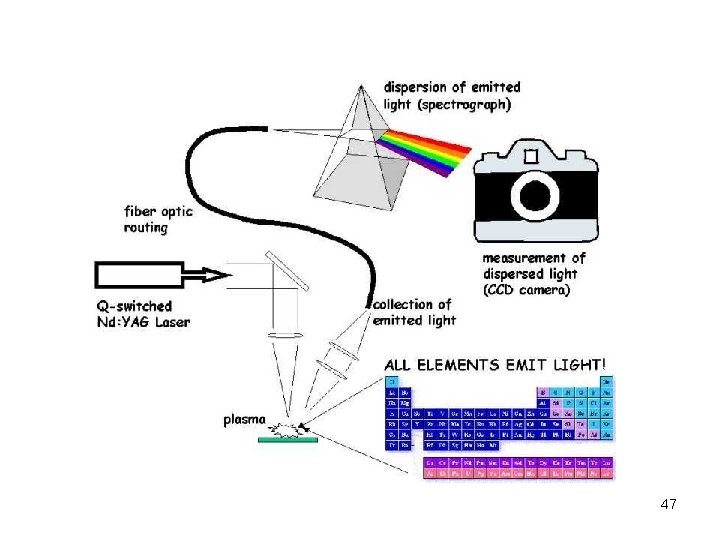
47

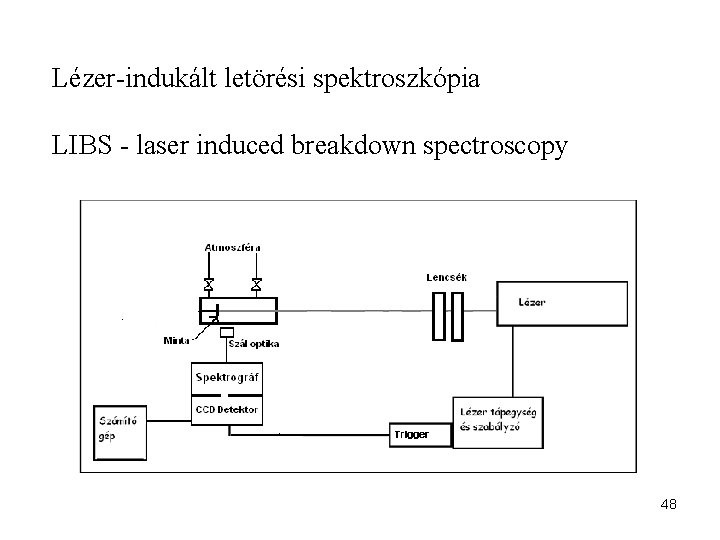
Lézer-indukált letörési spektroszkópia LIBS - laser induced breakdown spectroscopy 48

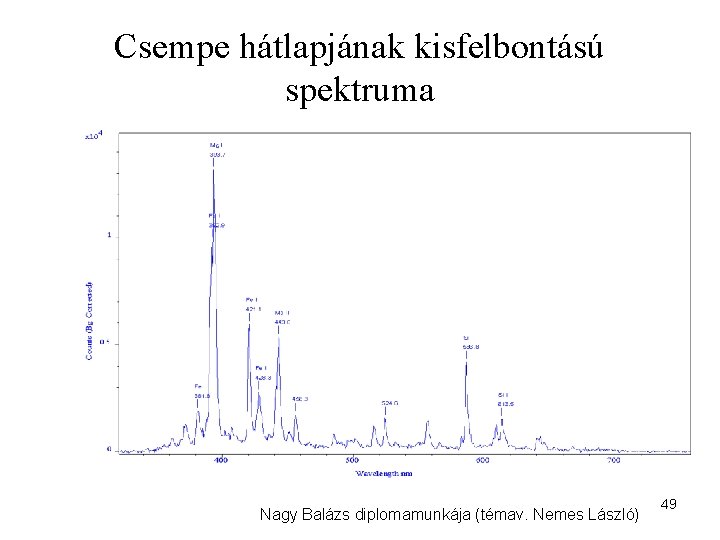
Csempe hátlapjának kisfelbontású spektruma Nagy Balázs diplomamunkája (témav. Nemes László) 49

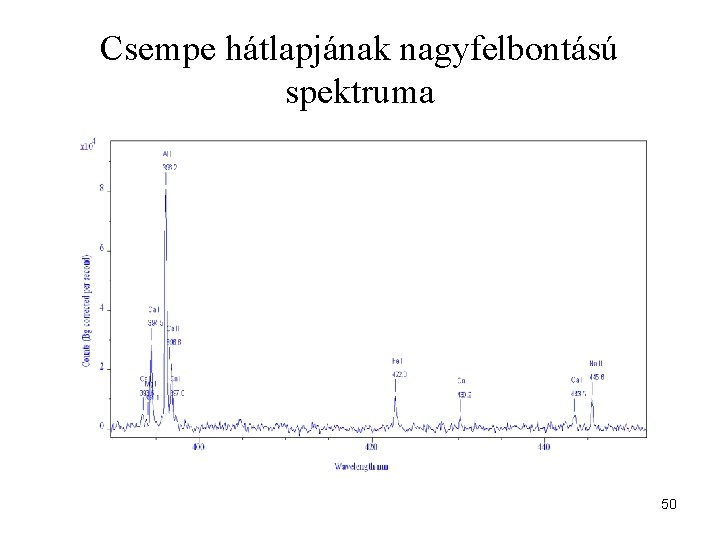
Csempe hátlapjának nagyfelbontású spektruma 50

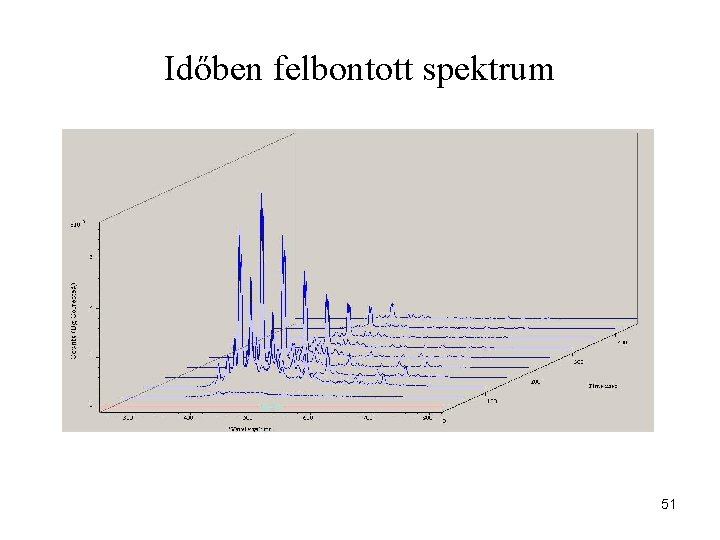
Időben felbontott spektrum 51