22 Ochrona przyrody i rodowiska Wpyw rolnictwa na





- Slides: 10

(2/2) Ochrona przyrody i środowiska Wpływ rolnictwa na emisję gazów cieplarnianych Wpływ freonów na warstwę ozonową Powstawanie dziury ozonowej

Wpływ rolnictwa na emisję gazów cieplarnianych v Gazy cieplarniane – substancje, których cząsteczki mają zdolność pochłaniania promieniowania elektromagnetycznego głównie z zakresie promieniowania widzialnego i podczerwieni v Ważniejsze gazy cieplarnianie emitowane do atmosfery: H 2 O(g); CO 2; O 3; CH 4; freony (halogenoalkany); tlenki azotu v Działalność rolnicza przyczyniająca się emisji gazów cieplarnianych: Ø Wycinanie i wypalanie lasów pod pola uprawne Ø Uprawa roślin (np. ryżu) na glebach podtopionych (warunki beztlenowe w glebie prowadzą do powstawanie metanu w trakcie rozkładu materii organicznej) Ø Duże fermy hodowlane (szczególne przeżuwacze – bydło, owce), produktem przemiany materii jest metan Ø Fermentacja beztlenowa odchodów (obornik, gnojowica) w fermach hodowlanych

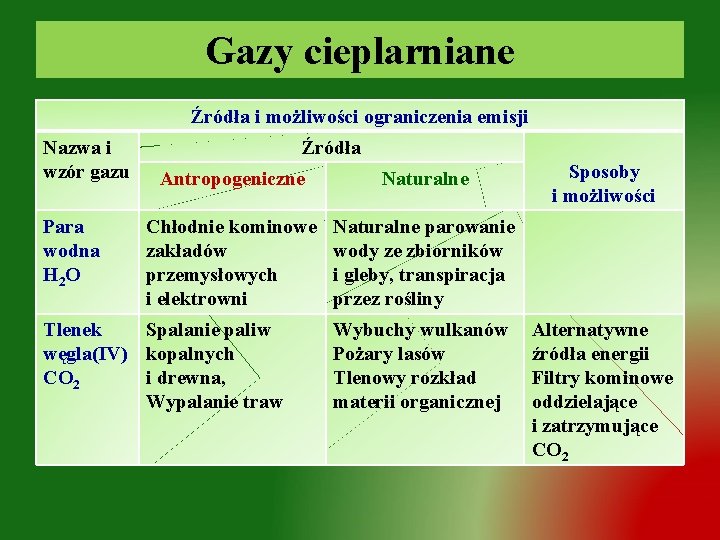
Gazy cieplarniane Źródła i możliwości ograniczenia emisji Nazwa i wzór gazu Para wodna H 2 O Źródła Antropogeniczne Naturalne Chłodnie kominowe zakładów przemysłowych i elektrowni Naturalne parowanie wody ze zbiorników i gleby, transpiracja przez rośliny Tlenek Spalanie paliw węgla(IV) kopalnych CO 2 i drewna, Wypalanie traw Wybuchy wulkanów Pożary lasów Tlenowy rozkład materii organicznej Sposoby i możliwości Alternatywne źródła energii Filtry kominowe oddzielające i zatrzymujące CO 2

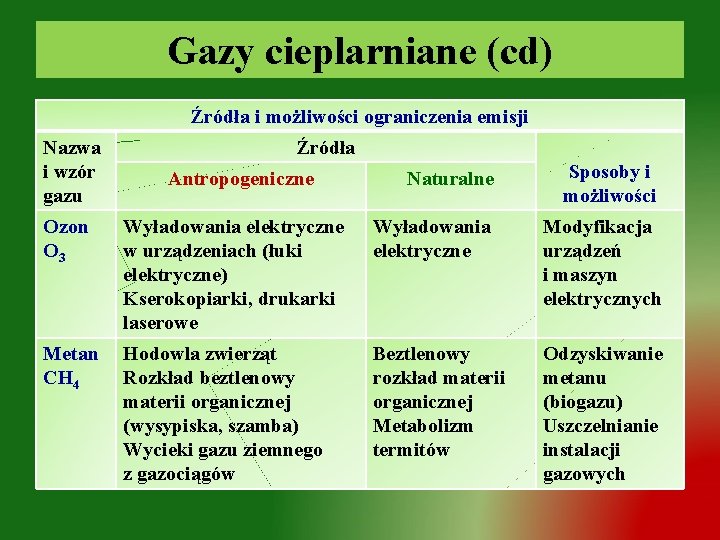
Gazy cieplarniane (cd) Źródła i możliwości ograniczenia emisji Nazwa i wzór gazu Źródła Antropogeniczne Naturalne Sposoby i możliwości Ozon O 3 Wyładowania elektryczne w urządzeniach (łuki elektryczne) Kserokopiarki, drukarki laserowe Wyładowania elektryczne Modyfikacja urządzeń i maszyn elektrycznych Metan CH 4 Hodowla zwierząt Rozkład beztlenowy materii organicznej (wysypiska, szamba) Wycieki gazu ziemnego z gazociągów Beztlenowy rozkład materii organicznej Metabolizm termitów Odzyskiwanie metanu (biogazu) Uszczelnianie instalacji gazowych

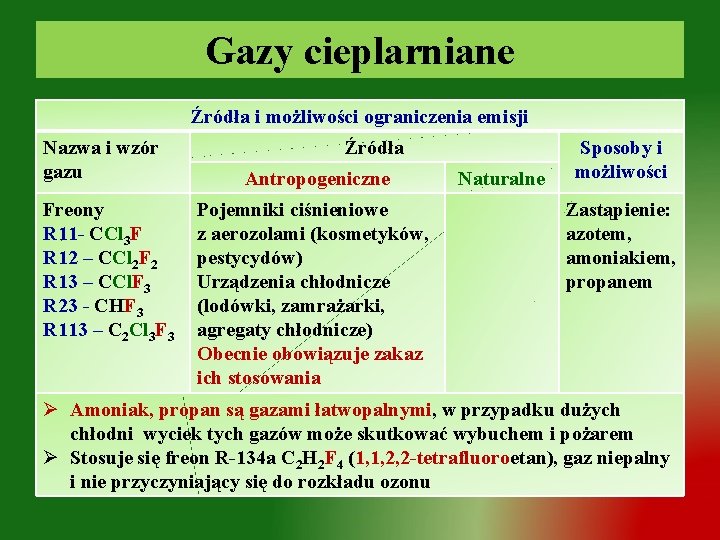
Gazy cieplarniane Źródła i możliwości ograniczenia emisji Nazwa i wzór gazu Freony R 11 - CCl 3 F R 12 – CCl 2 F 2 R 13 – CCl. F 3 R 23 - CHF 3 R 113 – C 2 Cl 3 F 3 Źródła Antropogeniczne Pojemniki ciśnieniowe z aerozolami (kosmetyków, pestycydów) Urządzenia chłodnicze (lodówki, zamrażarki, agregaty chłodnicze) Obecnie obowiązuje zakaz ich stosowania Naturalne Sposoby i możliwości Zastąpienie: azotem, amoniakiem, propanem Ø Amoniak, propan są gazami łatwopalnymi, w przypadku dużych chłodni wyciek tych gazów może skutkować wybuchem i pożarem Ø Stosuje się freon R-134 a C 2 H 2 F 4 (1, 1, 2, 2 -tetrafluoroetan), gaz niepalny i nie przyczyniający się do rozkładu ozonu

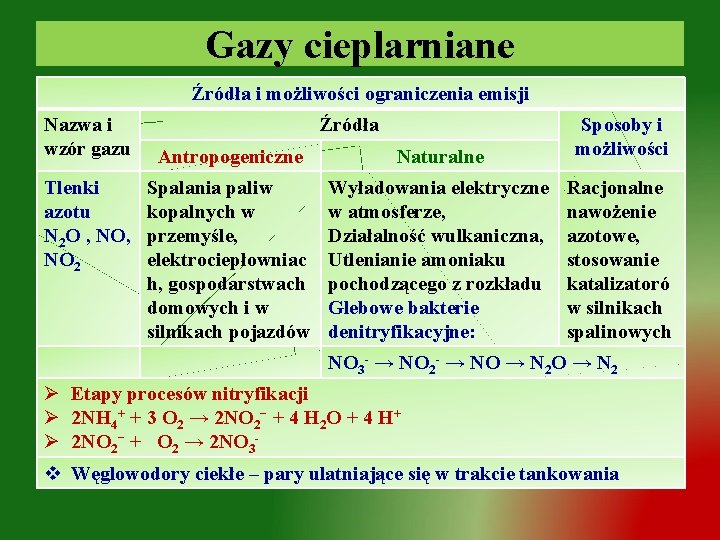
Gazy cieplarniane Źródła i możliwości ograniczenia emisji Nazwa i wzór gazu Tlenki azotu N 2 O , NO 2 Źródła Antropogeniczne Naturalne Sposoby i możliwości Spalania paliw kopalnych w przemyśle, elektrociepłowniac h, gospodarstwach domowych i w silnikach pojazdów Wyładowania elektryczne w atmosferze, Działalność wulkaniczna, Utlenianie amoniaku pochodzącego z rozkładu Glebowe bakterie denitryfikacyjne: Racjonalne nawożenie azotowe, stosowanie katalizatoró w silnikach spalinowych NO 3 - → NO 2 - → NO → N 2 Ø Etapy procesów nitryfikacji Ø 2 NH 4+ + 3 O 2 → 2 NO 2− + 4 H 2 O + 4 H+ Ø 2 NO 2− + O 2 → 2 NO 3 v Węglowodory ciekłe – pary ulatniające się w trakcie tankowania

Warstwa ozonowa – ozonosfera v Obecność ozonu (O 3 – alotropowa odmiana tlenu) w dolnych warstwach atmosfery jest szkodliwa dla organizmów żywych v Naturalna warstwa ozonu w górnych warstwach atmosfery (wys. 15 -50 km), to ozonosfera o stosunkowo stałym poziome O 3 pomimo, że jest on nietrwały i bardzo aktywny chemicznie Ø Ozon pochłania szkodliwe promieniowanie nadfioletowe (uv) v W górnej warstwie atmosfery ozon wchodzi w reakcje z freonami, halogenopochodnymi węglowodorów nasyconych (głównie metanu i etanu) v Freony – gazy lub lotne ciecze, niepalne i nietoksyczne, biernie chemiczne Ø stosowane jako nośniki innych w opakowaniach aerozolowych, środki spieniające tworzyw sztucznych, w agregatach chłodniczych Ø są bardzo trwałe, w dolnych warstwach atmosfery nie ulegają rozkładowi, w górnych warstwach pod wpływem promieniowania uv ulegają degradacji uwalniając rodniki chlorkowe lub fluorkowe

Skutki istnienia dziury ozonowej Większe dawki promieniowania ultrafioletowego Ø choroby oczu, osłabienie odporności na zarażenie chorobami wirusowymi Ø zwiększenie zachorowań na nowotwory Ø przyspieszenie procesu starzenia się skóry Ø zakłócenie działania systemu odpornościowego człowieka Ø synteza witaminy D 3 Ø skuteczne w leczeniu łuszczycy Wzrost temperatury Ziemi Ø zmiana klimatu: wzmożone parowanie, wzrost powierzchni obszarów suchych Niszczenie chlorofilu Ø zmniejszenie ilości roślin na lądzie Niszczenie planktonu Ø przerwanie łańcucha pokarmowego Osłabienie układu odpornościowego zwierząt Ø wzrost zachorowań i śmiertelności zwierząt dziko żyjących i hodowlanych Oddziaływanie na atmosferę Ø powstanie smogu fotochemicznego w miastach

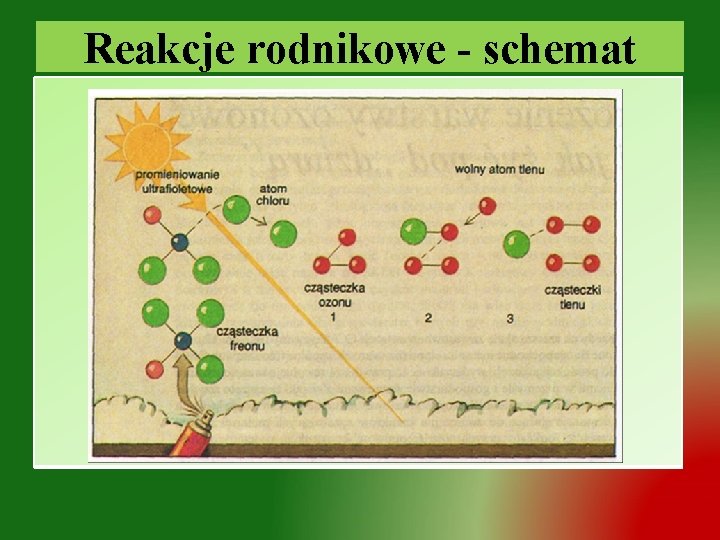
Reakcje rodnikowe v. Rodniki (wolny rodnik) – atom lub grupa atomów zawierający wolny – niesparowany elektron v. Rodniki, szczególnie organiczne są najczęściej nietrwałe, ponieważ niesparowany elektron jest bardzo aktywny v Freon R 12 – CCl 2 F 2 (dichlorodifluorometan) ●CCl. F ●Cl Ø CCl 2 F 2 + 2 rodniki: chlorodifluorometanowy + chlorkowy Ø ●Cl + O ●OCl + O 3 2 Ø ●OCl + O 2 O + ●Cl 3 2 Ø 2●OCl Cl 2 + O 2 Ø 2●Cl Cl 2 Ø Cl 2 + O 3 ●OCl + ●Cl + O 2

Reakcje rodnikowe - schemat

















