Vpoty spaovacch procesov Chemick zloenie palv Zloenie tuhch









































































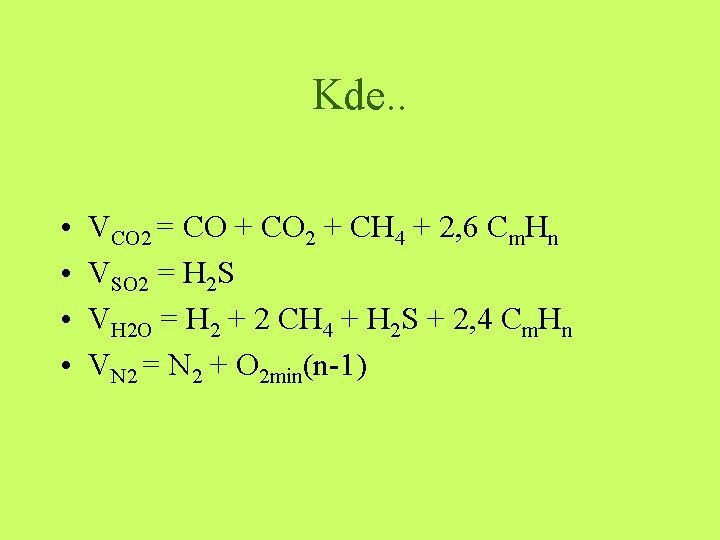



- Slides: 87

Výpočty spaľovacích procesov

Chemické zloženie palív Zloženie tuhých a kvapalných palív Zloženie plynných palív

Zloženie tuhých a kvapalných palív (odpadov)

• nepresné určovanie organických zlúčenín, tvoriacich horľavinu (zlúčenín C, H, O, N. S) • elementárna analýza (percentuálny podiel hmotností prvkov v horľavine) • nehorľavé látky – obsah popola (A) a vody (W) sa určia spálením resp. sušením • C + H + O + N+ Scelk + A + W = 100%

Imediátna technická analýza • okrem stanovenia obsahu vlhkosti a popola stanoví aj prchavé zložky( • prchavé zložky – látky, ktoré vyprchajú pri zahrievaní z téglika bez prístupu vzduchu pri teplote 850 °C (okrem vody) • PZ + V + A + W = 100% (PZ – pevný zvyšok v tégliku, V-prchavá horľavina, A- obsah popola, W - obsah vody)

Horľavina • Je podiel paliva po odčítaní nehorľavých látok (popol a voda) • Skladá sa z C, H, O, H, Sprch

Uhlík - C • Qn = 33 900 k. Jkg-1 • hlavný nositeľ tepelnej energie • nachádza sa vo forme organických zlúčenín

Vodík - H • Qn = 119 700 k. Jkg-1 • celkový vodík – skladá sa z vodíka viazaného a neviazaného HC = HV + HN – viazaný vodík – HV – viazaný na kyslík – neviazaný vodík –HN – zvýši po zlúčení s celým obsahom kyslíka HN =H-O/8

Síra - S • je nežiadúca – zvyšuje výhrevnosť • produkty horenia síry - SO 2 a SO 3 • kratšia trvanlivosť spaľovacích zariadení • znečistenie ovzdušia

Kyslík - O • Nežiadúca súčasť • Viaže sa na H a C

Dusík - N • nezúčastňuje sa na reakcii horenia • podieľa sa na tvorbe NOX • znižuje obsah iných zložiek • znižuje výhrevnosť

Zloženie plynných palív (odpadových plynov) • horľavé plyny – H 2, CO, metán, H 2 S a nenasýtené uhľovodíky • nehorľavé plyny – N 2, CO 2, H 2 O, SO 2

Spalné teplo a výhrevnosť palív (horľavých odpadov) • spaliny – produkty spaľovania (vznikli zlúčením paliva a kyslíka) • spalné teplo - Qv – množstvo tepla, ktoré sa uvoľní pri dokonalom spaľovaní, za predpokladu, že sa spaliny ochladia na 0°C a všetka vzniknutá para sa skondenzuje • výhrevnosť paliva - Qn – množstvo tepla uvoľnené pri dokonalom spaľovaní mernej jednotky paliva pri ochladení na 0°C, vlhkosť zostane v spalinách ako vodná para Qn = Qv – 2500 m. H 2 O k. Jkg-1 (Qn- výhrevnosť paliva, Qv – spalné teplo, m. H 2 O- množstvo vodnej pary)

Tuhé a kvapalné palivá • tuhé palivá Qv = 339 C + 1440 (H-1/8 O) + 105 S Qv = 339 C + 1214 (H-1/8 O) +105 S – 25 W • kvapalné palivá (Mendelejevova rovnica) Qv = 339 C + 1256 H + 109 (O-S) Qv = 339 C + 1030 H + 109 (O-S) – 25 W C, H, O, S, W sú hmotnostné percentá uhlíka, vodíka, kyslína, síry a vlhkosti v palive (odpade) %

Plynné palivá • Spalné teplo a výhrevnosť plynných palív sa počíta ako súčet spalných tepiel a výhrevnosti jednotlivých plynov QV = V 1 Qv, 1+V 2 Qv, 2+. . . + Vn. Qv, n Qn = V 1 Qn, 1+V 2 Qn, 2+. . . + Vn. Qn, n kde V 1 až Vn je objem jednotlivých plynov v 1 m. N-3

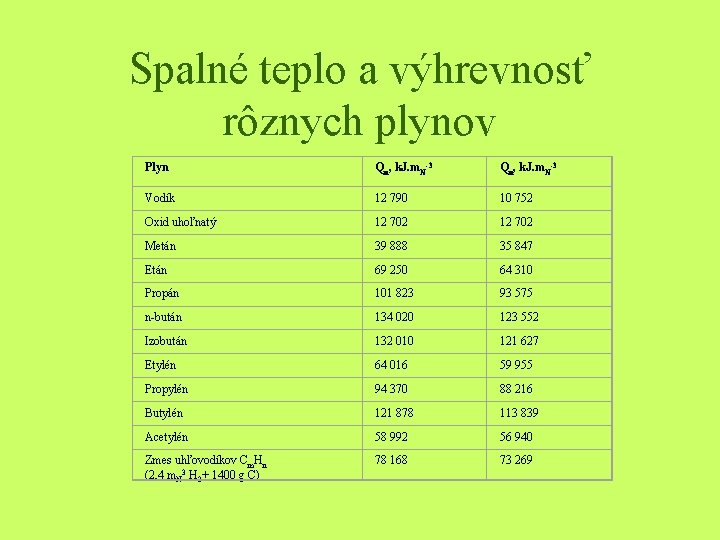
Spalné teplo a výhrevnosť rôznych plynov Plyn Qn, k. J. m. N-3 Vodík 12 790 10 752 Oxid uhoľnatý 12 702 Metán 39 888 35 847 Etán 69 250 64 310 Propán 101 823 93 575 n-bután 134 020 123 552 Izobután 132 010 121 627 Etylén 64 016 59 955 Propylén 94 370 88 216 Butylén 121 878 113 839 Acetylén 58 992 56 940 Zmes uhľovodíkov Cm. Hn (2, 4 m. N 3 H 2+ 1400 g C) 78 168 73 269

Spaľovanie palív (odpadov) • zahrievanie za prítomnosti vzduchu – spaľovanie • zahrievanie za obmedzeného prístupu vzduchu – splyňovanie • zahrievanie bez prístupu vzduchu - pyrolýza

Podmienky spaľovania Spaľovanie prebieha len ak sú splnené dve základné podmienky: • palivo (odpad) musí byť v styku s okysličovadlom • zmes paliva a okysličovadla musí byť zahriata na zápalnú teplotu

Rozmedzie vznietenia • Dolné – najmenší podiel paliva v objemových percentách zmesi • Horné - najväčší podiel paliva v objemových percentách zmesi

Zápalná teplota • je teplota, pri ktorej prebieha horenie paliva bez prívodu tepla z vonkajšieho prostredia • je teplota, pri ktorej rýchlosť oxidačnej reakcie je taká vysoká, že teplo, ktoré sa pri nej uvoľní je väčšie ako teplo odovzdané do okolia

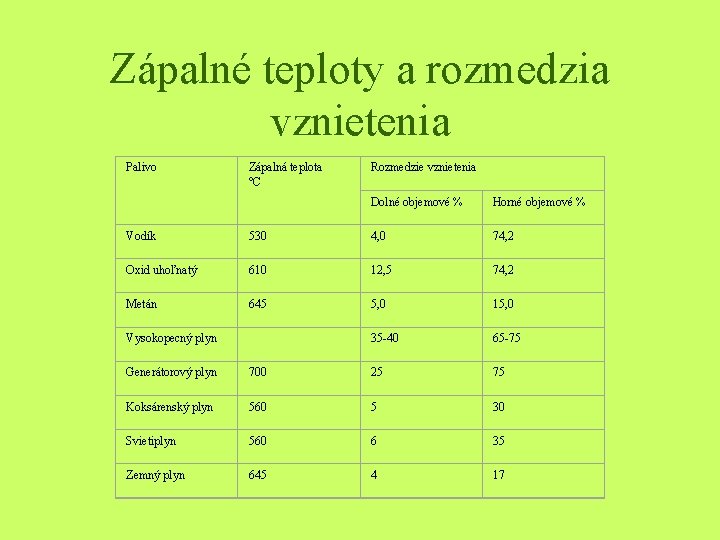
Zápalné teploty a rozmedzia vznietenia Palivo Zápalná teplota °C Rozmedzie vznietenia Dolné objemové % Horné objemové % Vodík 530 4, 0 74, 2 Oxid uhoľnatý 610 12, 5 74, 2 Metán 645 5, 0 15, 0 Vysokopecný plyn 35 -40 65 -75 Generátorový plyn 700 25 75 Koksárenský plyn 560 5 30 Svietiplyn 560 6 35 Zemný plyn 645 4 17

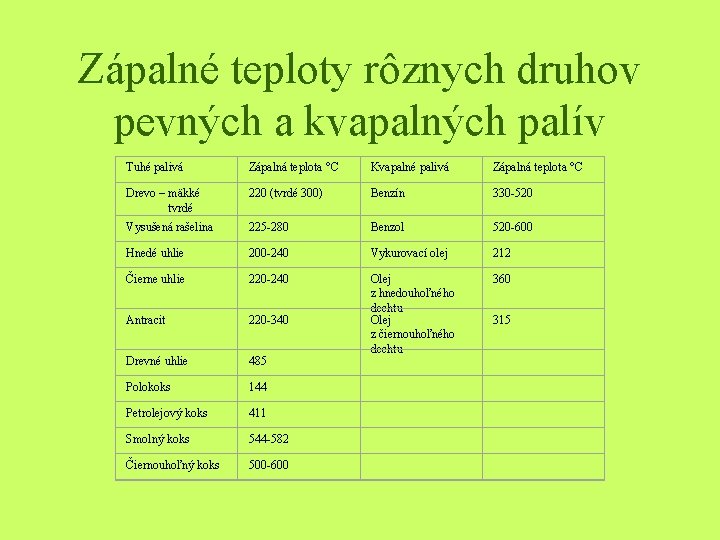
Zápalné teploty rôznych druhov pevných a kvapalných palív Tuhé palivá Zápalná teplota °C Kvapalné palivá Zápalná teplota °C Drevo – mäkké tvrdé 220 (tvrdé 300) Benzín 330 -520 Vysušená rašelina 225 -280 Benzol 520 -600 Hnedé uhlie 200 -240 Vykurovací olej 212 Čierne uhlie 220 -240 360 Antracit 220 -340 Drevné uhlie 485 Olej z hnedouhoľného dechtu Olej z čiernouhoľného dechtu Polokoks 144 Petrolejový koks 411 Smolný koks 544 -582 Čiernouhoľný koks 500 -600 315

Horenie plynných palív • prebieha vo veľmi tenkej vrstve, ktorá oddeľuje palivá a spaľovaný vzduch • prebiehajú tu chemické reakcie horenia • oblasť sa nazýva front horenia • teplo uvoľnené horením palivá predhrieva a zapaľuje

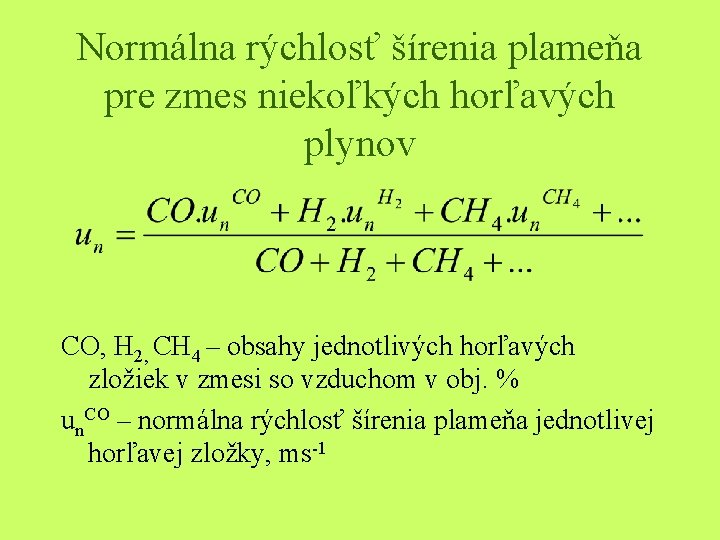
Normálna rýchlosť šírenia plameňa - un • Ak je rúrke nehybná zmes paliva a spaľovaného vzduchu potom sa front horenia bude premiestňovať v smere kolmom na povrch frontu • Táto rýchlosť s nazýva normálnou rýchlosťou šírenia plameňa • Ak je pre danú zmes na jednotku povrchu frontu horenia zhorí za jednu s rovnaké množstvo paliva m, tak pri posunutí rovinného frontu horenia je normálna rýchlosť šírenia plameňa daná vzťahom un = m/ρ (ms-1) m – rýchlosť horenia kgm-2 s-1, ρ – merná hmotnosť pôvodného chladného plynu kgm-3

Normálna rýchlosť šírenia plameňa pre zmes niekoľkých horľavých plynov CO, H 2, CH 4 – obsahy jednotlivých horľavých zložiek v zmesi so vzduchom v obj. % un. CO – normálna rýchlosť šírenia plameňa jednotlivej horľavej zložky, ms-1

Normálna rýchlosť šírenia plameňa závisí: • koncentrácie horľavej látky • tlaku • teploty

Horenie kvapalných palív • kvapalné palivá sa nespaľujú priamo, ale po rozprášení • pre rozprášenie kvapalného paliva sa používa: - samotné palivo pri vysokom tlaku - ventilátorový vzduch - predhriaty stlačený vzduch alebo vysokotlaká para

Horenie tuhého paliva • tuhé palivo sa pred vlastným spaľovaním najprv zahrieva • nastane termický rozklad organickej hmoty paliva • dva spôsoby: • horenie tuhého paliva vo vrstve • horenie tuhého paliva v prášku

Stechiometria spaľovacích procesov Stanovuje sa : • výhrevnosť paliva (odpadu) • množstvo O (vzduchu) potrebného k dokonalému spaľovaniu paliva (odpadu) • množstvo a zloženie spalín • adiabatická, teoretická a praktická spalná teplota

Výpočty spotreby vzduchu a množstva spalín • Dokonalé spaľovanie • Nedokonalé spaľovanie • Zmiešané spaľovanie

Dokonalé spaľovanie • Nastane spálenie všetkých horľavých zložiek v palive • C + O 2 = C O 2 • Dokonale spaľovanie s teoretickým prebytkom vzduchu (Lmin), ktoré sa dá vypočítať zo stechiometrických vzťahov spaľovacích rovníc je možné dosiahnuť len pri dokonalom premiešaní a pri ideálnych podmienkach • V skutočnosti – prebytok vzduchu

Súčiniteľ prebytku vzduchu • Pomer medzi skutočnou a teoretickou spotrebou vzduchu

Hodnoty súčiniteľa prebytku vzduchu n pre rôzne palivá Druh paliva n Kusové uhlie 1, 5 -2, 0 Tuhý odpad 1, 6 -2, 5 Práškové hnedé uhlie 1, 15 -1, 30 Práškové čierne uhlie 1, 15 -1, 30 Vykurovací olej 1, 1 -1, 3 Koksárenský plyn 1, 05 -1, 1 Zemný plyn 1, 05 -1, 1 Vysokopecný plyn 1, 15 -1, 20

Nedokonalé spaľovanie • V spalinách sa nachádza určité množstvo spaľovaných látok • C+1/2 O 2=CO • n� 1 • n≥ 1 pri nedokonalom zmiešaní paliva s oxidačným činidlom

Zmiešané spaľovanie • ak spaliny obsahujú CO 2 aj CO

Spôsoby výpočtov spotreby vzduchu a množstva spalín • Podľa údajov elementárnej analýzy pomocou stechiometrických rovníc (analytický spôsob) • Pomocou približných vzorcov, odlišných pre rôzne druhy paliva (na základe výhrevnosti) • Grafickými metódami

Stechiometrické výpočty • Predpokladá sa dokonalé spaľovanie • Výpočet sa zjednodušuje zaokrúhlením molekulových hmotností a objemov • Ako okysličovadlo sa používa suchý vzduch

Zjednodušené zloženie suchého vzduchu • objemovo • (21% O 2, 79% N 2) • Hmotnostne • 23, 1% O 2, 76, 9%N 2

Spalná teplota • Charakterizuje palivo vzhľadom k jeho technologickému použitiu • Stanovuje sa z rovnice tepelnej rovnováhy Qch+Qp+Qvz= Qsp+Qned+Qdis +Qz (k. Jkg-1)

Príjem tepla Qch+Qp+Qvz= Qsp+Qned+Qdis +Qz (k. Jkg-1) • Príjem tepla: (Qch-chemické teplo, ktoré je určené výhrevnosťou paliva Qpenatetalpia predhriateho paliva) Qp=cptp Qvz- entalpia predhriateho vzduchu Qvz= cvz tvzn. Lmin

Výdaj tepla • Qch+Qp+Qvz= Qsp+Qned+Qdis +Qz (k. Jkg-1) • Qsp- entalpia spalín Qsp= Vsp csp tsp Qned – chemický a mechanický nedopal Qdis – disociačné teplo Qz- teplo odvedené do konštrukcie pece a do okolia

Výpočet teploty spalín , ktorá charakterizuje spalnú teplotu paliva • Tsp = Qch+ Qp+ Qvz-Qned-Qdis-Qz/Vsp. csp

Základné druhy spalných teplôt • Adiabatická • Teoretická • Praktická

Adiabatická spalná teplota ta ta = Qn /Vsp, mincsp

Teoretická spalná teplota tt tt=Qn+ Qp+ Qvz/ Vsp. csp

Praktická spalná teplota tp • tp= Qch+ Qp+ Qvz- Qned- Qdis- Qz/ Vsp. Csp • Prepočet cez pyrometrický efekt Tp= tt. „ný“pyr

Cvičenie č. : 2

Výpočty spotreby vzduchu a množstva spalín Dva spôsoby: • analytický spôsob - podľa údajov elementárnej analýzy pomocou stechiometrických rovníc • pomocou približných vzorcov, odlišných pre rôzne druhy palív – na základe výhrevnosti • grafickými metódami

Spaľovanie odpadov • používa sa analytický spôsob • predpokladá sa dokonalé spaľovanie • výpočet sa zjednodušuje zaokrúhlením molekulových hmotností a molekulových objemov • ako okysličovadlo sa používa suchý vzduch

Objemové zloženie suchého vzduchu • 21% O 2, 79% N 2 • pomer kyslíka, dusíka a vzduchu • O 2: N 2: vzduch = 21/21: 79/21: 100/21 = 1: 3, 76: 4, 76

Hmotnostné zloženie suchého vzduchu • 23, 1% O 2, 76, 9% N 2 • pomer kyslíka, dusíka a vzduchu • O 2: N 2: vzduch = 23, 1/23, 1: 79, 6/23, 1: 100/23, 1 = 1: 3, 33: 4, 33

Poznámka Pri praktických stechiometrických výpočtoch zanedbáva vlhkosť vzduchu a tak môžu vznikať chyby 1 až 2%.

Spaľovanie tuhých a kvapalných odpadov • výpočet – hmotnostný alebo objemový, výnimočne molárny • spaľovanie plynných palív – zloženie je udávané v objemových % sa používa spaľovanie objemové

Označenie vo výpočtoch Omin – teoretické množstvo kyslíka pre dokonalé spaľovanie, m 3 N, kg Lmin – teoretické množstvo vzduchu pre dokonalé spaľovanie, m 3 N, kg Lskut - skutočné mnžstvo vzduchu pre dokonalé spaľovanie, m 3 N, kg n -súčiniteľ prebytku vzduchu VVsp, m. Vsp - objemové a hmotnostné množstvo vlhkých spalín, m 3 N, kg VSsp, m. Ssp - objemové a hmotnostné množstvo suchých spalín, m 3 N, kg VSsp, min – množstvo suchých spalín pri spaľovaní s teoretickým množstvom vzduchu, m 3 N, kg VCO, m. CO - objem a hmotnosť CO (po prípade ostatných zložiek), m 3 N, kg C, H 2 - množstvo uhlíka, vodíka, . . . v 1 m 3 alebo 1 kg paliva, m 3 N, kg W- vlhkosť (voda), m 3 N, kg

Spaľovanie tuhých a kvapalných odpadov Použitím molekulových hmotností jednotlivých prvkov je možné vyjadriť vzťahy pre oxidačné rekcie pri spaľovaní rovnicami

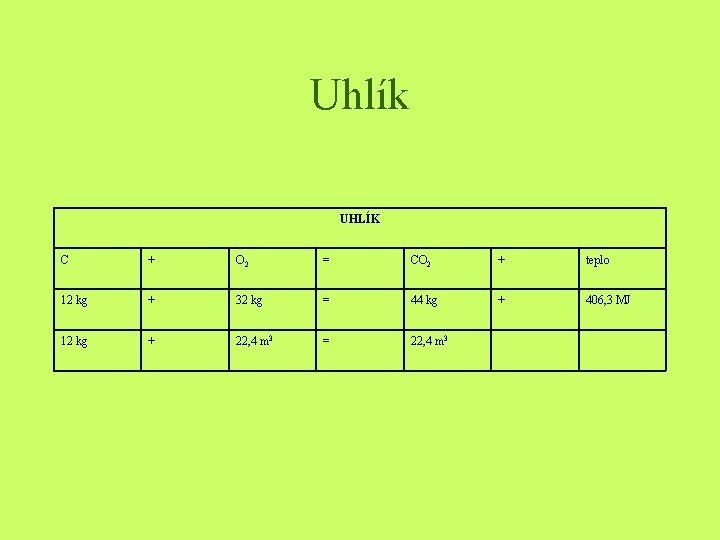
Uhlík UHLÍK C + O 2 = CO 2 + teplo 12 kg + 32 kg = 44 kg + 406, 3 MJ 12 kg + 22, 4 m 3 = 22, 4 m 3

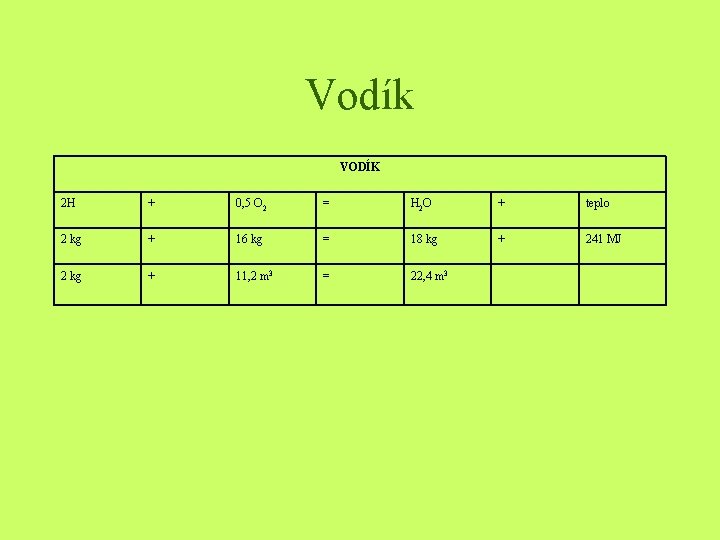
Vodík VODÍK 2 H + 0, 5 O 2 = H 2 O + teplo 2 kg + 16 kg = 18 kg + 241 MJ 2 kg + 11, 2 m 3 = 22, 4 m 3

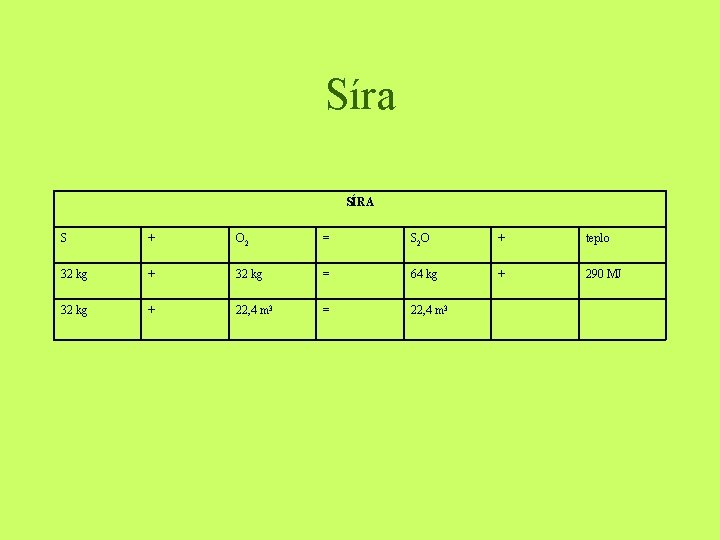
Síra SÍRA S + O 2 = S 2 O + teplo 32 kg + 32 kg = 64 kg + 290 MJ 32 kg + 22, 4 m 3 = 22, 4 m 3

Ostatné prvky a vlhkosť (voda) • 2 N = N 2 • 28 kg = 28 kg • 28 kg = 22, 4 m 3 • 2 O = O 2 • 32 kg = 32 kg • 32 kg = 22, 4 m 3 • H 20 kvap=H 2 Opara • 18 kg = 18 kg • 18 kg = 22, 4 m 3

Poznámka Výpočty spaľovania vychádzajú z molekulovej hmotnosti jednotlivých prvkov, ktoré sa udávajú v kilogramoch. Podľa Avogadra 1 mol akejkoľvek plynnej látky pri normálnych podmienkach (0°C, 101, 325 k. Pa) objem 22, 4 m 3

Výpočty hmotnostného spaľovania

• • • Omin = 2, 67 C + 8 H + S – O Lmin = Omin. 4, 33 Lskut = Omin. 4, 33. n mspv = m. CO 2+ m. SO 2+ m. H 2 O+ m. N 2+ m. O 2 msp. S = m. CO 2+ m. SO 2+ m. N 2+ m. O 2 m. CO 2=3, 67. C m. SO 2= 2. S m. H 2 O= 9 H + W m. N 2= N + Omin. 3, 33. n m. O 2 = Omin (n-1)

Vyjadrenie jednotlivých zložiek spalín • • • CO 2 = (m. CO 2 /msp. V). 100 H 2 O = (m. H 2 O /msp. V). 100 SO 2 = (m. SO 2 /msp. V). 100 N 2 = (m. N 2 /msp. V). 100 O 2 = (m. O 2 /msp. V). 100

Výpočty objemového spaľovania

• • • Omin = 1, 87 C + 5, 6 H + 0, 7 S – 0, 7 O Lmin = Omin. 4, 76 Lskut = Omin. 4, 76. n Vspv = m. VCO 2+ VSO 2+ VH 2 O+ VN 2+ VO 2 Vsp. S = VCO 2+ VSO 2+ VN 2+ VO 2 m. CO 2=1, 87. C m. SO 2= O, 7. S m. H 2 O= 11, 2 H + 1, 24 W m. N 2= 0, 8 N + Omin. 3, 76. n

Vyjadrenie jednotlivých zložiek spalín • • • CO 2 = (VCO 2 /Vsp. V). 100 H 2 O = (VH 2 O /Vsp. V). 100 SO 2 = (VSO 2 /Vsp. V). 100 N 2 = (VN 2 /Vsp. V). 100 O 2 = (VO 2 /Vsp. V). 100

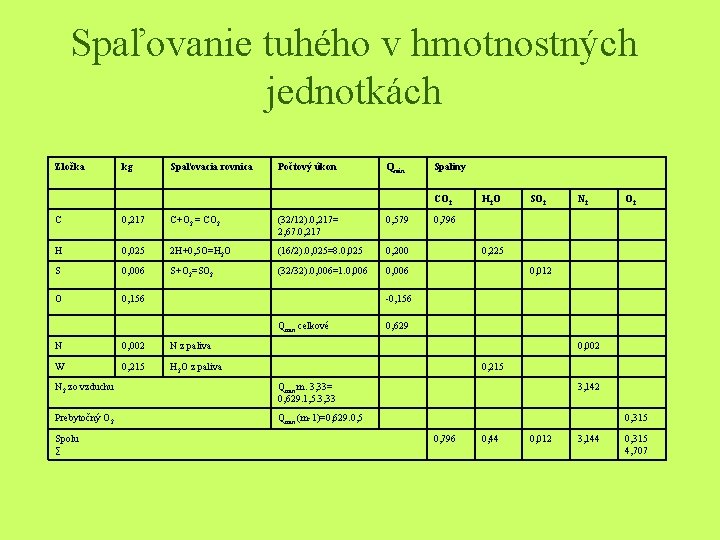
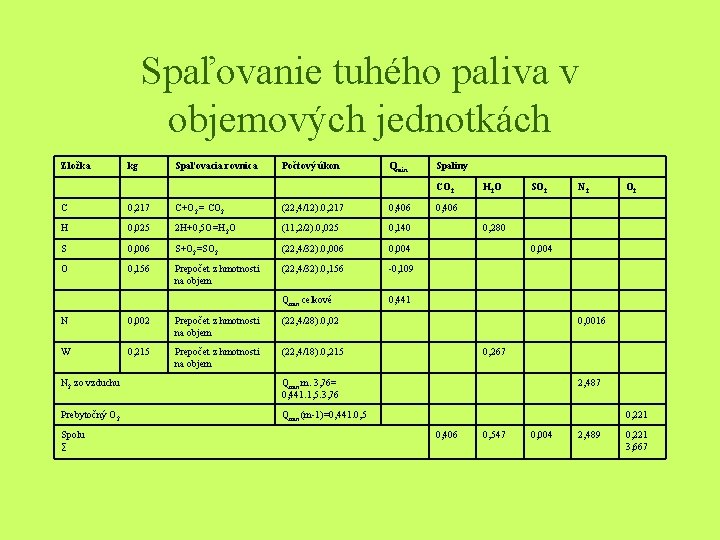
Príklad • Určite množstvo spaľovacieho vzduchu a množstvo vlhkých spalín, ak sa spaľuje tuhý komunálny odpad so zložením: C 21, 7 %, H 2, 5%, O 15, 6%, S 0, 6%, H 2 O 21, 5%, N 0, 2% a zvyšok je popol. Spaľuje sa s 50% prebytkom vzduchu. Pre výpočet použite hmotnostné i objemové spaľovanie.

Riešenie • Kvôli prehľadnosti je výpočet spaľovania uvedený v tabuľke. Počtový úkon sa vzťahuje k výpočtu Omin. Hmotnosť zložiek spalín sa určí pri hmotnostnom spaľovaní zo súčtu hmotností spaľovanej zložky a hmotnosti kyslíka, potrebného pri spaľovaní

Množstvo vlhkých spalín • VVsp= 0, 765 + 0, 44 + 0, 012 + 3, 144 + 0, 315 = 4, 707 kg. kg-1

Množstvo spaľovacieho vzduchu • použujeme vzťah Lskut = Omin. 4, 33. n kgkg_1 L _1 = 0, 629+1, 5+4, 33=4, 085 kgkg skut

Spaľovanie tuhého v hmotnostných jednotkách Zložka kg Spaľovacia rovnica Počtový úkon Qmin Spaliny CO 2 C 0, 217 C+O 2 = CO 2 (32/12). 0, 217= 2, 67. 0, 217 0, 579 H 0, 025 2 H+0, 5 O=H 2 O (16/2). 0, 025=8. 0, 025 0, 200 S 0, 006 S+O 2=SO 2 (32/32). 0, 006=1. 0, 006 O 0, 156 SO 2 N 2 O 2 0, 796 0, 225 0, 012 -0, 156 Qmin celkové N 0, 002 N z paliva W 0, 215 H 2 O z paliva 0, 629 0, 002 0, 215 N 2 zo vzduchu Qmin. m. 3, 33= 0, 629. 1, 5. 3, 33 Prebytočný O 2 Qmin. (m-1)=0, 629. 0, 5 Spolu ∑ H 2 O 3, 142 0, 315 0, 796 0, 44 0, 012 3, 144 0, 315 4, 707

Spaľovanie tuhého paliva v objemových jednotkách Zložka kg Spaľovacia rovnica Počtový úkon Qmin Spaliny CO 2 C 0, 217 C+O 2 = CO 2 (22, 4/12). 0, 217 0, 406 H 0, 025 2 H+0, 5 O=H 2 O (11, 2/2). 0, 025 0, 140 S 0, 006 S+O 2=SO 2 (22, 4/32). 0, 006 0, 004 O 0, 156 Prepočet z hmotnosti na objem (22, 4/32). 0, 156 -0, 109 Qmin celkové 0, 441 N 0, 002 Prepočet z hmotnosti na objem (22, 4/28). 0, 02 W 0, 215 Prepočet z hmotnosti na objem (22, 4/18). 0, 215 N 2 zo vzduchu Qmin. m. 3, 76= 0, 441. 1, 5. 3, 76 Prebytočný O 2 Qmin. (m-1)=0, 441. 0, 5 Spolu ∑ H 2 O SO 2 N 2 O 2 0, 406 0, 280 0, 004 0, 0016 0, 267 2, 487 0, 221 0, 406 0, 547 0, 004 2, 489 0, 221 3, 667

Zloženie vlhkých spalín (% hmotn. ) • vychádzame zo vzťahov: CO 2 = (m. CO 2 /msp. V). 100 H 2 O = (m. H 2 O /msp. V). 100 SO 2 = (m. SO 2 /msp. V). 100 N 2 = (m. N 2 /msp. V). 100 O 2 = (m. O 2 /msp. V). 100 • CO 2 = (0, 012/4, 707)100 = = 16, 91% • SO 2 = (0, 012/4, 707)100 = = 0, 25% • O 2 = (0, 35/4, 707)100=6, 69% • H 2 O = (0, 44/4, 707)100 = 9, 35% • N 2 = (3, 144/4, 707). 100 = 66, 8%

K spáleniu 1 kg uvedeného odpadu je treba Lsk = Qminm. 4, 76 = 0, 441. 1, 5. 4, 76 = 3, 149 m 3 N vzduchu a pri tom vznikne 3, 667 m 3 N spalín.

Spaľovanie plynných palív • zloženie plynných palív sa udáva v objemových percentách • preto sa u tohto druhu uvažuje len v objemových percentách

Základné rovnice objemového spaľovania

Oxid uhoľnatý • CO + 0, 5 O 2 = CO 2 + teplo • 1 m 3 + 0, 5 m 3 = 1 m 3 + 12, 64 MJ

Vodík • H 2 + 0, 5 O 2 = H 2 O + teplo • 1 m 3 + 0, 5 m 3 = 1 m 3 + 10, 76 MJ

Sírovodík (sulfán) • H 2 S + 1, 5 O 2 = SO 2 + H 2 O + teplo • 1 m 3 + 1, 5 m 3 = 1 m 3 + 23, 7 MJ

Metán • CH 4 + 2 O 2 = CO 2 + 2 H 2 O + teplo • 1 m 3 + 2 m 3 = 1 m 3 + 2 m 3 + 35, 8 MJ

Uhľovodíky • Cm. Hn + 3, 8 O 2 = 2, 6 CO 2 + 2, 4 H 2 O + teplo • 1 m 3 + 3, 8 m 3 = 2, 6 m 3 + 2, 4 m 3 + 73, 27 MJ

Výpočet • • • Omin = 0, 5 CO+0, 5 H 2+1, 5 H 2 S+2 CH 4+3, 8 Cm. Hn Lmin = Omin 4, 76 Lskut = Omin 4, 76 n Vsp. V = VCO 2+VSO 2+VH 20+VN 2+VO 2 Vsp. S = VCO 2+VSO 2+VN 2+VO 2
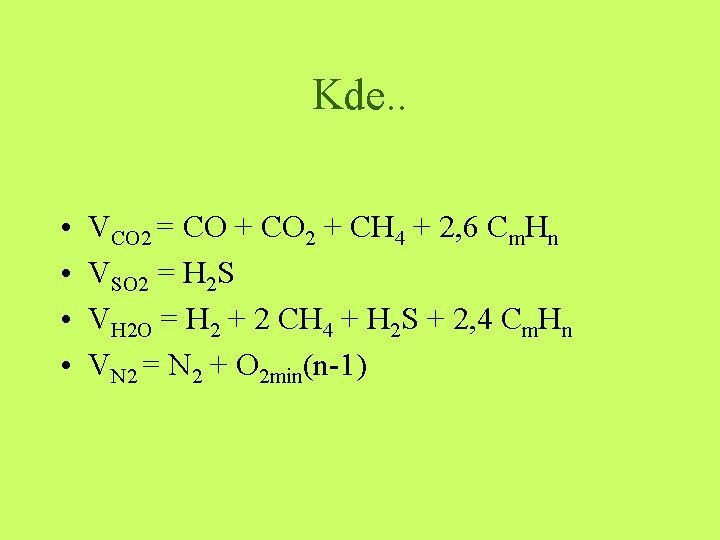
Kde. . • • VCO 2 = CO + CO 2 + CH 4 + 2, 6 Cm. Hn VSO 2 = H 2 S VH 2 O = H 2 + 2 CH 4 + H 2 S + 2, 4 Cm. Hn VN 2 = N 2 + O 2 min(n-1)

Vyjadrenie jednotlivých zložiek v objemových percentách • CO 2 = (VCO 2/Vsp. V). 100 • H 2 O = (VH 2 O/Vsp. V). 100

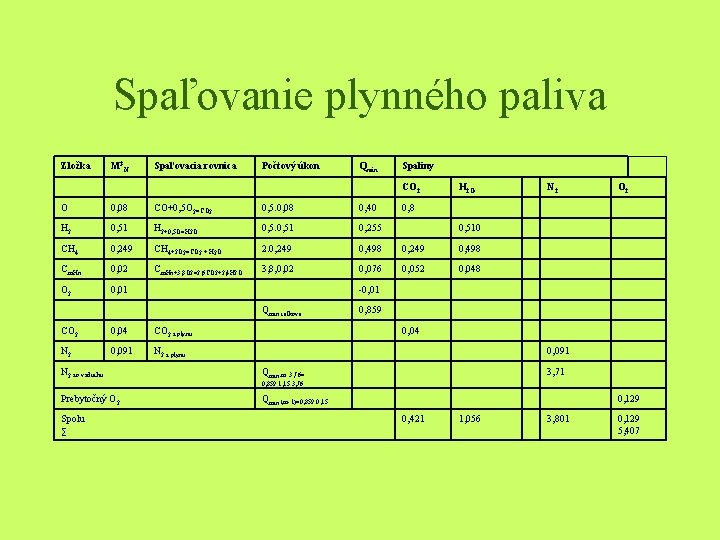
Príklad Ako príklad spaľovania plynného paliva je uvedené spaľovanie odpadového plynu (koksárenský plyn), ktorý má zloženie: 4% oxidu uhličitého, 2% uhľovodíkov, 1% kyslíka, 8% oxidu uhoľnatého, 51% vodíka, 24% metánu, 9, 1% duíka, m=1, 15.

Spaľovanie plynného paliva Zložka M 3 N Spaľovacia rovnica Počtový úkon Qmin Spaliny CO 2 H 2 O O 0, 08 CO+0, 5 O 2=CO 2 0, 5. 0, 08 0, 40 H 2 0, 51 H 2+0, 5 O=H 2 O 0, 51 0, 255 CH 4 0, 249 CH 4+2 O 2=CO 2 + H 2 O 2. 0, 249 0, 498 Cm. Hn 0, 02 Cm. Hn+3, 8 O 2=2, 6 CO 2+2, 4 H 2 O 3, 8, 0, 02 0, 076 0, 052 0, 048 O 2 0, 01 O 2 0, 8 0, 510 -0, 01 Qmin celkové CO 2 0, 04 CO 2 z plynu N 2 0, 091 N 2 z plynu N 2 zo vzduchu N 2 0, 859 0, 04 0, 091 Qmin. m. 3, 76= 3, 71 0, 859. 1, 15. 3, 76 Prebytočný O 2 Spolu ∑ Qmin. (m-1)=0, 859. 0, 15 0, 129 0, 421 1, 056 3, 801 0, 129 5, 407

• Zmes ťažkých uhľovodíkov sa spaľuje podľa rovnice odvodenej z ich predpokladaného zloženia Cm. Hn = 2, 4 m. N 3 H 2 a 1400 g C. Cm. Hn = 3, 8 O 2 = 2, 6 CO 2 + 2, 4 H 2 O • K spáleniu 1 m. N 3 koksárenského plynu daného zloženia je treba: L 3 = O. m. 4? 76 = 0, 859. 1, 15. 4, 76=4, 7 m sk min N vzduchu a vznikne 5, 407 m. N 3 spalín