SEL ELEKTROKIMIA PERTEMUAN 7 KIMIA XII AJANG DESI






- Slides: 7

SEL ELEKTROKIMIA PERTEMUAN 7 KIMIA XII AJANG DESI KURNIAWAN ST. SMA AL ISLAM BOARDING SCHOOL PONDOK PESANTREN MODERN AL – ISLAM

Metode Bilangan Oksidasi Langkah-langkah penyetaraan persamaan reaksi redoks dengan metode ini sebagai berikut. 1) Menentukan bilangan oksidasi (biloks) setiap atom pada semua zat. 2) Menyetarakan atom yang mengalami perubahan biloks. Perlu diperhatikan jika ada atom dalam satu zat yang memiliki jumlah lebih dari satu. 3) Menentukan jumlah penurunan dan kenaikan bilangan oksidasi (jumlah perubahan bilangan oksidasi atom dikalikan jumlah atom dalam zat tersebut). 4) Menyamakan jumlah perubahan bilangan oksidasi antara atom yang mengalami reaksi reduksi dan atom yang mengalami reaksi oksidasi dengan koefisien tertentu. 5) Menyetarakan jumlah atom-atom yang lain kecuali atom H dan O. 6) Menyetarakan muatan dengan menambah ion H+ untuk suasana asam dan ion OH– untuk suasana basa. 7) Menyetarakan atom H dengan menambahkan H 2 O. 8) Memeriksa jumlah atom O dan hasil penyetaraan. Kembali ke daftar isi Kembali ke awal bab

Contoh: Setarakan reaksi redoks berikut dengan metode bilangan oksidasi: Cu. S(s) + NO 3 –(aq) → Cu 2+(aq) + S(s) + NO(g) (suasana asam) penyelesaian: Kembali ke daftar isi Kembali ke awal bab

Sel Elektrokimia Reaksi Redoks Spontan Sel Volta atau Sel Galvani Sel Elektrolisis Kembali ke daftar isi Kembali ke awal bab

Reaksi Redoks Spontan ü Reaksi redoks spontan merupakan reaksi redoks yang berlangsung dengan sendirinya. ü Reaksi redoks spontan dapat menghasilkan energi listrik. ü Reaksi redoks tidak spontan memerlukan Reaksi logam seng dengan larutan Cu. SO 4 berlangsung spontan energi listrik. Kembali ke daftar isi Kembali ke awal bab

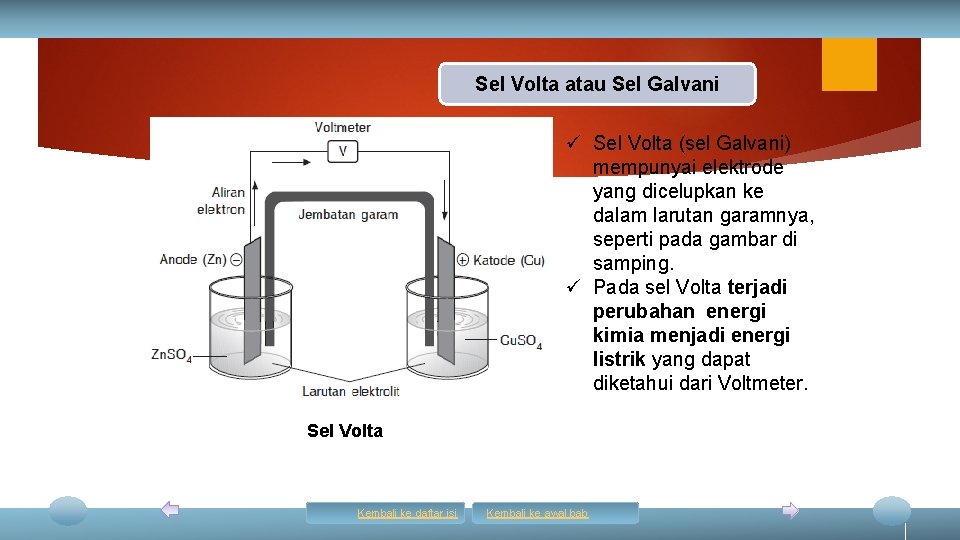
Sel Volta atau Sel Galvani ü Sel Volta (sel Galvani) mempunyai elektrode yang dicelupkan ke dalam larutan garamnya, seperti pada gambar di samping. ü Pada sel Volta terjadi perubahan energi kimia menjadi energi listrik yang dapat diketahui dari Voltmeter. Sel Volta Kembali ke daftar isi Kembali ke awal bab

Diagram sel ü Diagram sel merupakan susunan suatu sel Volta yang dinyatakan dengan suatu notasi singkat. ü Logam yang bertindak sebagai katode dan anode harus ditentukan terlebih dahulu sebelum menentukan diagram sel. Contoh: ü Berdasarkan reaksi di atas, logam Zn berfungsi sebagai anode dan logam Cu berfungsi sebagai katode. ü Jika potensial sel yang ditunjukkan oleh voltmeter sebesar 1, 1 volt, penulisan diagram selnya sebagai berikut. Zn(s) | Zn 2+(aq) || Cu 2+(aq) | Cu(s), E° = 1, 1 volt Kembali ke daftar isi Kembali ke awal bab