Schma de Lewis des molcules les rgles de





- Slides: 8

Schéma de Lewis des molécules : les règles de bases • • Les électrons sont répartis en « couches » autour du noyau. Chaque couche admet un nombre maximum d’électrons: la couche K (la première) accepte 2 électrons la couche L 8 électrons la couche M 8 électrons (cela suffira pour le modèle enseigné en seconde) Ce sont les électrons de la dernière couche (couche externe) qui participent aux liaisons (et donc aux réactions chimiques Avoir 8 électrons sur sa couche externe est un état stable dans la nature (ex : les gaz rares sont des molécules monoatomiques ; les atomes comptent 8 électrons sur leur couche externe) Règle de l’octet : les atomes cherchent à acquérir la configuration électronique des gaz rares (soit 8 électrons sur la couche externe ; exception : 2 pour l’hydrogène et l’hélium) Afin de satisfaire la règle de l’octet, ils partagent des liaisons covalentes avec d’autres atomes Chaque liaison covalente est une mise en commun de 2 électrons Les électrons qui ne participent pas à la liaison covalente sont répartis en doublet non liant autour de l’atome auquel ils appartiennent.

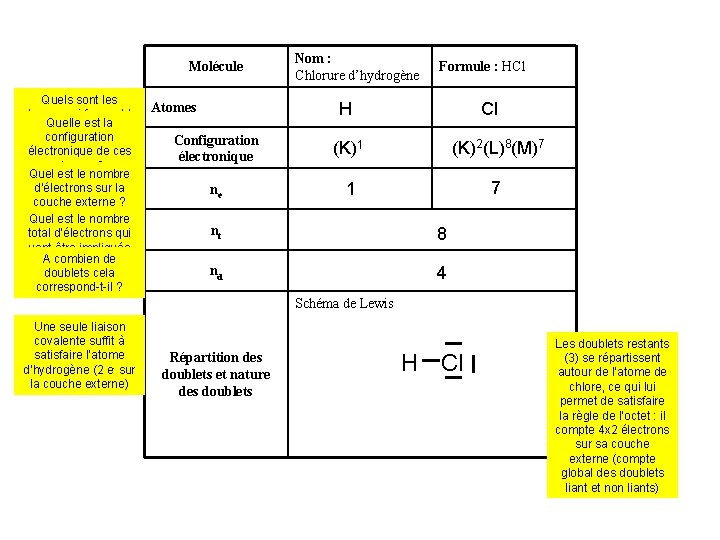
Molécule Quels sont les atomes qui forment la Quelle est la molécule ? configuration électronique de ces atomes ? Quel est le nombre d’électrons sur la couche externe ? Quel est le nombre total d’électrons qui vont être impliqués A combien de dans les liaisons doublets cela éventuelles ? correspond-t-il ? Nom : Chlorure d’hydrogène Formule : HCl H Atomes Cl Configuration électronique (K)1 (K)2(L)8(M)7 ne 1 7 nt 8 nd 4 Schéma de Lewis Une seule liaison covalente suffit à satisfaire l’atome d’hydrogène (2 e- sur la couche externe) Répartition des doublets et nature des doublets H Cl Les doublets restants (3) se répartissent autour de l’atome de chlore, ce qui lui permet de satisfaire la règle de l’octet : il compte 4 x 2 électrons sur sa couche externe (compte global des doublets liant et non liants)

Molécule Nom : Eau Formule : H 2 O 2 x. H Atomes Configuration électronique ne O (K)2(L)6 2 x (K)1 6 2 x 1 nt 8 nd 4 Schéma de Lewis Répartition des doublets et nature des doublets H O H

Molécule Atomes Configuration électronique ne Nom : Méthane Formule : CH 4 4 x. H C 4 x (K)1 (K)2(L)4 4 4 x 1 nt 8 nd 4 Schéma de Lewis Répartition des doublets et nature des doublets H H C H H

Molécule Nom : Diazote Formule : N 2 2 x. N Atomes Configuration électronique ne 2 x (K)2(L)5 2 x 5 nt 10 nd 5 Schéma de Lewis Répartition des doublets et nature des doublets N N

Molécule Nom : Cyanure d’hydrogène Formule : HCN H C N Configuration électronique (K)1 (K)2(L)4 (K)2(L)5 ne 1 4 5 Atomes nt 10 nd 5 Schéma de Lewis Répartition des doublets et nature des doublets H C N

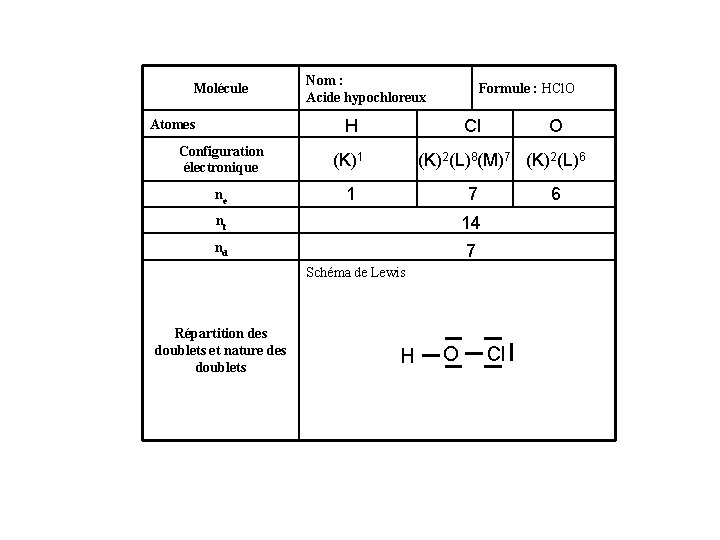
Molécule Nom : Acide hypochloreux Formule : HCl. O H Atomes Configuration électronique (K)1 ne 1 Cl O (K)2(L)8(M)7 (K)2(L)6 7 nt 14 nd 7 6 Schéma de Lewis Répartition des doublets et nature des doublets H O Cl

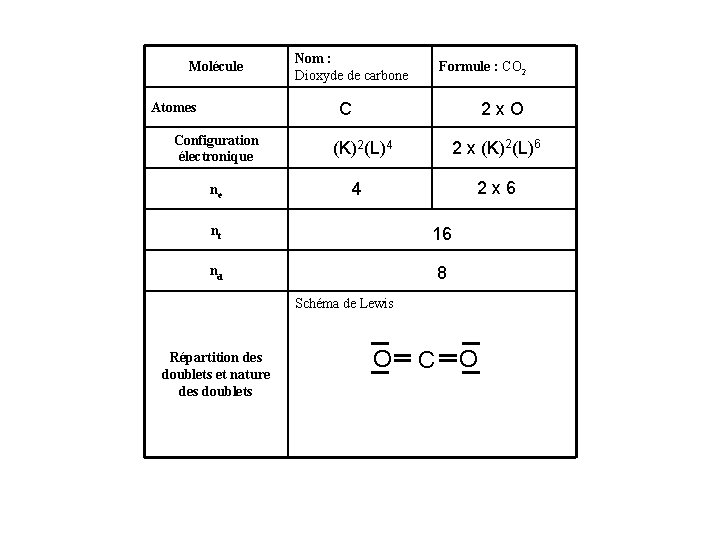
Molécule Nom : Dioxyde de carbone Formule : CO 2 C Atomes Configuration électronique ne 2 x. O 2 x (K)2(L)6 (K)2(L)4 2 x 6 4 nt 16 nd 8 Schéma de Lewis Répartition des doublets et nature des doublets O C O