Saikne starp nemetlisko elementu savienojumiem Tipiskas shmas un
















- Slides: 17

Saikne starp nemetālisko elementu savienojumiem

Tipiskas shēmas un piemēri(I) • • Nemetāls Skābais oksīds Skābe Sāls Skābe Cita sāls Skābe Skābā sāls Normālā sāls Skābe Bāziskā sāls Normālā sāls Piemēri: C CO 2 H 2 CO 3 Ca. CO 3 Na. Cl HCl Ca. Cl 2 H 2 SO 4 Na. HSO 4 Na 2 SO 4 HCl (Cu. OH)Cl Cu. Cl 2

Piemēru(I) atrisinājumi C CO 2 H 2 CO 3 Ca. CO 3 Atrisinājums: C + O 2 CO 2 un CO 2 + H 2 O H 2 CO 3 + Ca(OH)2 Ca. CO 3 + 2 H 2 O Na. Cl HCl Ca. Cl 2 Atrisinājums: 2 Na. Cl + H 2 SO 4 (t 0) 2 HCl + Na 2 SO 4 2 HCl + Ca. O Ca. Cl 2 + H 2 O

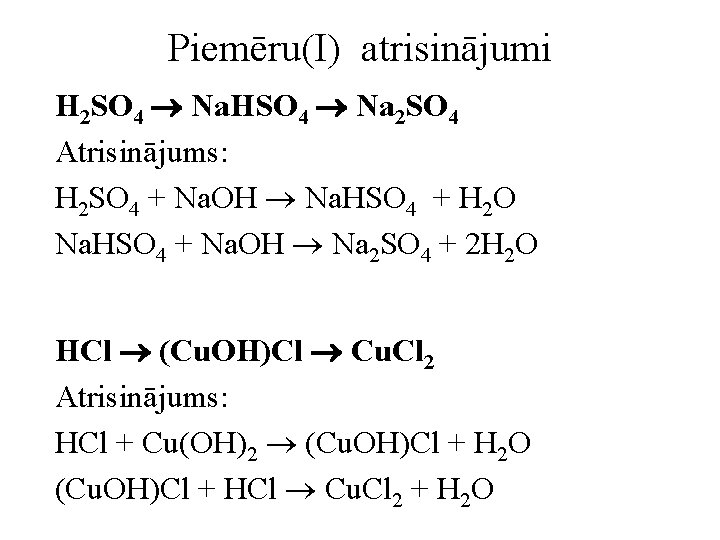
Piemēru(I) atrisinājumi H 2 SO 4 Na. HSO 4 Na 2 SO 4 Atrisinājums: H 2 SO 4 + Na. OH Na. HSO 4 + H 2 O Na. HSO 4 + Na. OH Na 2 SO 4 + 2 H 2 O HCl (Cu. OH)Cl Cu. Cl 2 Atrisinājums: HCl + Cu(OH)2 (Cu. OH)Cl + H 2 O (Cu. OH)Cl + HCl Cu. Cl 2 + H 2 O

Daži reakciju norises nosacījumi (I) • Stiprāka skābe izspiež vājāko skābi no tās sāļiem Piemēri: 2 Na. NO 3 + H 2 SO 4 (t 0) Na 2 SO 4 + 2 HNO 3 K 2 Si. O 3 + 2 HNO 3 2 KNO 3 + H 2 Si. O 3 Na 2 SO 4 + HNO 3 reakcija nenotiek Ca. Cl 2 + H 2 CO 3 reakcija nenotiek

Daži reakciju norises nosacījumi (II) • Mazāk gaistoša skābe izspiež gaistošāko skābi no tās sāļiem – Visraksturīgākie piemēri ir silīcijskābei Piemēri: Na 2 CO 3 + H 2 Si. O 3 (t 0) Na 2 Si. O 3 + H 2 O + CO 2 2 Na. NO 3 + H 2 Si. O 3 (t 0) Na 2 Si. O 3 + 2 HNO 3 Na 2 Si. O 3 + H 2 CO 3 reakcija nenotiek

Daži reakciju norises nosacījumi (III) • Aktīvākais metāls izspiež mazāk aktīvo no tā sāļiem Piemēri: Fe + Cu. SO 4 Cu + Fe. SO 4 Cu + 2 Ag. NO 3 2 Ag + Cu(NO 3)2 Cu + Fe. SO 4 reakcija nenotiek Uzmanību! Paši aktīvākie metāli reaģē arī ar ūdeni!

Daži reakciju norises nosacījumi (IV) • Divi sāļi reaģē savā starpā, ja tie abi šķīst ūdenī un reakcijas rodas viena ūdenī nešķīstoša sāls Na. Cl + Ag. NO 3 Ag. Cl + Na. NO 3 K 2 SO 4 + Ba. Cl 2 Ba. SO 4 + 2 KCl Na. Cl + KNO 3 reakcija nenotiek K 2 SO 4 + Mg. SO 4 reakcija nenotiek Uzmanību! Izmanto sāļu šķīdības tabulas!

Daži reakciju norises nosacījumi (V) • Hidroksīdi karsējot sadalās – No 1 A grupas metālu hidroksīdiem sadalās tikai Li. OH Piemēri: 2 Fe(OH)3 (t 0) Fe 2 O 3 + 3 H 2 O Ca(OH)2 (t 0) Ca. O + H 2 O 2 Li. OH (t 0) Li 2 O + H 2 O

Daži reakciju norises nosacījumi (VI) • Skābekli saturošās skābes karsējot parasti sadalās Piemēri: H 2 CO 3 (t 0) CO 2 + H 2 O 4 HNO 3 (t 0) 4 NO 2 + 2 H 2 O H 2 Si. O 3 (t 0) Si. O 2 + H 2 O

Daži reakciju norises nosacījumi (VII) • Skābekli saturošo skābju sāļi karsējot sadalās Piemēri: Mg. CO 3 (t 0) Mg. O + CO 2 Fe. CO 3 (t 0) Fe. O + CO 2 Ca. SO 3 (t 0) Ca. O + SO 2

Daži reakciju norises nosacījumi (VIII) • Jonu reakcijas līdz galam notiek, ja: – izdalās gāze Piemēri: Na 2 SO 3 + 2 HCl 2 Na. Cl + SO 2 + H 2 O K 2 CO 3 + 2 HNO 3 2 KNO 3 + CO 2 + H 2 O NH 4 Cl + KOH KCl + NH 3 + H 2 O

Daži reakciju norises nosacījumi (IX) • Jonu reakcijas līdz galam notiek, ja: – rodas nogulsnes Piemēri: Ba(NO 3)2 + K 2 SO 4 Ba. SO 4 + 2 KNO 3 Ca. Cl 2 + Na 2 CO 3 Ca. CO 3 + 2 Na. Cl Fe. Cl 2 + 2 KOH Fe(OH)2 + 2 KCl

Daži reakciju norises nosacījumi (X) • Jonu reakcijas līdz galam notiek, ja: – rodas ūdens Piemēri: 3 KOH + H 3 PO 4 K 3 PO 4 + 3 H 2 O HNO 3 + Li. OH Li. NO 3 + H 2 O 2 Na. OH + H 2 SO 4 Na 2 SO 4 + 2 H 2 O

Daži reakciju norises nosacījumi (XI) • Skābos sāļus veido tikai daudzvērtīgās skābes Piemēri: Na. HCO 3 nātrija hidrogēnkarbonāts jeb dzeramā soda Na. OH + H 2 CO 3 Na. HCO 3 + H 2 O KOH + SO 2 KHSO 3

Daži reakciju norises nosacījumi (XII) • Bāziskos sāļus veido tikai daudzvērtīgās bāzes Piemēri: Mg(OH)Cl – magnija hidroksīdhlorīds Mg(OH)2 + HCl Mg(OH)Cl + H 2 O Fe(OH)3 + H 2 SO 4 Fe(OH)SO 4 + 2 H 2 O Fe(OH)2 + HNO 3 Fe(OH)NO 3 + H 2 O

Uzdevumu piemēri audzēkņu patstāvīgajam darbam 1. 2. 3. 4. 5. 6. 7. P P 2 O 5 H 3 PO 4 K 3 PO 4 Ca 3(PO 4)2 Na. Cl HCl KCl Ag. Cl Ca. CO 3 CO 2 Na 2 CO 3 Na 2 SO 4 Ca(OH)2 Ca. O Ca(NO 3)2 HNO 3 S SO 2 H 2 SO 3 Na 2 SO 3 SO 2 CO 2 Na. HCO 3 Na 2 CO 3 Ca. CO 3 H 2 SO 4 (Fe. OH)SO 4 Fe 2(SO 4)3



















