Promieniowanie jonizujce w rodowisku 1 Promieniowanie Soca wszystko







![Widmo promieniowania elektromagnetycznego Jednostki: częstotliwość [Hz] długość fali [m] energia [e. V] l=c/n E=hn Widmo promieniowania elektromagnetycznego Jednostki: częstotliwość [Hz] długość fali [m] energia [e. V] l=c/n E=hn](https://slidetodoc.com/presentation_image_h/f3f4e94c42677dcd37649084d2c14f3a/image-10.jpg)











- Slides: 31

Promieniowanie jonizujące w środowisku (1)

Promieniowanie Słońca – wszystko co powstaje podczas reakcji zachodzących wewnątrz Słońca i dociera do górnych warstw atmosfery n n promieniowanie ultrafioletowe wiatr słoneczny promieniowanie widzialne podczerwone i radiowe Promieniowanie to nie ma własności jonizacji atmosfery

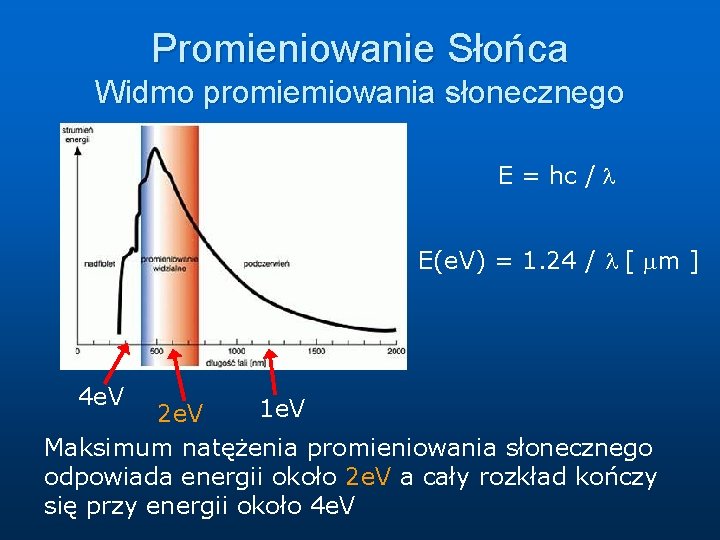
Promieniowanie Słońca Widmo promiemiowania słonecznego E = hc / l E(e. V) = 1. 24 / l [ mm ] 4 e. V 1 e. V 2 e. V Maksimum natężenia promieniowania słonecznego odpowiada energii około 2 e. V a cały rozkład kończy się przy energii około 4 e. V

Energia jonizacji Energia, jaką musi mieć promieniowanie, aby móc zjonizować materię (od neutralnych atomów oderwać elektron lub więcej elektronów i zamienić je w dodatnio naładowane jony). Energia jonizacji atomu wodoru: 13. 6 e. V Energia wiązania elektronów przez jądra różnych pierwiastków zależy od liczby atomowej pierwiastka Z (czyli od ładunku elektrycznego jądra atomowego i od miejsca (stanu elektronu) na kolejnych orbitach (orbity K L M. . . ) w atomie.

Energie wiązania elektronów w atomach kilku pierwiastków w elektronowoltach (e. V) H O Fe Pb K L-I M-I N-IV O-IV 13. 6 543. 1 7 112 88 005 41. 6 844. 6 15 861 91. 3 3 851 434 20. 7

Średnia energia jonizacji n n Energie potrzebne do oderwania elektronów związanych w atomach na różnych powłokach są różne Dla atomów każdego pierwiastka wyliczone zostały średnie energie jonizacji Przykłady średniej energii jonizacji: Powietrze – 85 e. V Grafit – 78 e. V Aluminium – 164 e. V Ołów – 812 e. V

Jednostki energii w fizyce atomowej i jądrowej n n 1 e. V – typowa energia dla atomów 1 Me. V = 1 000 e. V - typowa energia dla jąder atomowych

Promieniowanie jonizujące to promieniowanie o energii (energia pojedynczego fotonu lub pojedynczej cząstki) przekraczających energię wiązania elektronów w atomach. n n Promieniowanie elektromagnetyczne o dużej energii (promieniowanie X znane też jako promieniowanie rentgenowskie) Promieniowanie emitowane przez jądra atomowe: a, b, g

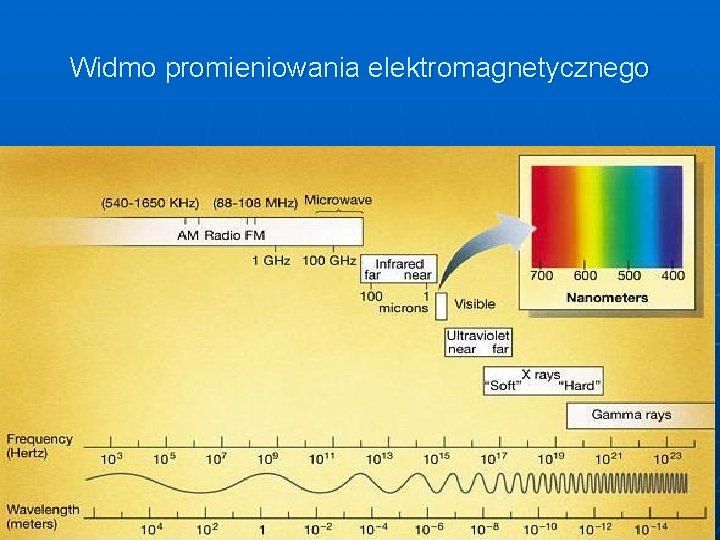
Widmo promieniowania elektromagnetycznego
![Widmo promieniowania elektromagnetycznego Jednostki częstotliwość Hz długość fali m energia e V lcn Ehn Widmo promieniowania elektromagnetycznego Jednostki: częstotliwość [Hz] długość fali [m] energia [e. V] l=c/n E=hn](https://slidetodoc.com/presentation_image_h/f3f4e94c42677dcd37649084d2c14f3a/image-10.jpg)
Widmo promieniowania elektromagnetycznego Jednostki: częstotliwość [Hz] długość fali [m] energia [e. V] l=c/n E=hn Promieniowanie elektromagnetyczne ma własność jonizowania materii wtedy, gdy energia kwantu promieniowania przekroczy energię około 10 elektronowoltów. Jest to obszar promieniowania X czyli promieniowania rentgenowskiego i promieniowania gamma.

Promieniowanie elektromagnetyczne powstaje np. . gdy na poruszający się ładunek elektryczny działa siła powodująca zmianę prędkości tego ładunku. W szczególności promieniowanie X powstaje gdy elektrony przyspieszone do energii kilkudziesięciu ke. V zderzają się z jądrami atomów Źródła jonizującego promieniowania elektromagnetycznego : n n n Lampa rentgenowska (elektrony o E~50 ke. V hamują) Synchrotron (elektrony o E~2 Ge. V poruszają się po łuku) Kineskop w starych telewizorach (elektrony o E~3 ke. V hamują uderzając w ekran kineskopu)

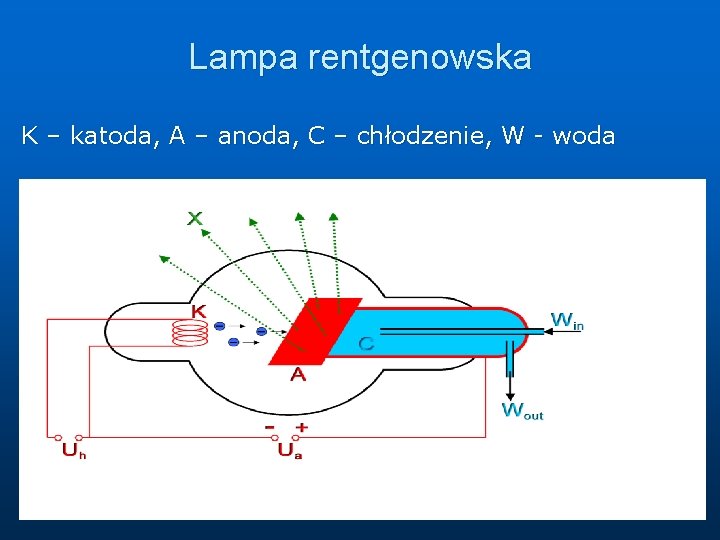
Lampa rentgenowska K – katoda, A – anoda, C – chłodzenie, W - woda

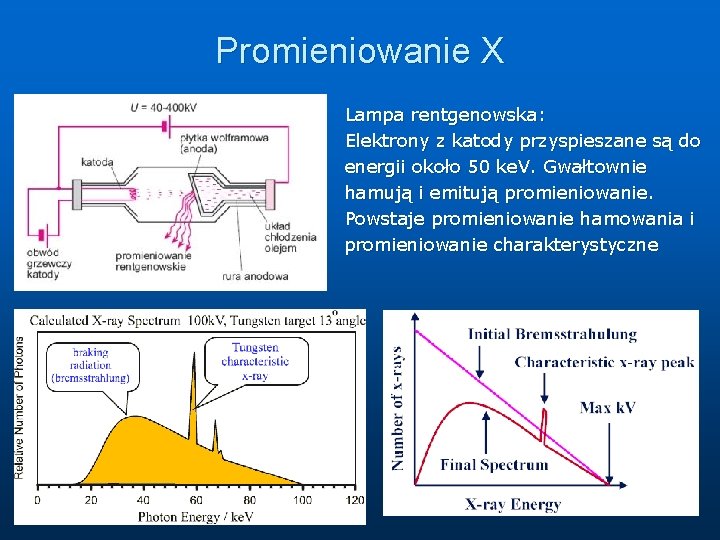
Promieniowanie X Lampa rentgenowska: Elektrony z katody przyspieszane są do energii około 50 ke. V. Gwałtownie hamują i emitują promieniowanie. Powstaje promieniowanie hamowania i promieniowanie charakterystyczne

Promieniowanie jąder atomowych n n Powstaje przy przemianach jąder atomowych zarówno tych wywołanych przez reakcje jądrowe jak i przez spontaniczne (samorzutne) przemiany. Przy przemianach jądrowych występuje energia rzędu energii wiązania jednego nukleonu (neutronu lub protonu) przez jądro atomowe Jest to energia znacznie większa od energii potrzebnej do zjonizowania jednego atomu. Średnia energia wiązania neutronu. 8 000 e. V = 8 Me. V

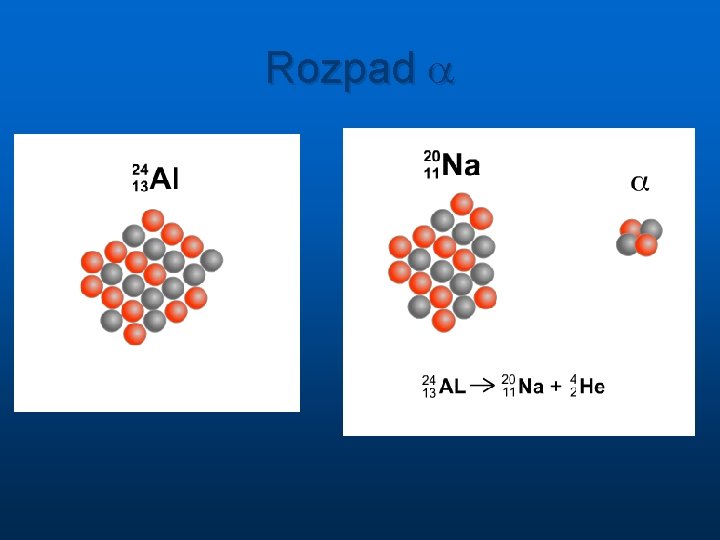
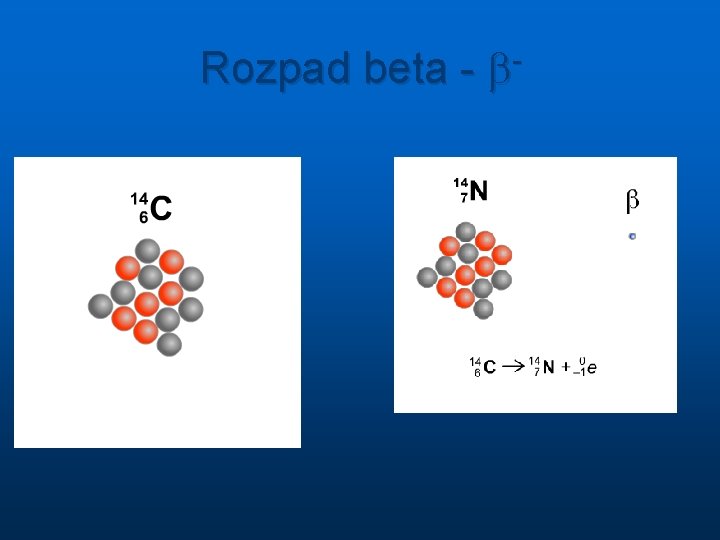
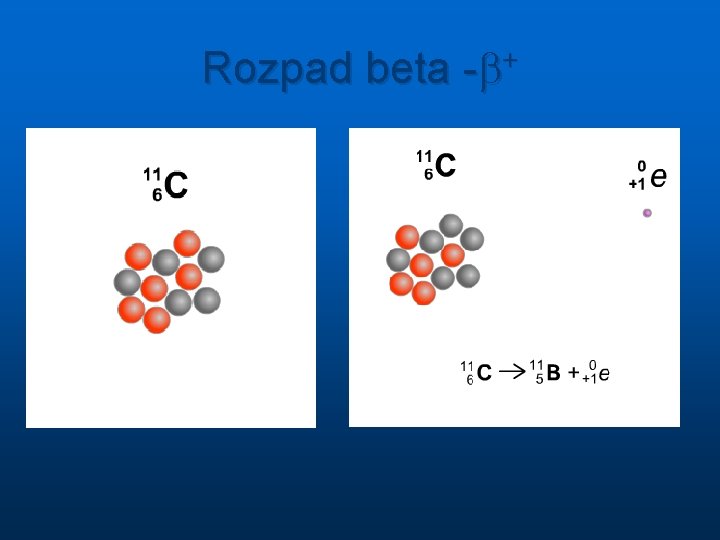
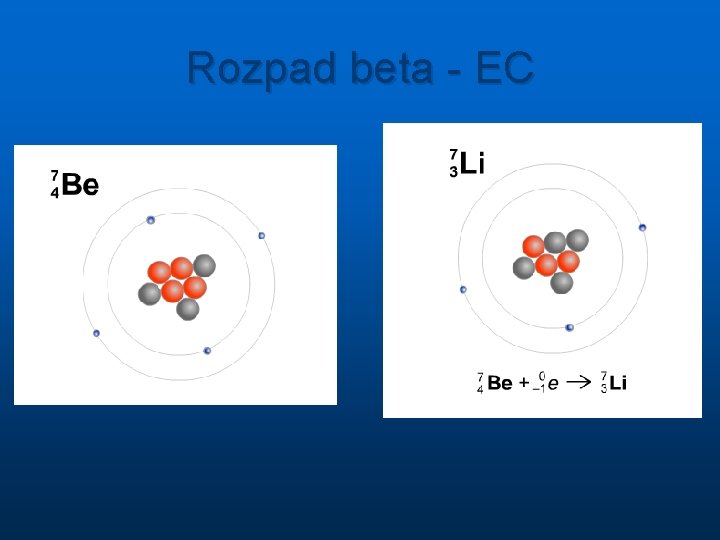
Rozpad radioaktywnych jąder Przemiana jednego jądra w inne zachodzi spontanicznie bez udziału czynników zewnętrznych n n n alfa ( jądra atomu helu, 2 protony i 2 neutrony ) masa cząsteczki alfa A=4, ładunek Z=2 beta (elektrony, ale jest też promieniowanie beta plus, które stanowią pozytony czyli cząstki identyczne jak elektron ale z dodatnim ładunkiem elektrycznym) masa 1840 razy mniejsza od masy protonu ale A=0, ładunek elektryczny Z= -1 lub +1 gamma ( o naturze fal elektromagnetycznych ) energie pojedynczych od ok. 10 ke. V do 5 Me. V

Rozpad a

Rozpad beta - b-

Rozpad beta -b+

Rozpad beta - EC

Cząsteczki powstające w wywołanych sztucznie lub zachodzących w naturze reakcjach jądrowych Przemiana jądrowa pod wpływem cząsteczki uderzającej w jądro n neutrony (cząsteczki o masie prawie takiej samej jak masa protonów czyli A=1, ale bez ładunku elektrycznego) n lekkie cząstki (protony, deuterony, jądra helu ) n ciężkie jony n inne cząsteczki powstające przy zderzeniach o jeszcze większych energiach (Ge. V)

Składniki jąder: protony i neutrony n n n Proton – cząstka o ładunku elektrycznym (Z=+1) Neutron – cząstka bez ładunku (Z=0) Składniki te przyciągają się mimo że protony mają ładunek elektryczny a jednoimienne ładunki odpychają się. Składniki jądra związane są siłami jądrowymi

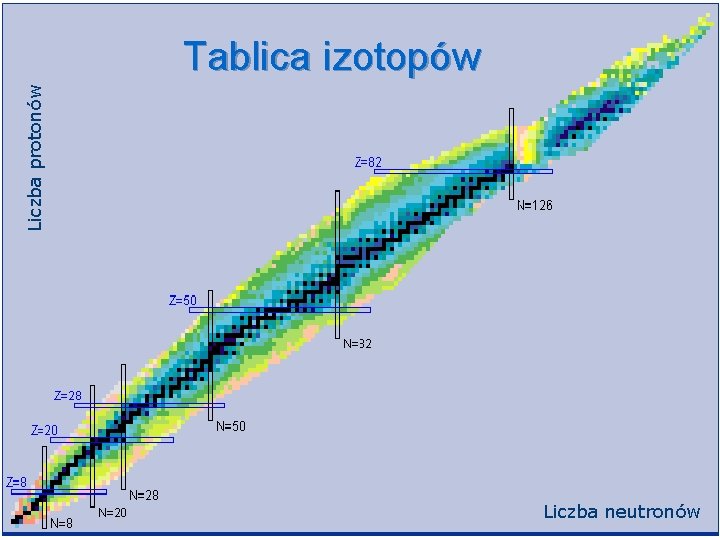
Liczba atomowa Z i liczba masowa A n n n Każde jądro scharakteryzowane jest przez liczbę protonów i liczbę neutronów znajdujących się w jądrze Z – liczba protonów nazywa się liczbą atomową N – liczba neutronów ( zwykle nie podaje się) Z+N=A sumę liczb protonów i neutronów nazywa się liczbą masową Symbol pierwiastka automatycznie oznacza liczbę atomową Z

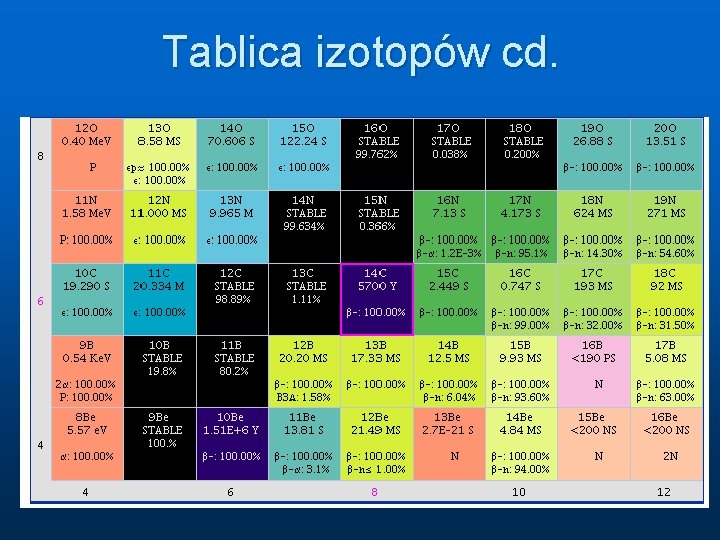
Izotopy Przykłady: Jądra 12 C i 14 C to dwa izotopy węgla. Jądra te zawierają po 6 protonów (węgiel to kolejno szósty pierwiastek w układzie okresowym) i odpowiednio 6 (6+6=12)i 8 (6+8=14) neutronów. Jądra 235 U i 238 U oba zawierają 92 protony i odpowiednio 143 i 146 neutronów.

Liczba protonów Tablica izotopów Liczba neutronów

Tablica izotopów cd.

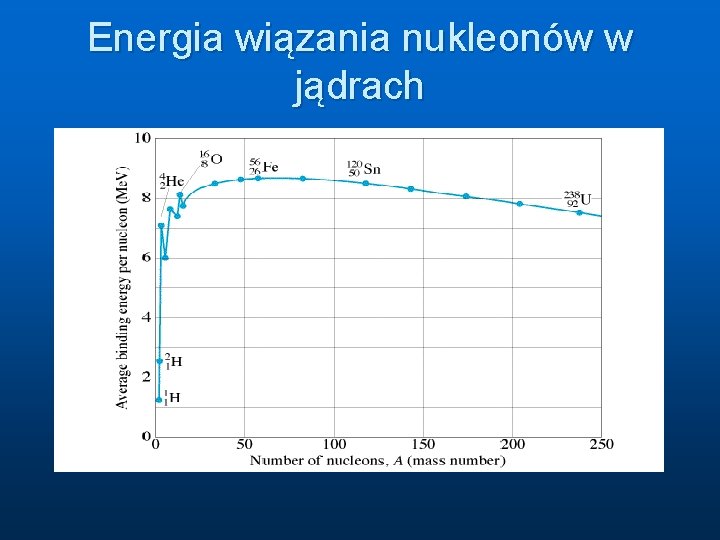
Energia wiązania jąder n n Masa każdego jądra jest mniejsza od masy sumy wszystkich składników jądra Najsilniej związane są jądra o odpowiednim stosunku liczby protonów do liczby neutronów n Gdy ten stosunek nie jest właściwy jądro rozpada się na inne bardziej stabilne n Są stabilne i radioaktywne izotopy

Energia wiązania nukleonów w jądrach

Ścieżka stabilności sposoby przemian jądra w inne jądro n n n Rozpad beta to zamiana jądra słabiej związanego w jądro silniej związane poprzez zamianę jednego z neutronów w proton (gdy w jądrze jest za dużo neutronów) lub jednego protonu w neutron (gdy w jądrze jest za dużo protonów). Rozpad alfa: Ciężkie jądra, zawierające ponad 200 składników łatwiej potrafią zamienić się w jądro silniej związane poprzez pozbycie się równocześnie połączonych razem dwóch protonów i dwóch neutronów czyli cząstki alfa. Rozpad gamma: Po rozpadzie beta jądro często emituje promieniowanie elektromagnetyczne.

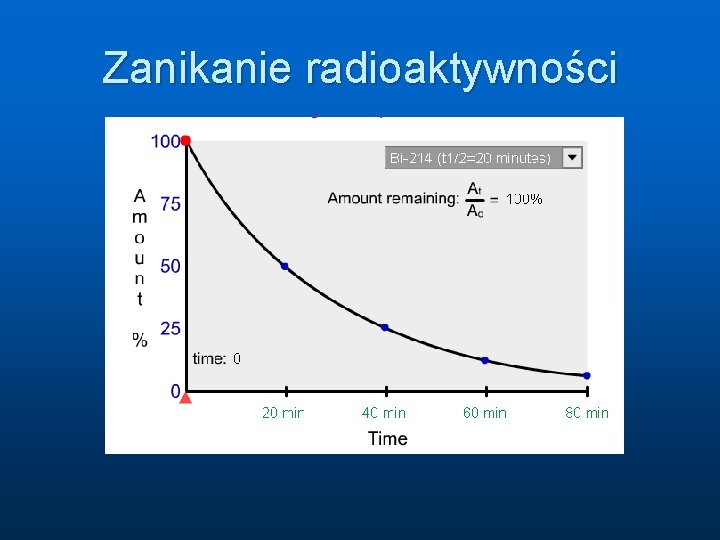
Okres połowicznego rozpadu jądra n n Czas w ciągu którego połowa jąder ulega rozpadowi. ( T 1/2 ) Czas połowicznego zaniku zmienia się od jądra do jądra i może wynosić ułamki sekundy aż do miliardów lat Jądro 3 H 7 Be 14 C T 1/2 Jądro 12 lat 53 dni 5730 lat 238 U 235 U 232 Th T 1/2 4. 47 mld lat 0. 71 mld lat 14. 1 mld lat

Zanikanie radioaktywności

Długożyciowe jądra promieniotwórcze znajdujące się w środowisku n n n Jądra o T 1/2 około 1 miliarda lat, rozpadające się na jądra stabilne: 40 K, 87 Rb i kilkanaście innych Jądra o T 1/2 , które rozpadają się na jądra niestabilne i które tworzą szeregi promieniotwórcze: 232 Th, 238 U i 235 U i kolejne produkty rozpadu tych długożyciowych jąder 3. Jądra, które powstają podczas zderzeń stabilnych jąder (głównie tlenu i azotu) z promieniowaniem kosmicznym: 3 H, 14 C, 7 Be i kilkanaście innych































