Oleh Amalia Nur Apriliani Kelas 11 MIA 6





- Slides: 8

Oleh Amalia Nur Apriliani Kelas : 11 MIA 6 SMA N 3 Tangerang Selatan

Pengertian BERKAITAN DENGAN : Hukum Kekekalan Energi, yaitu energi tidak dapat diciptakan atau dimusnahkan tetapi energi hanya dapat diubah dari satu bentuk ke bentuk lainnya. TERMOKIMIA Adalah cabang ilmu kimia Entalphy yang mempelajari tentang dinotasikan dengan panas, kalor, energi, suhu yang berhubungan dengan H ( heat content) kalor reaksi, panas reaksi atau perubahan entalphy reaksi.

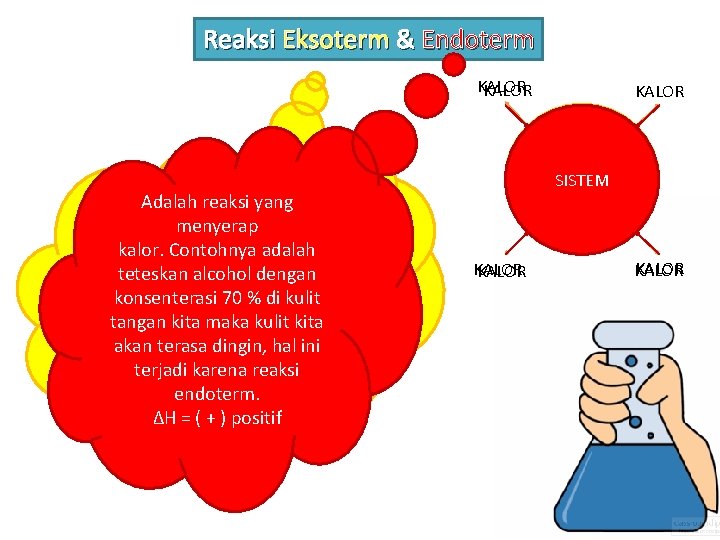
Reaksi Eksoterm & Endoterm KALOR Adalah reaksi kimia yang Adalah reaksi yang membebaskan kalor. menyerap Contohnya adalah masukkan kalor. Contohnya adalah batu kapur(Ca. O) dalam air, teteskan alcohol dengan maka air akan menjadi panas konsenterasi di kulit malahan bisa 70 jadi%sampai tangan kita maka kulit kita mendidih , tergantung akan terasa dingin, hal ini banyaknya Ca. O yang terjadi karena reaksi direaksikan dengan air. ΔHendoterm. = ( - ) negatif ΔH = ( + ) positif KALOR SISTEM KALOR

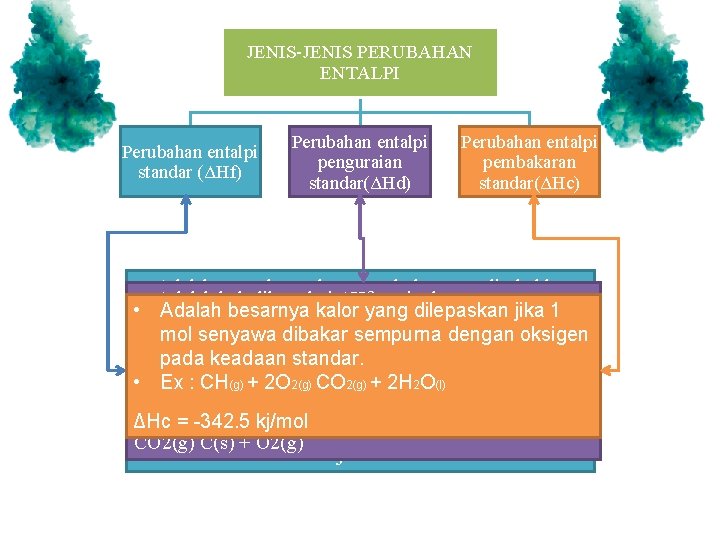
JENIS-JENIS PERUBAHAN ENTALPI Perubahan entalpi standar (ΔHf) Perubahan entalpi penguraian standar(ΔHd) Perubahan entalpi pembakaran standar(ΔHc) • Adalah pengukuran besarnya kalor yang disebabkan • Adalah kebalikan dari ΔHf , yaitu besarnya energy suatubesarnya reaksi yang berlangsung pada suhujika 25 C • dari Adalah kalor yang dilepaskan 1 yang dibebaskan atau yang diperlukan untuk (298 dan tekanan 1 atm. mol K) senyawa dibakar sempurna dengan oksigen menguraikan 1 mol suatu senyawa menjadi unsur • Perubahan entalpistandar. pembentukan standar(ΔHf) pada keadaan unsurnya. • Ex : CH(g) + 2 O 2(g) CO 2(g) + 2 H 2 O(l) • Ex : ΔH penguraian CO 2 = + 392. 2 kj/mol • Ex : pembentukan H 2 O ΔHc = -342. 5 kj/mol CO 2(g) C(s) + O 2(g) H 2 + O 2 H 2 O ΔH f = -134 j/mol

Rumus menghitung ΔH ΔHreaksi = Hproduk – Hreaktan Rumus menghitung perubahan entalpi ΔH Qlarutan = -Qair = -m(air). V(air). ΔT = -ρair. C(air). V (air). ΔT Q = m. cp. ΔT = m. cp (T 2 -T 1) T 2 > T 1 Q = + (exo) T 2 < T 1 Q = − (endo)

Energi Ikatan Energi ikatan adalah energi yang diperlukan untuk memutuskan ikatan antar atom per mol zat dalam bentuk gas � Rumus : � ΔHreaksi = Sreaktan-Sproduk � ΔHreaksi = S ôkiri - S ôkanan

Penentuan ΔH Reaksi dengan Hukum Hess Bunyi hukum hess “Hukum hess menyatakan bahwa besarnya perubahan entalpi reaksi hanya bergantung pada keadaan awal dan akhir reaksi saja dan tidak bergantung pada jalannya reaksi. ”

Sumber materi : Slideshare. com















