l Nahromadenie poznatkov o zloen ltok viedlo k













- Slides: 19


l Nahromadenie poznatkov o zložení látok viedlo k zostaveniu štruktúrnych vzorcov. l Zistilo sa, že spájanie atómov, sa nazýva chemická väzba.

Vzťah chemická látka – prvok zlúčenina l Definujme molekulu. . . . ?

l Molekula je stavebná častica chemickej látky zložená z 2 alebo viacerých zlúčených atómov. Z molekúl je zložená väčšina chemických látok. Molekula vody

Molekuly l l l Atómy prvkov sú za bežných podmienok zlúčivé, to znamená, že vytvárajú zložitejšie útvarymolekuly. Molekuly sa môžu skladať buď z atómov rovnakého prvku alebo z atómov rôznych prvkov. Existujú : l l molekuly rovnakých prvkov, napr. H 2 , O 3, P 4 , S 8. molekuly rôznych prvkov, napr. H 2 O, NH 3, H 2 SO 4.

l l Všetky chemické látky zložené z atómov 2 – viac prvkov nazývame chemické zlúčeniny. Zlúčeniny rozlišujeme: l l Dvojprvkové (napr. HCl, Na. Cl) Trojprvkové (napr. HNO 3, KOH) Viacprvkové (napr. bielkoviny, tuky) Molekuly a zlúčeniny zapisujeme chemickými vzorcami, napr. Na. Cl, KOH, NH 3 atď.

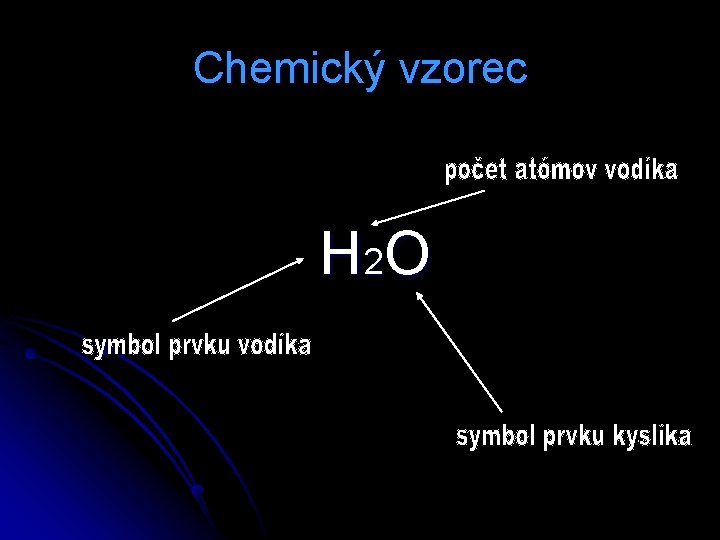
Chemický vzorec H 2 O

Čo udáva vzorec NH 3 ? l Molekula amoniaku je zložená zo 4 viazaných atómov : l jedného atómu dusíka l troch atómov vodíka Je to štvoratómová molekula l Tvoria ju dva rôzne prvky: vodíka a dusík - dvojprvková molekula l

Zopakuj si! • Čo je chemická väzba? Je to sila pútajúca atómy v molekulách. • Podľa čoho možno určiť silu väzby? -Silu väzby charakterizuje väzbová energia - Ev. Je to sila potrebná na rozštiepenie väzby alebo energia, ktorá sa uvoľní pri jej vzniku. Ktorá z väzieb je najpevnejšia? -Ev(Cl-Cl)=243 KJ Ev(H-Cl)= 432 KJ Ev(H-O)= 463 KJ Väzba H-O

Aké sú podmienky vzniku väzby? Podmienky vzniku väzby: l Atómy sa musia priblížiť natoľko, aby nastalo prekrytie ich atómových orbitálov, musia sa zraziť. • Elektróny, ktoré sa na väzbe zúčastňujú, musia mať opačný spin Medzi atómami viazanými chemickou väzbou pôsobia dva druhy síl: • príťažlivé (medzi jadrami a elektrónmi) • odpudivé (medzi jadrami navzájom a elektrónmi navzájom)

Aké druhy chemickej väzby poznáš? • Kovalentná : • Iónová • Kovová polárna nepolárna

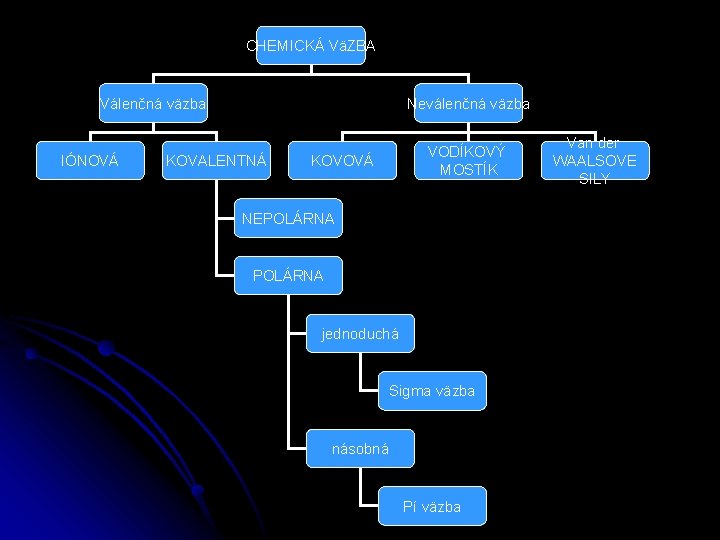
CHEMICKÁ VäZBA Válenčná väzba IÓNOVÁ Neválenčná väzba KOVALENTNÁ VODÍKOVÝ MOSTÍK KOVOVÁ NEPOLÁRNA jednoduchá Sigma väzba násobná Pí väzba Van der WAALSOVE SILY

l Jej podstatou je vytváranie spoločných elektrónových párov. • podľa počtu spoločných elektrónových párov rozlišujeme : • jednoduchú kovalentnú väzbu • dvojitú a trojitú kovalentnú väzbu

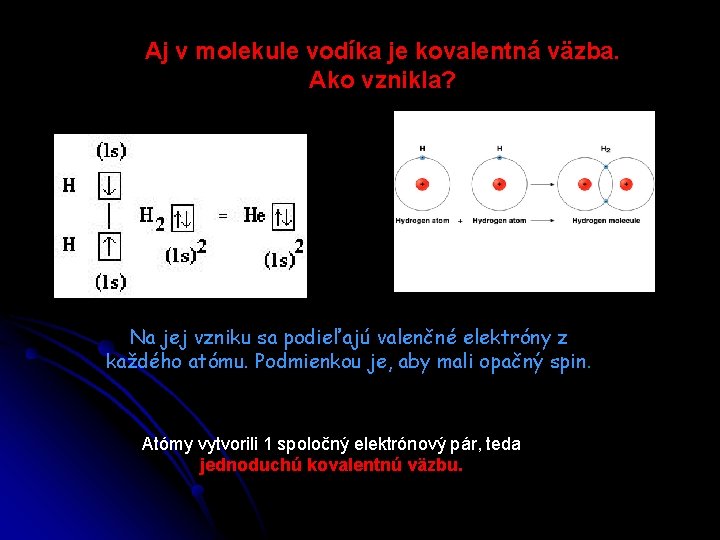
Aj v molekule vodíka je kovalentná väzba. Ako vznikla? Na jej vzniku sa podieľajú valenčné elektróny z každého atómu. Podmienkou je, aby mali opačný spin. Atómy vytvorili 1 spoločný elektrónový pár, teda jednoduchú kovalentnú väzbu.

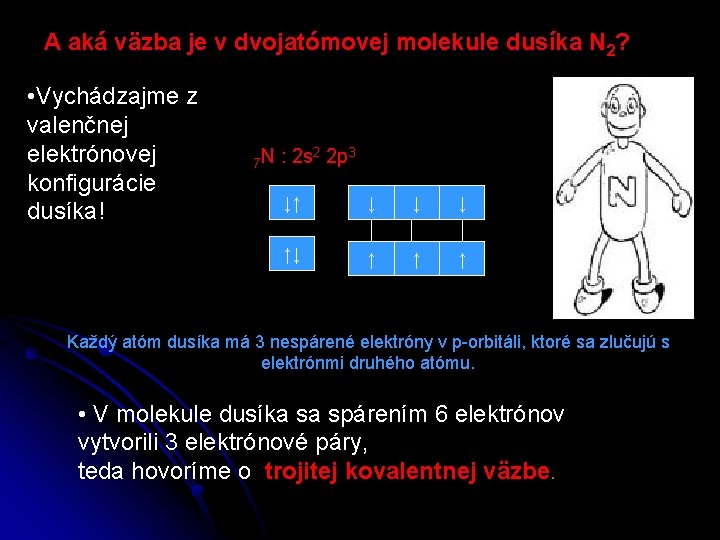
A aká väzba je v dvojatómovej molekule dusíka N 2? • Vychádzajme z valenčnej elektrónovej konfigurácie dusíka! 7 N : 2 s 2 2 p 3 ↓↑ ↓ ↓ ↓ ↑↓ ↑ ↑ ↑ Každý atóm dusíka má 3 nespárené elektróny v p-orbitáli, ktoré sa zlučujú s elektrónmi druhého atómu. • V molekule dusíka sa spárením 6 elektrónov vytvorili 3 elektrónové páry, teda hovoríme o trojitej kovalentnej väzbe.

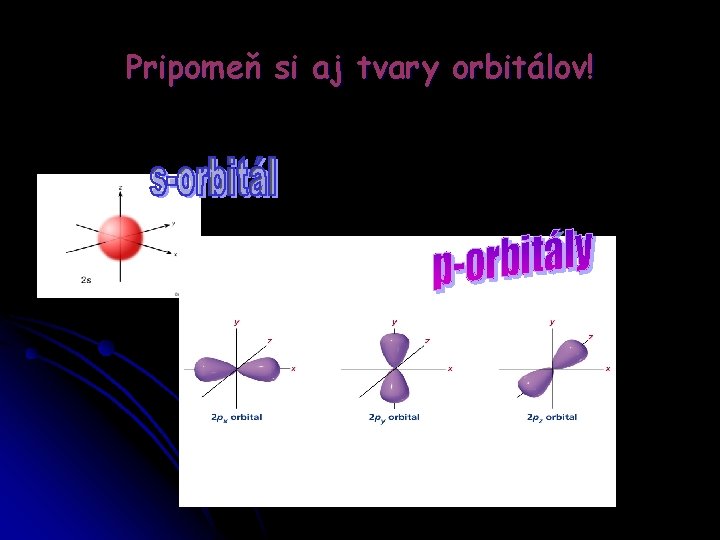
Pripomeň si aj tvary orbitálov!

δ- jednoduchá väzba • Vzniká podobne ako väzba v molekule vodíka • Najväčšia elektrónová hustota je na spojnici jadier viazaných atómov l Vzniká prekryvom orbitálov s-s, s-p a p-p

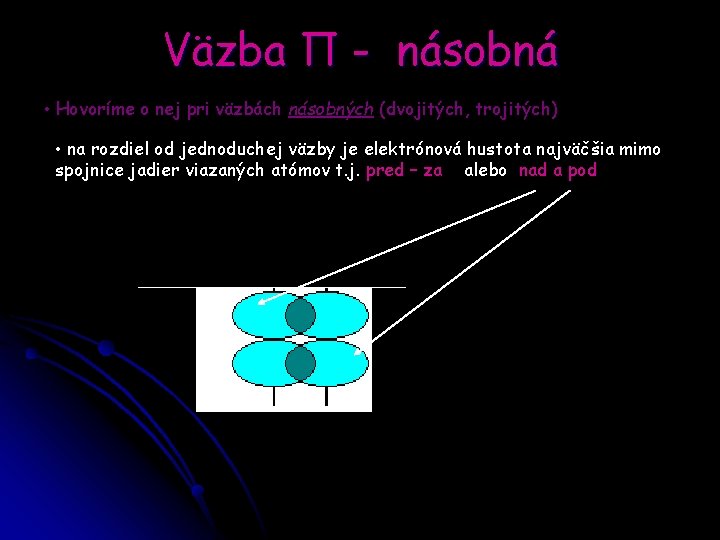
Väzba Π - násobná • Hovoríme o nej pri väzbách násobných (dvojitých, trojitých) • na rozdiel od jednoduchej väzby je elektrónová hustota najväčšia mimo spojnice jadier viazaných atómov t. j. pred – za alebo nad a pod

Ďakujem za pozornosť

















