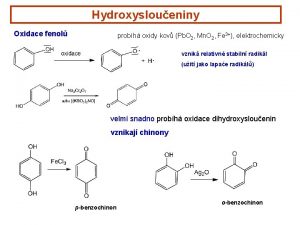
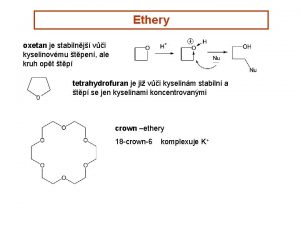
KYSLKAT DERIVTY ETHERY ETHERY kyslkat derivty ke kyslkovmu






![Opětovné uzákonění používání éteru v praxi 16. října 1846 WIKIPEDIA. ORG. [online]. [cit. 17. Opětovné uzákonění používání éteru v praxi 16. října 1846 WIKIPEDIA. ORG. [online]. [cit. 17.](https://slidetodoc.com/presentation_image_h2/fa6b94e305f79ee10ed9ba38102ebe2f/image-11.jpg)



- Slides: 14

KYSLÍKATÉ DERIVÁTY ETHERY

ETHERY = kyslíkaté deriváty, ke kyslíkovému atomu jsou připojeny 2 uhlovodíkové zbytky Funkční skupina: etherová –O– Obecný vzorec: R–O–R´ R, R´ alkyly nebo aryly, R = R´ : ethery jednoduché lineární R = R´ : ethery smíšené O cyklické R 2

Lze je odvodit od hydroxyderivátů nebo vody. Názvosloví Příklad: CH 3 CH 2 – O – CH 2 CH 3 1. systematické: alkoxy + název uhlovodíku • ethoxyethan 2. radikálové: název uhlovodíkového zbytku + ether • diethylether 3. triviální: • éter 3

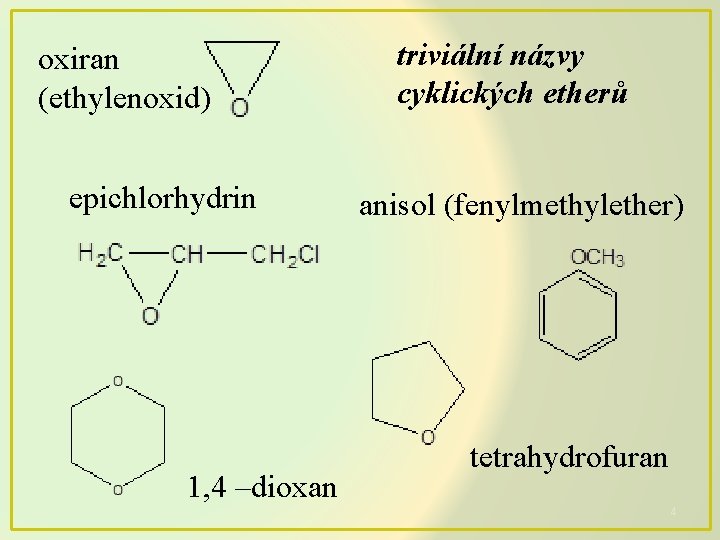
oxiran (ethylenoxid) epichlorhydrin 1, 4 –dioxan triviální názvy cyklických etherů anisol (fenylmethylether) tetrahydrofuran 4

Vlastnosti: • dimethyléter a oxiran – (g), ostatní (l) až (g) • neobsahují –OH, proto netvoří vodíkové můstky • nižší teplota varu, nerozpouštějí se v polárních rozpouštědlech, ve vodě jsou prakticky nerozpustné (výjimka tetrahydrofuran, dioxan) • dobře se rozpouštějí v alkoholech, uhlovodících, halogenderivátech • těkavé patří mezi hořlaviny I. třídy, mají narkotické účinky 5

volné el. na kyslíku umožňují přijímat elektrofilní částice a chovat se jako zásady, např. s kyselinou chlorovodíkovou tvoří oxoniovou sůl (donor akceptorová vazba) CH 3 CH 2 - O - CH 2 CH 3 + HCl [ CH 3 CH 2 - O+- CH 2 CH 3 ] Cl - H diethyloxonium-chlorid

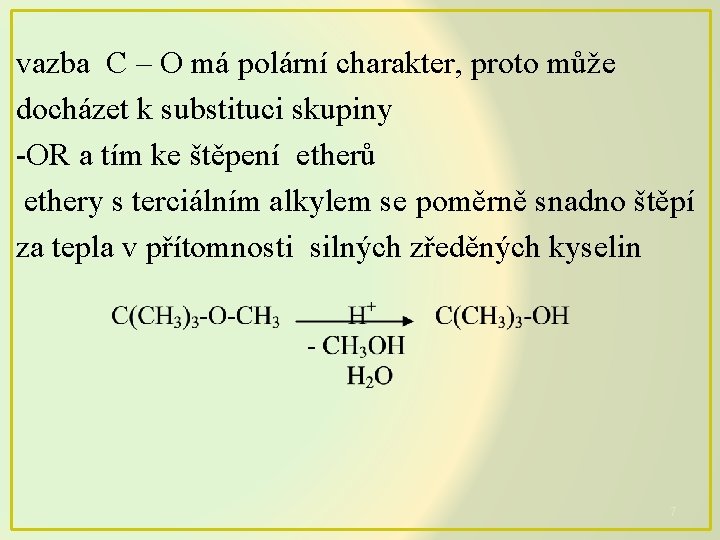
vazba C – O má polární charakter, proto může docházet k substituci skupiny -OR a tím ke štěpení etherů ethery s terciálním alkylem se poměrně snadno štěpí za tepla v přítomnosti silných zředěných kyselin 7

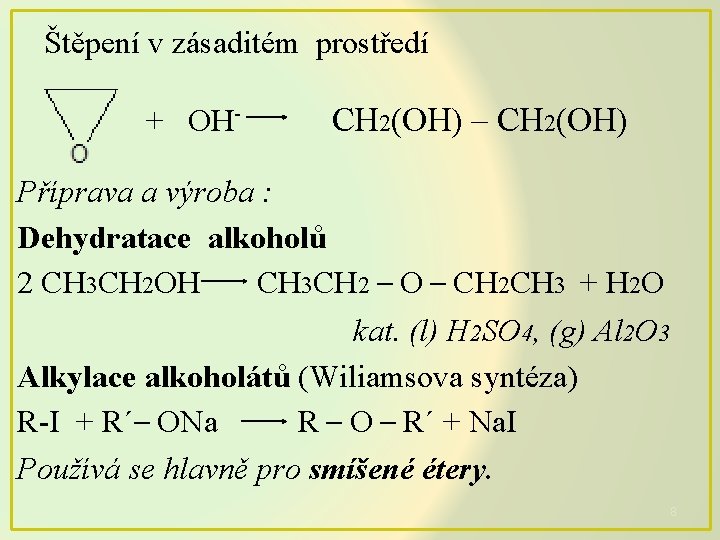
Štěpení v zásaditém prostředí + OH- CH 2(OH) – CH 2(OH) Příprava a výroba : Dehydratace alkoholů 2 CH 3 CH 2 OH CH 3 CH 2 – O – CH 2 CH 3 + H 2 O kat. (l) H 2 SO 4, (g) Al 2 O 3 Alkylace alkoholátů (Wiliamsova syntéza) R-I + R´– ONa R – O – R´ + Na. I Používá se hlavně pro smíšené étery. 8

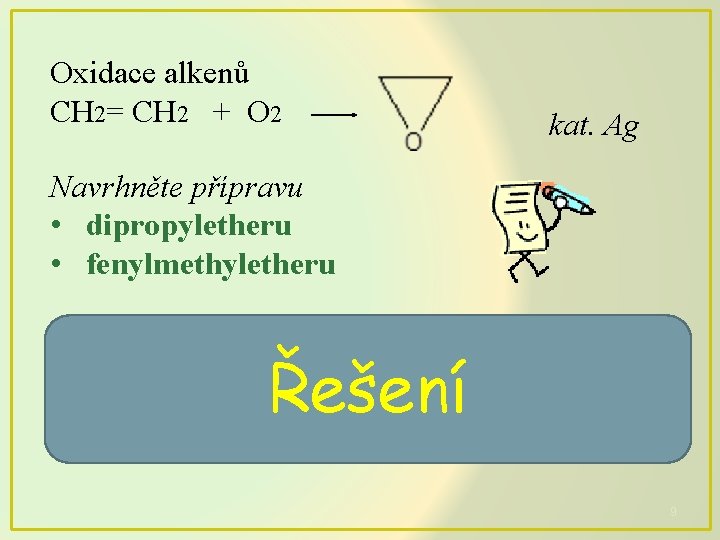
Oxidace alkenů CH 2= CH 2 + O 2 kat. Ag Navrhněte přípravu • dipropyletheru • fenylmethyletheru 2 CH 3 CH 2 OH (CH 3 CH 2)2 O + H 2 O Řešení C H OCH + Na. I CH 3 I + C 6 H 5 ONa 6 5 3 9

Zástupci: Dimethyléter (g), methylační činidlo - výroba dimethylsufátu s oxidem sírovým Diethyléter = „éter“ těkavá kapalina (b. v. 34, 6°C) s narkotickými účinky, ve vodě se rozpouští pouze 7%, rozpouštědlo, páry jsou těžší než vzduch, jsou výbušné, může tvořit výbušný diethylether peroxid, extrakční činidlo, dříve jako anestetikum 10
![Opětovné uzákonění používání éteru v praxi 16 října 1846 WIKIPEDIA ORG online cit 17 Opětovné uzákonění používání éteru v praxi 16. října 1846 WIKIPEDIA. ORG. [online]. [cit. 17.](https://slidetodoc.com/presentation_image_h2/fa6b94e305f79ee10ed9ba38102ebe2f/image-11.jpg)
Opětovné uzákonění používání éteru v praxi 16. října 1846 WIKIPEDIA. ORG. [online]. [cit. 17. 5. 2014]. Dostupné z: http: //upload. wikimedia. org/wikipedia/commons/4/4 b/Southworth_%26_Hawes__First_etherized_operation_%28 re-enactment%29. jpg

Oxiran (ethylenoxid) bezbarvý, hořlavý, snadno zkapalnitelný plyn, velmi reaktivní, jedovatý, dobře rozpustný ve vodě i v organických rozpouštědlech používá se k výrobě glykolu, lepidel, tenzidů, rozpouštědel (ethanolaminy), … 12

Anisol ( fenylmethylether ) bezbarvá kapalina s příjemnou anýzovou vůní, hlavní součást anýzového oleje, výroba parfémů 1, 4 –dioxan prudce jedovaté rozpouštědlo vzniká dimerizací oxiranu (kyselé prostředí, voda) Znázorněte vznik schématicky rovnicí: Rovnice 13

Zdroje: JANECZKOVÁ, Anna a Pavel KLOUDA. Organická chemie. 2001. vyd. Ostrava: Pavel Klouda, 1998, 154, [1] s. ISBN 80 -902 -1556 -4 http: //cs. wikipedia. org/wiki/Diethylether [21. 2. 2013] Úvodní obrázek: http: //officeimg. vo. msecnd. net/enus/images/MH 900439090. jpg [26. 2. 2013] Klipart: http: //officeimg. vo. msecnd. net/enus/images/MH 900356604. gif [26. 2. 2013] 14