HDROSFR I II Loengud 10 11 20 ja
























- Slides: 29

HÜDROSFÄÄR I, II Loengud 10 - 11 20. ja 27. aprill 2007

Üldist hüdrosfäärist Hüdrosfäär on katkendlik kiht Maa atmosfääri ja litosfääri vahel, tahke ja vedel vesi. Kogumass on 1, 4. 1021 kg = 1, 4. 1018 tonni ~3/4 maismaast on mered ja ookeanid. (Elu ookeaani põhjas erineb tunduvalt elust ookeani pindkihtides Sügavaim koht hüdrosfääris on ~11 kilomeetrit - Mariani süvik Vaikses ookeanis) ~97 % maailmamere vesi, 2 % mandrijää 0, 4 % siseveekogude vesi Vee uurimisega on seotud keskkonakeemia, hüdroloogia, limnoloogia, okeanoloogia

HÜDROSFÄÄRI KEEMIA … on määratud vee molekuli füüsikalis-keemiliste omadustega ja piirpindade atmosfäär/hüdrosfäär ning litosfäär/hüdrosfäär keemiaga Olulised on ka veekogude füüsikalised omadused, nagu läbipaistvus UV-kiirtele, temperatuur, turbulents Turbulents – keeriseline liikumine (vedelikes, gaasides)

Vee molekuli füüsikalis-keemilised omadused 1) polaarne molekul, dipoolmoment on D = 1, 84 D (suhteline laeng hapnikul on -0, 34 ja kummalgi vesinikul +0, 17) (Elektronegatiivsuste erinevus O ja H vahel on määrav. Hapnik tahab e- enam kui vesinik) 2) moodustab vesiniksidemeid ja esineb dimeeridena (H 2 O)2, trimeeridena (H 2 O)3 ja stabiilsed on ka klastrid (H 2 O)20, (H 2 O)280 3) allub autoprotolüüsile H 2 O + H 2 O = H 3 O+ + OH– (H 3 O+ on oksoonium-ioon) (OH– on hüdroksüülioon)

Vee molekuli omadusi Vee molekulis on nurk α kahe H vahel O-H sideme pikkus l Dielektriline konstant ε Ionisatsiooni energia Eion Dissotsiatsiooni energia Edis Vee tihedus d 4 d 0 d 25 d 100 Sulamissoojus (0˚ C) Aurumissoojus (25˚C) Aurumissoojus (100˚C) 104, 50 (kraadi) 0, 9 Ǻ ~80 12, 62 e. V (k. J/mol ? ) 5, 13 e. V (k. J/mol? ) 1, 000 g/cm 3 0, 99987 g/cm 3 0, 99707 g/cm 3 0, 95838 g/cm 3 ΔHtv = +6, 01 k. J/mol ΔHva = 44, 1 k. J/mol ΔHva = 40, 67 k. J/mol

Mõisteid seoses veega Hüdrofiilne - vett "armastav“, polaarsed ühendid Nukleofiilne on tuuma, ka prootonit, "armastav". Alused on nukleofiilsed reagendid (OH–). Elektrofiilne on elektroni (elektronpaari) "armastav" reagent (H+, Fe 3+) Hüdrofoobne - vett "eemale tõukav“, mittepolaarsed ühendid Benseen, alifaatsed süsivesinikud nagu metaan, propaan, butaan, pentaan jne on hüdrofoobsed reagendid, . ---------------------------- Steariinhappe CH 3(CH 2)16 COOH pikk süsinike ahel CH 3(CH 2)16– ehk C 17 H 35– on hüdrofoobne osa molekulist, ei lahustu vees, karboksüülrühm –COOH on hüdrofiilne osa molekulist, lahustub vees.

Veel mõisteid Hüdrolüüs - lahustunud aine ja vee vaheline reaktsioon vähedissotsieeruva või raskesti lahustuva ühendi tekkega CH 3 COONH 4 + H 2 O = CH 3 COOH + NH 4 OH Elektrolüüt - aine, mis vees lahustumisel annab ioone (laetud osakesi) ja seega suurendab vee elektrijuhtivust Na. Cl (t) + aqua (vesi) = Naaq+ + Claq elektrolüütiline dissotsiatsioon Lahustuvuse "kuldreegel" - sarnane lahustub sarnases. Polaarne aine lahustub polaarses lahustis (alkohol vees). Mittepolaarne aine lahustub mittepolaarses lahustis (propaan C 3 H 8 benseenis C 6 H 6).

Hüdrateerunud ioonide suurused Katioonid Na+ r = 95 pm K+ r = 113 pm Na+(aq) r = 276 pm K+(aq) r = 232 pm Suurema ionisatsioonipotentsiaaliga Na (3 -s periood, 3 elektonkihti, tuumalaeng 23) hoiab kõvemini väliselektrone kui väiksema ionisatsioonipotentsiaaliga K (4 -s periood, 4 elektronkihti, tuumalaeng 39). Hüdrateerumisel on tuumalaeng on määrav +39 (K) tõmbab enam vee dipooli negatiivset poolt kui +23 (Na)

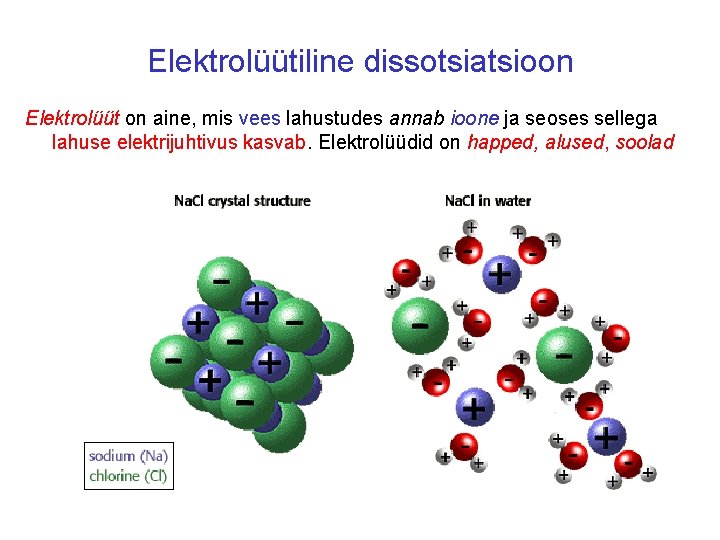
Elektrolüütiline dissotsiatsioon Elektrolüüt on aine, mis vees lahustudes annab ioone ja seoses sellega lahuse elektrijuhtivus kasvab. Elektrolüüdid on happed, alused, soolad

VEE TARBIMINE I. 1900. a. tarbiti ühe inimese kohta ööpäevas USA-s 1990 2005 ~ 40 liitrit vett ~600 liitrit vett (olme+aedade, muru kastmine) ~200 liitrit isiklikuks tarbeks (ei arvestata kastmist) ~8 000 liitrit kogutarbimine II. Tooraine allikas soolad metallid mittemetallid 46 % põllumajandus 46 % tööstusvajadused 8 % munitsipaal + olme Na. Cl, Mg. Cl 2, Na 2 SO 4 U, Mg, Mn J 2, Cl 2, Br 2

VEE KAREDUS …Ca 2+, Mg 2+, Fe 2+ ioonide olemasolu vees (Fe annab pruuni värvi) Mööduv karedus, keetmisega saab pehmendada: Ca(HCO 3)2 Ca. CO 3 + H 2 O + CO 2, Reaktsiooni vaba energia muut ΔG = ΔH - TΔS ΔH > 0, ΔS>0 ΔG<0, kui TΔS>ΔH, st reaktsioon toimub ainult kõrgel temperatuuril, keetmisel

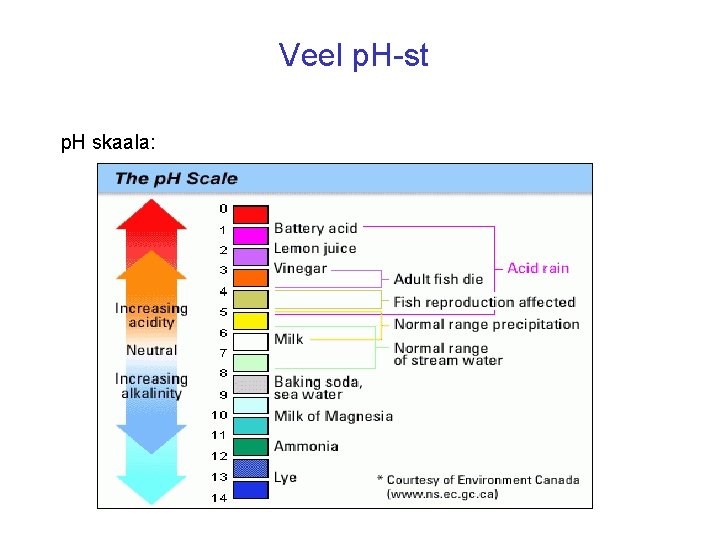
SOOLSUS JA HAPPELISUS Merevesi on soolane Soolsus - 1 kilogrammis merevees olevate kuivade soolade hulk grammides. Baltimere soolsus on ~0, 5 % ehk 5 ‰ (promilli) (1 kg H 2 O - 5 g sooli) Ookeanivee soolsus on kuni 3, 5 % (35 ‰) (1 kg H 2 O - 35 g sooli) NB! Kõige soolasem looduslik vesi maakeral on Vahemeres Kreeta ranniku lähedal. 3, 6 km sügavusel meresüvikus on vesi 3 korda soolasem kui tavaline ookeanivesi, ~10 % (põhiliselt Mg. Cl 2). Merevesi on aluseline so [OH–] > [H+] p. H = 7, 5 - 8, 5 (p. H = log [H+])

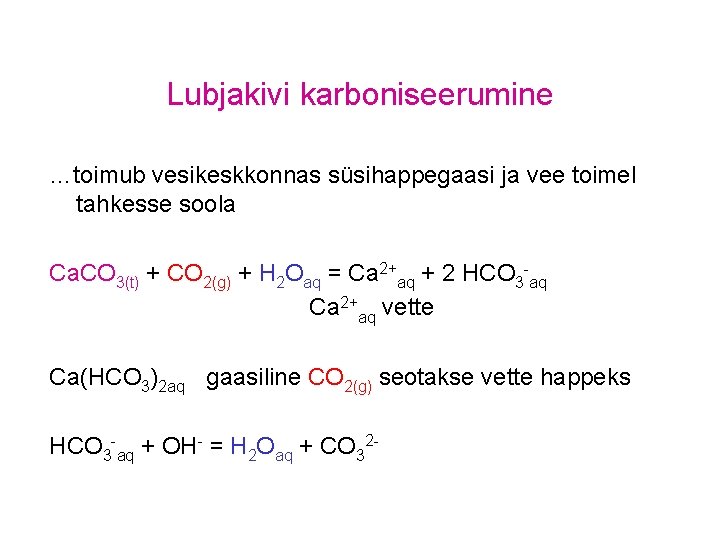
Lubjakivi karboniseerumine …toimub vesikeskkonnas süsihappegaasi ja vee toimel tahkesse soola Ca. CO 3(t) + CO 2(g) + H 2 Oaq = Ca 2+aq + 2 HCO 3 -aq Ca 2+aq vette Ca(HCO 3)2 aq gaasiline CO 2(g) seotakse vette happeks HCO 3 -aq + OH- = H 2 Oaq + CO 32 -

VEE ALUSELISUS …. . so võime haarata H+-ioone (p. H>7) Merevesi on aluseline, järelikult selles peavad vees olema ioonid OH , CO 32 , HCO 3 OH + H H 2 O CO 32 + H HCO 3 ; HCO 3 + H CO 2 + H 2 O Al 3 on merevees hüdrateerunud Al(H 2 O)63 , hüdrateerunud ioon Al(H 2 O)63 annab vees ära prootoni H (H 2 O)6 (H 2 O)5(OH ) + H Al(H 2 O)63 + H 2 O Al(H 2 O)5 OH 2 + H 3 O

Veel p. H-st p. H skaala:

KEEMILISED ELEMENDID MEREVEES Element Kontsentratsioon, g/m 3 Põhikuju (katioon +, anioon -) kloor Cl 18 980 naatrium Na 10 540 magneesium Mg 1 270 väävel S 2 460 kaltsium Ca 400 kaalium K 380 broom Br 65 süsinik C 28 strontsium Sr 8 boor B 20 räni Si 3 fluor F 1, 3 argoon Ar 0, 6 lämmastik N 0, 6 jood I 0, 06 raud Fe 0, 01 alumiinium Al 0, 01 Cl– Na+ Mg 2+, [Mg. SO 4] SO 42– , HSO 4 – Ca 2+, [Ca. SO 4] K+ Br – HCO 3 –, CO 32 –, CO 2 Sr 2+ B(OH)3, [B(OH)4] – Si(OH)4, Si(OH)3 O – F –, Mg. F+ Ar NO 3 –, NO 2 –, NH 4�+, N 2 I–, IO 3– Fe(OH)2+, Fe(OH)4– Al(OH)4–

Ühendeid merevees Heitvetega satub merre pestitsiide ja väetisi. Tulemuseks vetikate vohamine, mis takistab päikesekiirguse toimel toimuvat fotosünteesi. Hapnik-süsihappegaas vahekord muutub - loomsetel organismidel ei jätku hapnikku. Merevette satub heitvetega ka toksilisi ühendeid, näiteks dimetüülelavhõbedat (CH 3)2 Hg. 3500 m sügavusel on leitud freoone (metaani Cl ja F derivaate, so CFC=Chloro. Fluoro. Carbons) kontsentratsioonis ~5 pikomooli/kg (5. 10– 12 mooli/kg)

HAPNIK VEES Vees lahustunud hapnik O 2 (LH) 25 C 0 C 8, 32 mg/l 14, 74 mg/l Kalad ja teised mereorganismid kasutavad hingamiseks umbes 4 -5 mg/l hapnikku Vee biokeemiline hapniku tarve (BHT)- hapniku hulk, mis on vajalik 1) veetaimede lagundamiseks pärast nende "surma" ja 2) mikroorganismide, mis sattusid vette heitvetega, lagundamiseks Puhas vesi Väga reostunud vesi BHT < 30 mg/l BHT > 100 mg/l

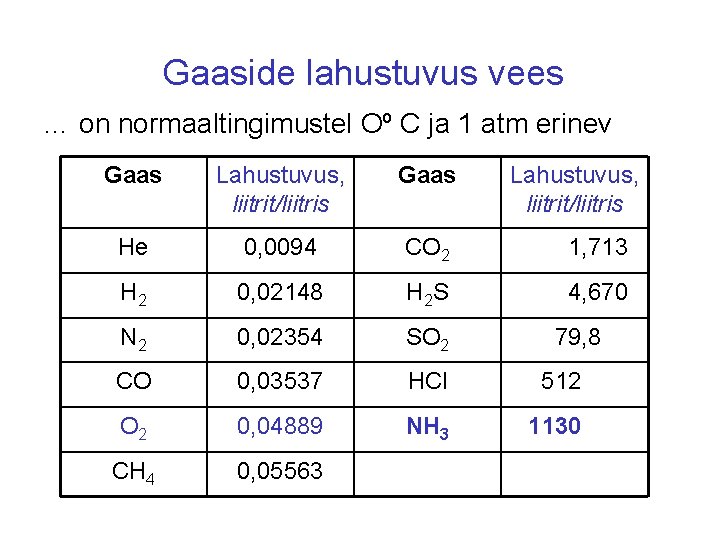
Gaaside lahustuvus vees … on normaaltingimustel Oº C ja 1 atm erinev Gaas Lahustuvus, liitrit/liitris He 0, 0094 CO 2 1, 713 H 2 0, 02148 H 2 S 4, 670 N 2 0, 02354 SO 2 79, 8 CO 0, 03537 HCl 512 O 2 0, 04889 NH 3 1130 CH 4 0, 05563

KEEMILISI REAKTSIOONE MEREVEES Pb. S +2 O 2 Pb. SO 4 Redoksreaktsioon S 2– - 8 e S 6+ 4 O 0 + 8 e 4 O 2 – väävel oksüdeerub hapnik taandub (OA oli – 2, muutus +6) (OA oli 0, muutus -2) Redoksreaktsioonid on reaktsioonid, kus keemiliste elementide oksüdatsiooniaste (OA) muutub – OA suureneb, kui oksüdeerub ja väheneb, kui redutseerub. Järgneb hüdrolüüs vees: Pb. SO 4 + 2 H 2 O Pb(OH)2 + SO 42 – + 2 H+ vee aluselisus väheneb Püriit merevees (summaarne reaktsioon) 4 Fe. S 2 + 15 O 2 + 14 H 2 O 4 Fe(OH)3 + 8 SO 42 – + 16 H+

Keemilisi reaktsioone vees Elu merevees on otsese sõltuvuses fütoplanktoni fotosünteesist merepinna läheduses päikesekiirguse toimel. Fütoplankton jaoks on empiirilise valem C 106(H 2 O)106(NH 3)16 PO 4 Saadakse fotosünteesiks vajalike CO 2, H 2 O ja väetiste koosmõjul: 106 CO 2 + 122 H 2 O + 16 HNO 3 + H 3 PO 4 = (CH 2 O)106(NH 3)16 H 3 PO 4 + 138 O 2 Fütoplankton – taimne hõljum, vees hõljuvate taimsete organismide kogum. Sinivetikad tekivad sarnaselt, kui palju väetisi merre…

MEREPÕHJA KEEMIA Merevee koostis sõltub biogeokeemilistest protsessidest, lahustunud ained - tahkesse olekusse. Merepõhja tahke koostis sõltub geograafilisest asukohast. Lisaks suubub merre voogudena tahkeid aineid, neist suurem osa on savimineraalid – illiit, kaoliniit, montmorilloniit, kloriit (Al 2 Si 2 O 5(OH)4 – kaoliniit, kahekihiline) Si. O 2 (s) + 2 H 2 O = H 4 Si. O 4 Al 2 O 3. 3 H 2 O (s) + 2 H 2 O = 2 Al(OH)4– + 2 H+ (gibbsiidi reaktsioon) Ca 5(PO 4)3(OH) (s) + 3 H 2 O = 5 Ca 2+ + 3 HPO 42– + 4 OH– (apatiidi reaktsioon) Kivimid magnesiit Mg. CO 3, hematiit Fe 2 O 3, püriit Fe. S, galeniit Pb. S, dolomiit Ca. Mg(CO 3)2, lubjakivi Ca. CO 3 mere põhjas

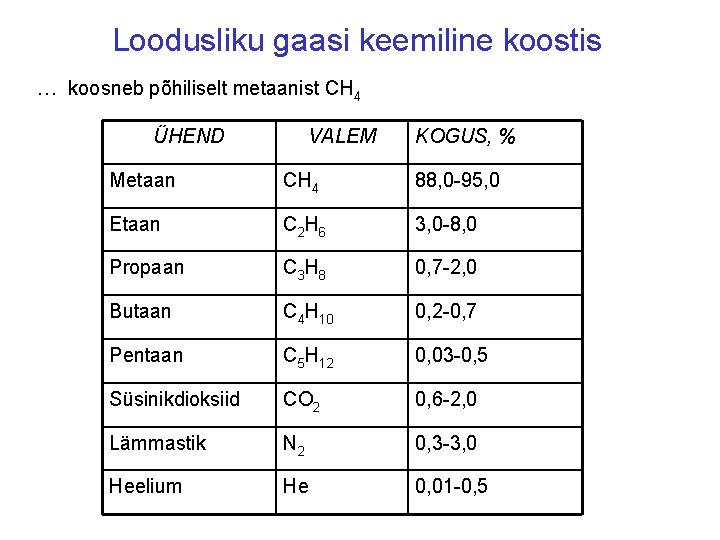
Loodusliku gaasi keemiline koostis … koosneb põhiliselt metaanist CH 4 ÜHEND VALEM KOGUS, % Metaan CH 4 88, 0 -95, 0 Etaan C 2 H 6 3, 0 -8, 0 Propaan C 3 H 8 0, 7 -2, 0 Butaan C 4 H 10 0, 2 -0, 7 Pentaan C 5 H 12 0, 03 -0, 5 Süsinikdioksiid CO 2 0, 6 -2, 0 Lämmastik N 2 0, 3 -3, 0 Heelium He 0, 01 -0, 5

Aeroobsed ja anaeroobsed protsessid hüdrosfääris Aeroobne – hapniku (õhu) juuresolekul, hüdrosfääri pinnakihtides aeroobne hingamine 1/4 “CH 2 O” + 1/4 O 2 = 1/4 CO 2 + 1/4 H 2 O Anaeroobne – ilma õhu (hapniku) juurdepääsuta, mere põhjas anaeroobne hingamine 1/4 “CH 2 O” = 1/8 CO 2 + 1/8 CH 4 1/4 “CH 2 O” +1/4 H 2 O = 1/4 CO 2 + 1/2 H 2 (CH 2 O)106(NH 3)16 H 3 PO 4 +84, 8 HNO 3 → 106 CO 2 + 148, 8 H 2 O + 42, 4 N 2 + 16 NH 3 + H 3 PO 4

Merepõhja ja merepinna keemilise koostise erinevus Pinnavees on oksüdatsiooniaste keemilistel elementidel suurem, hapnik kui oksüdeerija “tegutseb”: O 2, CO 2, NO 3–, SO 42–, Fe(OH)3, Mn. O 2 Orgaanika aeroobne lagunemine: {C, H, O, N, S, P} + O 2 CO 2, H 2 O, NO 3–, SO 42–, HPO 4– ---------------------------------------------------------- Põhjavees on keemilised elemendid taandatud vormis OA on väike), oksüdatsiooni aste väiksem, kuna puudub hapnik, mis oksüdeeriks: CH 4, NH 4+, H 2 S, Fe(OH)2, Mn. O Orgaanika anaeroobne lagunemine: {C, H, O, N, S, P} CH 4, H 2 O, NH 4+, H 2 S, PH 3, NH 3 jne

Looduslik gaas (maagaas, soogaas, kaevandusgaas) Metaani CH 4 teke fermentide abil (lagunevast orgaanikast): 1/4 “CH 2 O” = 1/8 CO 2 + 1/8 CH 4 Metaani põlemine: 1) CH 4 + 2 O 2 = CO 2 + 2 H 2 O täielik põlemine 2) 2 CH 4 + 3 O 2 = 2 CO + 4 H 2 O mittetäielik põlemine 3) CH 4 + O 2 = Ctahm + 2 H 2 O mittetäielik põlemine Metaani ja hapniku suhe 1) 1: 2 2) 2: 3 3) 1: 1. Mida vähem hapnikku, seda enam tahma

Küllastunud süsivesinike (Cn. H 2 n+2) faasilised olekud CH 4 C 2 H 6 C 3 H 8 C 4 H 10 C 8 H 18 metaan propaan butaan oksaan Cn. H 2 n+2 gaasilised ühendid NAFTA C 5 H 12 C 6 H 14 C 7 H 16 C 8 H 18 C 9 H 20 C 10 H 22 pentaan heksaan heptaan oktaan nonaan dekaan C 5 - C 70 alkaanid + tsükloalkaanid vedelikud (bensiin) Alates C 16 H 34 C 17 H 36 steariin kuni C 70 H 142 on tahked nafta komponendid

Orgaanilised ühendid 5 põhiklassi 1) SÜSIVESINIKUD ‘CH’ 2) SÜSIVESIKUD {CH 2 O} 3) RASVAD ehk lipiidid 4) VALGUD ehk peptiidid ehk proteiinid {C, H, O, N} peptiidne side -C-N 20 erinevat amiinohapet, miljonite valkude aluseks. Amiinohappeid tähistatakse 3 -tähelise kombinatsiooniga 5) NUKLEIINHAPPED ehk nukleotiidid {C, H, O} {C, H, O, N, P, S}

Funktsionaalsed rühmad orgaanikas 1. 2. 3. 4. 5. 6. 7. 8. Hüdroksüülrühm Amiinorühm Karboksüülrühm Aldehüüdirühm Ketorühm Metüülrühm Fosfaatrühm Nitrorühm -OH alkohol -NH 2 amiin -COOH karboksüülhape -CHO aldehüüd -CO ketoon -CH 3 metüül… -PO 4 …. fosfaat -NO 2 nitro… R-OH R-NH 2 R-COOH R-CHO R 1 -C(O)-R 2 R-CH 3 R-PO 4 RNO 2 Veel N-sisaldavaid orgaanilisi ühendeid looduses Nitroosamiin (R 1 R 2)N-N=O, karbamiid (NH 2)2 CO, aniliinvärv NH 2 C 6 H 5 (amiinobenseen), atsetonitriil CH 3 CN







