Corso di Laurea in LOGOPEDIA corso integrato FISICA







- Slides: 11

Corso di Laurea in LOGOPEDIA corso integrato FISICA - disciplina FISICA MEDICA TEMPERATURA E CALORE - TEMPERATURA - ENERGIA INTERNA - CALORE E CALORE SPECIFICO - LAVORO IN TERMODINAMICA - TRASFORMAZIONI TERMODINAMICHE - TRASFORMAZIONI DI STATO TEMPERATURA E CALORE 1

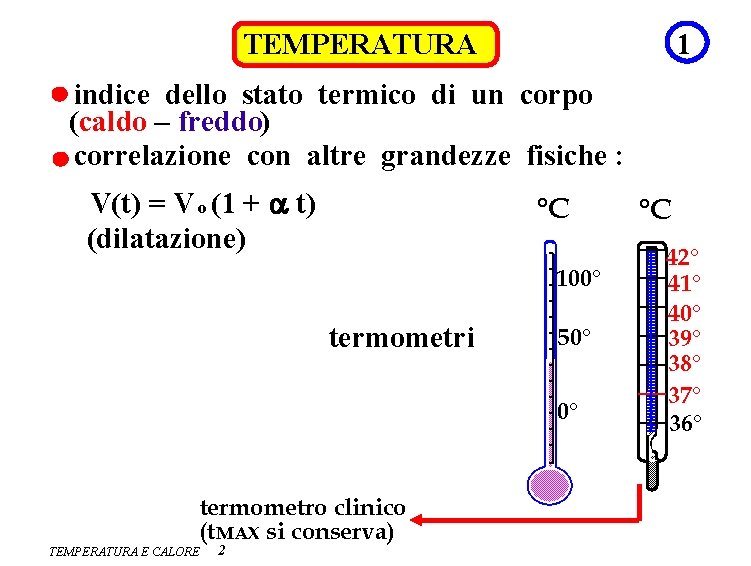
1 TEMPERATURA indice dello stato termico di un corpo (caldo – freddo) correlazione con altre grandezze fisiche : V(t) = V o (1 + a t) (dilatazione) °C 100° termometri 50° 0° termometro clinico (t MAX si conserva) TEMPERATURA E CALORE 2 °C 42° 41° 40° 39° 38° 37° 36°

TEMPERATURA 2 scale di temperatura °C °F °K CELSIUS (°C) 0° 100° H 2 O 200° 400° KELVIN (°K) 100° 212° 373° T (°K) = t (°C) + 273° 300° 0° 32° 273° – 100° 200° – 148° – 200° 100° – 328° – 273° 0° – 459. 4° FAHRENHEIT 9 t (°F) = 32° + t (°C) 5 t T scale centigrade EQUILIBRIO TERMICO Dt º DT = 0 TEMPERATURA E CALORE 3

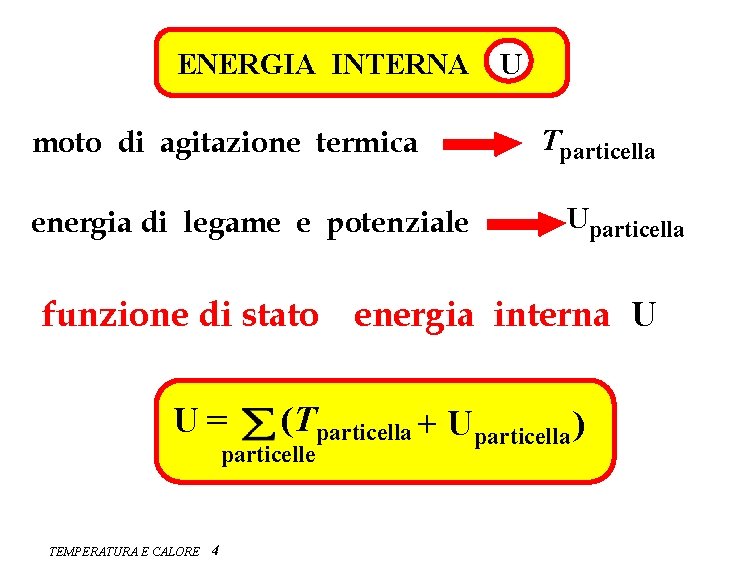
ENERGIA INTERNA moto di agitazione termica energia di legame e potenziale U Tparticella Uparticella funzione di stato energia interna U U= (Tparticella + U particella ) particelle TEMPERATURA E CALORE 4

CALORE temperatura t, T : indice stato termico di un corpo calore Q : forma di energia travaso energia interna tra corpi unità di misura pratica : caloria (cal) 1 g H 2 O 14. 5°C 15. 5°C 1000 cal = 1 kcal = 1 Cal equivalente termico del lavoro J J = L = 4. 18 joule cal – 1 Q L = J Q(caloria) L = Q(joule) TEMPERATURA E CALORE 5

CALORE SPECIFICO Q = c m (t 2 – t 1) = c m Dt calore specifico capacità termica Q c = m (t – t ) [cal g – 1 °C– 1] 2 1 TEMPERATURA E CALORE 6 1

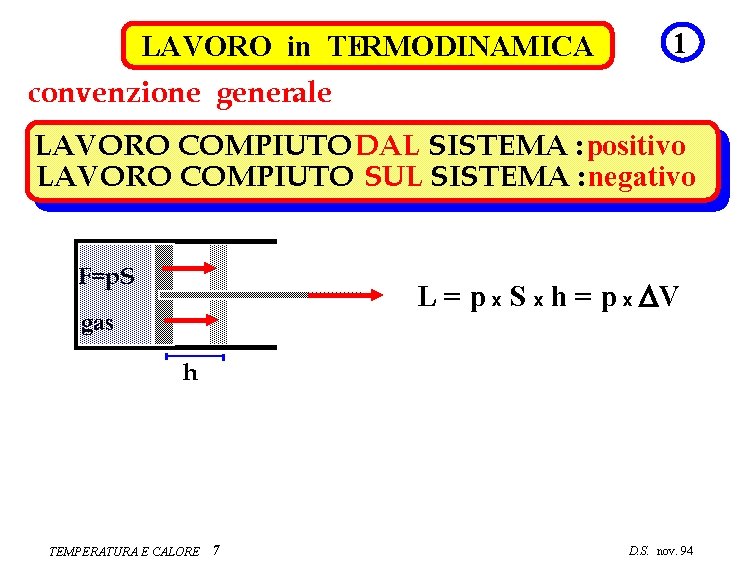
LAVORO in TERMODINAMICA 1 convenzione generale LAVORO COMPIUTO DAL SISTEMA : positivo LAVORO COMPIUTO SUL SISTEMA : negativo F=p. S L = p x S x h = p x DV gas h TEMPERATURA E CALORE 7 D. S. nov. 94

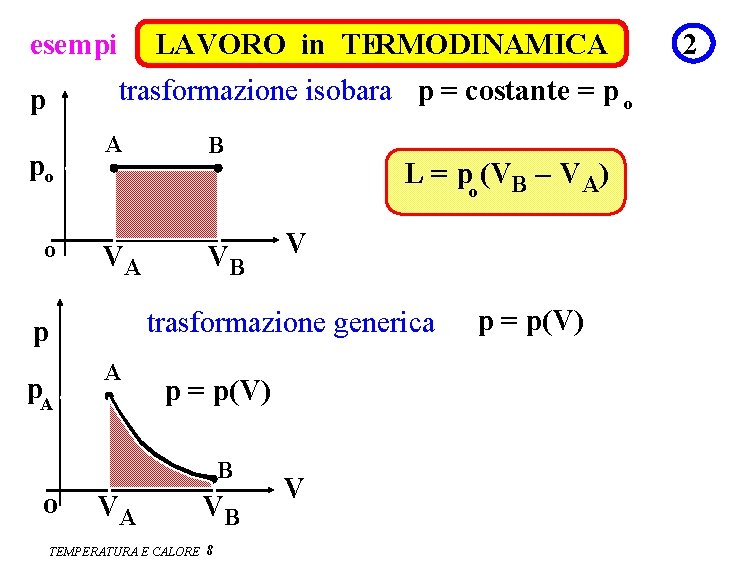
esempi LAVORO in TERMODINAMICA trasformazione isobara p = costante = p o p po o A B VA VB L = po (VB – V A) V trasformazione generica p p. A A p = p(V) B o VA VB TEMPERATURA E CALORE 8 V p = p(V) 2

TERMODINAMICA N o = 6. 02 10 23 1 formulazione fenomenologica formulazione statistica SISTEMA TERMODINAMICO [macrostato] STATO TERMODINAMICO PARAMETRI TERMODINAMICI scambio no materia - no energia SISTEMA ISOLATO no materia - si energia SISTEMA CHIUSO EQUILIBRIO (DINAMICO) : parametri termodinamici costanti nel tempo microstato noti tutti i parametri delle particelle che compongono il sistema termodinamico TEMPERATURA E CALORE 9

TERMODINAMICA trasformazioni termodinamiche parametri termodinamici tornano CHIUSA ai valori iniziali parametri termodinamici non tornano APERTA ai valori iniziali REVERSIBILE successione stati di equilibrio (trasformazione ideale) IRREVERSIBILE successione stati non di equilibrio (trasformazione reale) ISOTERMA a temperatura costante ISOCORA a volume costante ISOBARA a pressione costante ADIABATICA sistema termicamente isolato (niente scambio di calore) TRASFORMAZIONI DI STATO PROCESSI CHIMICI, BIOCHIMICI TEMPERATURA E CALORE 10 2

TRASFORMAZIONI DI STATO FUSIONE Q = kf m T = costante kf = calore latente di fusione EVAPORAZIONE Q = ke m T= costante ke = calore latente di evaporazione H 2 O ke = 606. 5 – 0. 695 t cal g – 1 ( 0°C 100°C ) tensione di vapore º p di vapore saturo p vapore saturo = p esterna EBOLLIZIONE TEMPERATURA E CALORE 11



















