Chemie Klein kleiner Atome ALLE STOFFE SIND AUS








- Slides: 9

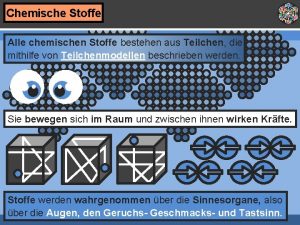
Chemie Klein – kleiner Atome ALLE STOFFE SIND AUS WINZIG KLEINEN ATOMEN AUFGEBAUT. MIT DIESEM WISSEN KANN MAN DEN AUFBAU DER STOFFE UND CHEMISCHE REAKTIONEN ERKLÄREN.

Chemie Klein – kleiner - Atome Einem Stück Eisen sieht man nicht an, dass es aus winzig kleinen Teilchen besteht. Beim Feilen erhält man Eisenspäne. In Gedanken kann man Eisenspäne immer weiter zerteilen. Es gibt jedoch ein kleinstes Teilchen, das sich nicht mehr teilen lässt. Demokrit und der Begriff des Atoms Dass es unteilbare kleinste Teilchen gibt vermutete schon vor über 2000 Jahren der griechische Philosoph DEMOKRIT. Er nannte sie Atome. Lange Zeit war DEMOKRITS Idee vergessen. Vor etwa 200 Jahren konnte jedoch der Naturforscher JOHN DALTON beweisen, dass es tatsächlich Atome gibt. Das griechische Wort „atomos“ bedeutet „unteilbar“.

Chemie Klein – kleiner - Atome Das Atommodell von DALTON JOHN DALTON stellte sich die Atome so vor: - Alle Stoffe bestehen aus kleinsten, kugelförmigen Teilchen: den Atomen. - Atome kann man weder erzeugen noch zerstören. Sie sind unteilbar. - Unterschiedliche Atome haben verschiedene Massen und Durchmesser. - Alle Atome mit gleicher Masse und Durchmesser gehören zum selben Element. Weil es keine halben Atome gibt, konnte er erklären, warum die Mengenverhältnisse bei einer chemischen Reaktion immer gleich sind. Z. B. reagiert ein Sauerstoff-Atom mit genau zwei Wasserstoff-Atomen zum H 2 O-Molekül.

Chemie Klein – kleiner - Atome Welche Masse hat ein Atom? DALTON kannte die Masse der Atome nicht. Er stellte aber fest, dass das Wasserstoff-Atom die kleinste Masse hat. Die Masse anderer Atome berechnete er als Vielfache davon. Weil z. B. 16 g Sauerstoff mit 2 g Wasserstoff zu 18 g Wasser reagieren, muss das Sauerstoff-Atom die 16 -fache Masse haben. Heute kennt man die Masse der einzelnen Atome. Zur Vereinfachung gibt man sie in der atomaren Masseneinheit u an, das ist etwa die Masse des Wasserstoff-Atoms: Atomare Masseneinheit u: 1 u = 0, 000 000 0017 g = 1, 7 x 10 -24 g

Chemie Klein – kleiner - Atome Wie groß ist ein Atom? Atome sind so winzig klein, dass man sie mit einem normalen Mikroskop nicht erkennt. Erst seit der Erfindung des Raster-Tunnelmikroskops kann man einzelne Atome sichtbar machen. Trotzdem kennt man schon lange ihren Durchmesser: je nach Element etwa 0, 000 000 1 m = 10 -10 m. Eine „Kette“ aus 10 Milliarden Atomen wäre nur 1 m lang Info: Das Raster-Tunnelmikroskop macht einzelne kugelförmige Atome sichtbar. Eine feine Nadel tastet eine Metall-Oberfläche ab. Daraus erzeugt der Computer ein räumliches Bild.

Chemie Klein – kleiner - Atome Merke: Jeder Stoff besteht aus kleinsten Teilchen. Man nennt sie Atome. Das Wasserstoff-Atom ist das kleinste Atom mit der kleinsten Masse. Das Raster-Tunnelmikroskop macht einzelne Atome sichtbar.

Chemie Klein – kleiner - Atome Tabelle: Massen einiger Atome in der atomaren Masseneinheit

Chemie Klein – kleiner - Atome Videos zur aktuellen PPP: https: //www. youtube. com/watch? v=k. D_Cl. TRc. QRQ https: //www. youtube. com/watch? v=Ws. PCF 6 bj. R 8 k Videos zur aktuellen PPP und zu nachfolgenden PPP: https: //www. youtube. com/watch? v=v. BXa. INQwp. Z 0 https: //www. youtube. com/watch? v=ZD 2 HWNk. A 6 WI

Chemie Klein – kleiner - Atome Aufgaben: 1. Erkläre den Begriff „Atom“. 2. a) Beschreibe das Atommodell von JOHN DALTON. 2. b) Welchen Sachverhalt konnte DALTON mit seinem Atommodell erklären? 3. Du kennst die chemische Formel von Wasser, H 2 O. Erkläre mithilfe der Tabelle, warum 16 g Sauerstoff mit 2 g Wasserstoff zu 18 g Wasser reagieren. 4. Informiere dich über das Raster-Tunnelmikroskop a) Wie funktioniert es? b) Wer hat es wann erfunden? c) Welcher Preis wurde dafür verliehen?
 Woraus bestehen alle stoffe
Woraus bestehen alle stoffe Ich bin du bist er sie es ist wir sind ihr seid sie sind
Ich bin du bist er sie es ist wir sind ihr seid sie sind Viele sind berufen
Viele sind berufen Ich bin du bist er
Ich bin du bist er Drei dinge sind uns aus dem paradies geblieben
Drei dinge sind uns aus dem paradies geblieben Alle sind mitreisende im zug des lebens
Alle sind mitreisende im zug des lebens Der zug des lebens geschichte
Der zug des lebens geschichte Zug des lebens spruch kurz
Zug des lebens spruch kurz Alle meine quellen entspringen in dir noten mehrstimmig
Alle meine quellen entspringen in dir noten mehrstimmig Wir sind alle wie schneeflocken
Wir sind alle wie schneeflocken