Alcalimetria Con il termine alcalimetria si intende quella








- Slides: 10

Alcalimetria

Con il termine alcalimetria si intende quella parte dell’analisi chimica volumetrica che permette di determinare la concentrazione di una soluzione acida mediante l’uso di una soluzione alcalina a titolo noto e di un opportuno indicatore. Da: Vocabolario on-line Treccani Fonte: www. treccani. it

L’alcalimetria viene usata per determinare le innumerevoli specie inorganiche, organiche e biologiche posseggono intrinseche proprietà acide. Ecco alcuni esempi: • determinazione dell’acidità di un olio; • determinazione dell’acidità del latte; • determinazione dell’acidità volatile di un vino;

L’olio di oliva La composizione chimica dell’olio di oliva è variabile e dipende da molti fattori: attacchi parassitari, latitudine, tipo di terreno, varietà, condizioni di conservazione delle olive, etc. Trigliceridi 96, 4 - 98, 5 Digliceridi 2, 0 - 3, 0 Monogliceridi 0, 1 - 0, 2 Fosfolipidi Insaponificabile 0, 013 0, 50 - 1, 35 I trigliceridi, gli esteri della glicerina con acidi grassi, sono la frazione più abbondante nell’olio. Il particolare, l’acido oleico (C 18: 1 Δ 9) è l’acido grasso più rappresentativo. Sotto l’azione delle lipasi, normalmente contenuta nell’oliva, e in presenza di acqua, l’olio può subire una reazione di idrolisi dei trigliceridi con liberazione di acidi grassi liberi e conseguente formazione di mono e digliceridi e glicerina. Per cui la determinazione dell’acidità in un olio misura l’estensione dell’irrancidimento idrolitico.

Composizione acidica media dell’olio COMPOSIZIONE % Acidi inferiori a C 12 assenti Acidi laurico e miristico < 0, 1 Acido palmitico < 17 Acido stearico < 3, 5 Acido arachico < 0, 7 Acido behenico < 0, 2 Acido palmitoleico 0, 3 – 3 Acido oleico > 65 Acido gadoleico < 0, 2 Acido linoleico < 13, 5 Acido linolenico < 1, 5 TRIGLICERIDE Fonte: www. alternativenergetiche. it

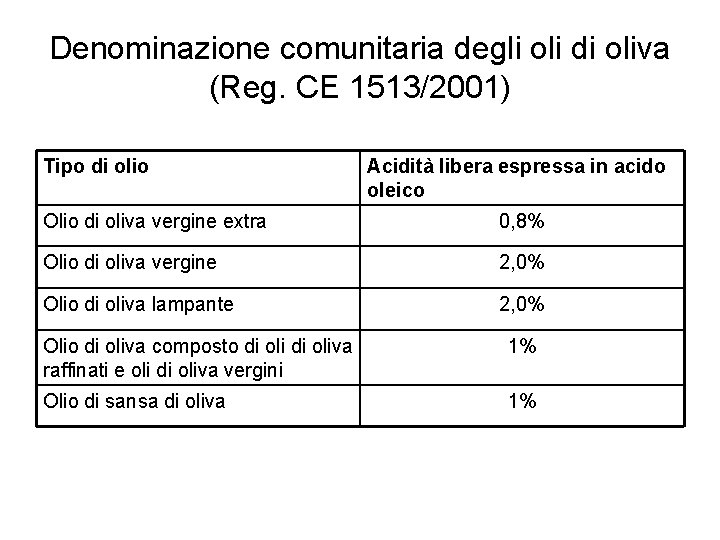
Denominazione comunitaria degli oli di oliva (Reg. CE 1513/2001) Tipo di olio Acidità libera espressa in acido oleico Olio di oliva vergine extra 0, 8% Olio di oliva vergine 2, 0% Olio di oliva lampante 2, 0% Olio di oliva composto di oliva raffinati e oli di oliva vergini 1% Olio di sansa di oliva 1%

Determinazione dell’acidità dell’olio L’analisi viene effettuata su circa 5 g di olio, aggiungendo 80 m. L di una miscela etanolo-etere etilico nel rapporto 1: 2 e qualche goccia di fenolftaleina all’ 1%. Si titola fino al viraggio (comparsa del colore rosa) con KOH 0, 1 M o 0, 5 M. L’acidità, espressa in g% di acido oleico, è data da: Acidità g% di acido oleico = A x N x 28, 2 p Dove: A: m. L di KOH utilizzati; N: normalità della base p: peso del campione 1

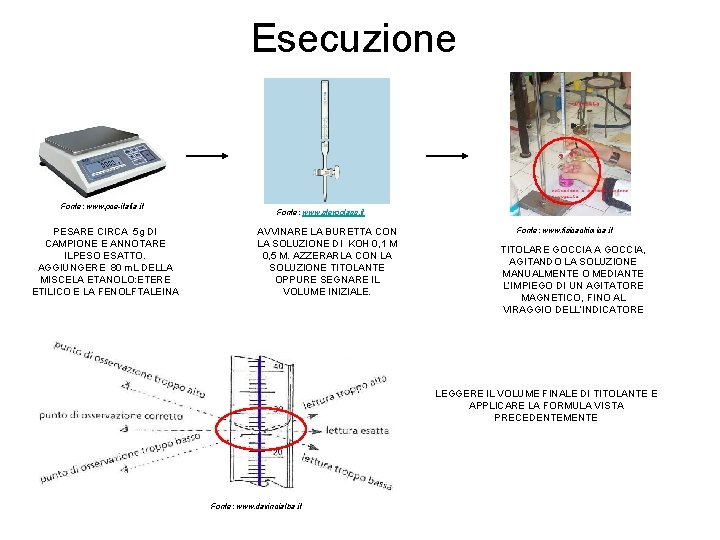
Esecuzione Fonte: www. pce-italia. it PESARE CIRCA 5 g DI CAMPIONE E ANNOTARE ILPESO ESATTO. AGGIUNGERE 80 m. L DELLA MISCELA ETANOLO: ETERE ETILICO E LA FENOLFTALEINA Fonte: www. steroglass. it AVVINARE LA BURETTA CON LA SOLUZIONE DI KOH 0, 1 M 0, 5 M. AZZERARLA CON LA SOLUZIONE TITOLANTE OPPURE SEGNARE IL VOLUME INIZIALE. Fonte: www. fisicachimica. it TITOLARE GOCCIA A GOCCIA, AGITANDO LA SOLUZIONE MANUALMENTE O MEDIANTE L’IMPIEGO DI UN AGITATORE MAGNETICO, FINO AL VIRAGGIO DELL’INDICATORE LEGGERE IL VOLUME FINALE DI TITOLANTE E APPLICARE LA FORMULA VISTA PRECEDENTEMENTE Fonte: www. davincialba. it

Esempio applicativo Si supponga di aver titolato 5, 12 g di olio di oliva con una soluzione di KOH 0, 1 M e che la buretta non sia stata azzerata, ma che il volume iniziale era di 12, 05 m. L. Se il volume finale letto nel modo corretto era di 16, 20 m. L, quale sarà l’acidità espressa come g% di acido oleico dell’olio sottoposto ad analisi? Vtot = Vf – Vi = (16, 20 – 12, 05) m. L = 4, 15 m. L Acidità g% di acido oleico = 4, 15 m. L x 0, 1 M x 28, 2 5, 12 g Acidità g% di acido oleico = 2, 28% 1

Bibliografia e sitografia • Regolamento (CE) 1513/2001 che modifica il regolamento n. 136/66/CEE e il regolamento (CE) n. 1638/98, in ordine alla proroga del regime di aiuto e alla strategia della qualità dell'olio di oliva. • Regolamento (CEE) n. 2568/91 della Commissione dell'11 luglio 1991 relativo alle caratteristiche degli oli d'oliva e degli oli di sansa d'oliva nonché ai metodi ad essi attinenti • B. Mincione, S. Spagna Musso; Appunti dalle lezioni di industrie agrarie; Editore Libreria S. Ciro portici (NA) • Cappelli P. , Vannucchi V. ; Chimica degli alimenti. Conservazione e trasformazioni. Zanichelli • www. treccani. it
 Alcalimetria
Alcalimetria Acidimetria e alcalimetria
Acidimetria e alcalimetria Comparaison système scolaire français italien
Comparaison système scolaire français italien Appartengo all'unica razza che conosco quella umana
Appartengo all'unica razza che conosco quella umana Frase attiva e passiva
Frase attiva e passiva Una cosa leggera
Una cosa leggera Che cosa si intende per controriforma
Che cosa si intende per controriforma Deus in adiutorium meum intende
Deus in adiutorium meum intende Relativismo culturale
Relativismo culturale Cosa significa risorgimento
Cosa significa risorgimento Cosa si intende per rischi emergenti
Cosa si intende per rischi emergenti


















