A sziliktok osztlyozsa Az Si O 4 4














![A szilikátok osztályozása / Структурні типи силікатів Az [Si. O 4] 4 koordinációs tetraéderek A szilikátok osztályozása / Структурні типи силікатів Az [Si. O 4] 4 koordinációs tetraéderek](https://slidetodoc.com/presentation_image_h2/7314f4968bc0dfb4fa154fa9f573d38e/image-15.jpg)
![Nezo- vagy szigetszilikátok (nezosz=sziget) / Острівні силікати Az [Si. O 4] 4 koordinációs tetraéderek Nezo- vagy szigetszilikátok (nezosz=sziget) / Острівні силікати Az [Si. O 4] 4 koordinációs tetraéderek](https://slidetodoc.com/presentation_image_h2/7314f4968bc0dfb4fa154fa9f573d38e/image-16.jpg)



![Tekto- vagy vázszilikátok / Каркасні силікати Az [Si. O 4] 4 koordinációs tetraéderek minden Tekto- vagy vázszilikátok / Каркасні силікати Az [Si. O 4] 4 koordinációs tetraéderek minden](https://slidetodoc.com/presentation_image_h2/7314f4968bc0dfb4fa154fa9f573d38e/image-20.jpg)
![Tekto- vagy vázszilikátok / Каркасні силікати Földpátok / Польовий шпат Az [Si. O 4] Tekto- vagy vázszilikátok / Каркасні силікати Földpátok / Польовий шпат Az [Si. O 4]](https://slidetodoc.com/presentation_image_h2/7314f4968bc0dfb4fa154fa9f573d38e/image-21.jpg)





- Slides: 29














![A szilikátok osztályozása Структурні типи силікатів Az Si O 4 4 koordinációs tetraéderek A szilikátok osztályozása / Структурні типи силікатів Az [Si. O 4] 4 koordinációs tetraéderek](https://slidetodoc.com/presentation_image_h2/7314f4968bc0dfb4fa154fa9f573d38e/image-15.jpg)
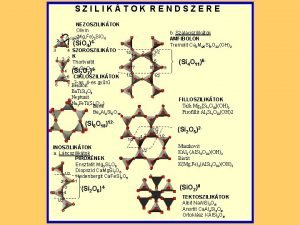
A szilikátok osztályozása / Структурні типи силікатів Az [Si. O 4] 4 koordinációs tetraéderek kapcsolódó módja szerint, W. l. Bragg (1930) nyomán, öt osztályba soroljuk őket Kapcsolt oxigének száma Si: O arány Nezo- vagy szigetszilikát / Острівні силікати 0 1: 4 Szoro- vagy csoportszilikátok / Кільцеві силікати 1 1: 3, 5 Ino- vagy láncszilikátok / Ланцюгові силікати, поясні (Стрічкові) силікати 2 1: 3 Filo- vagy rétegszilikátok / Листові силікати 3 1: 2, 5 Tekto- vagy vázszilikátok / Каркасні силікати 4 1: 2
![Nezo vagy szigetszilikátok nezoszsziget Острівні силікати Az Si O 4 4 koordinációs tetraéderek Nezo- vagy szigetszilikátok (nezosz=sziget) / Острівні силікати Az [Si. O 4] 4 koordinációs tetraéderek](https://slidetodoc.com/presentation_image_h2/7314f4968bc0dfb4fa154fa9f573d38e/image-16.jpg)
Nezo- vagy szigetszilikátok (nezosz=sziget) / Острівні силікати Az [Si. O 4] 4 koordinációs tetraéderek nem kapcsolódnak közvetlenül egymáshoz Кординаційні тетраедри [Si. O 4] 4 не пов’язані безпосередньо дне з одним Másodrendű kationok, pl. Mg+2, Fe+2, Al+3, stb kapcsolják össze őket Субкатіони, напр. Mg+2, Fe+2, Al+3 тощо, пов’язують їх між собою Gránát



![Tekto vagy vázszilikátok Каркасні силікати Az Si O 4 4 koordinációs tetraéderek minden Tekto- vagy vázszilikátok / Каркасні силікати Az [Si. O 4] 4 koordinációs tetraéderek minden](https://slidetodoc.com/presentation_image_h2/7314f4968bc0dfb4fa154fa9f573d38e/image-20.jpg)
Tekto- vagy vázszilikátok / Каркасні силікати Az [Si. O 4] 4 koordinációs tetraéderek minden irányban hasonló tetraéderekhez kapcsolódnak, közös oxigéneken keresztül /Координаційні тетраедри [Si. O 4] 4 пов’язуюються зі схожими тетраедрами через спільний оксиген. Kvarc
![Tekto vagy vázszilikátok Каркасні силікати Földpátok Польовий шпат Az Si O 4 Tekto- vagy vázszilikátok / Каркасні силікати Földpátok / Польовий шпат Az [Si. O 4]](https://slidetodoc.com/presentation_image_h2/7314f4968bc0dfb4fa154fa9f573d38e/image-21.jpg)
Tekto- vagy vázszilikátok / Каркасні силікати Földpátok / Польовий шпат Az [Si. O 4] tetraéderekből közvetlenül oxigénkötéssel előállítható háromdimenziós térháló minden 4. , 3. , vagy 2. tetraéderének Si+4 ját Al+2 (vagy Fe+3) helyettesítheti, az így felszabaduló szabad vegyértékekhez pedig K+1, Na+1, Ca+2 épülhet be A földkéreg leggyakoribb ásványai Plagioklász (nátron mész) földpátok (triklin véglapos) Káliföldpátok: (monokln prizmások)

Karbonátok és szulfátok Kalcit Gipsz

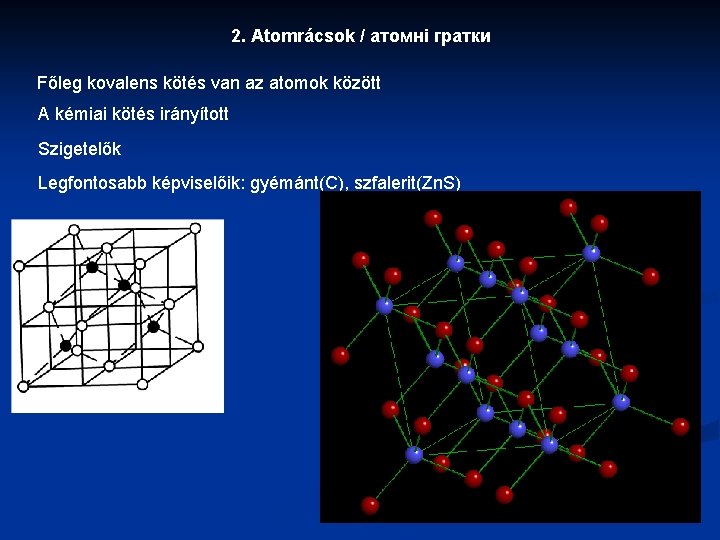
2. Atomrácsok / атомні гратки Főleg kovalens kötés van az atomok között A kémiai kötés irányított Szigetelők Legfontosabb képviselőik: gyémánt(C), szfalerit(Zn. S)

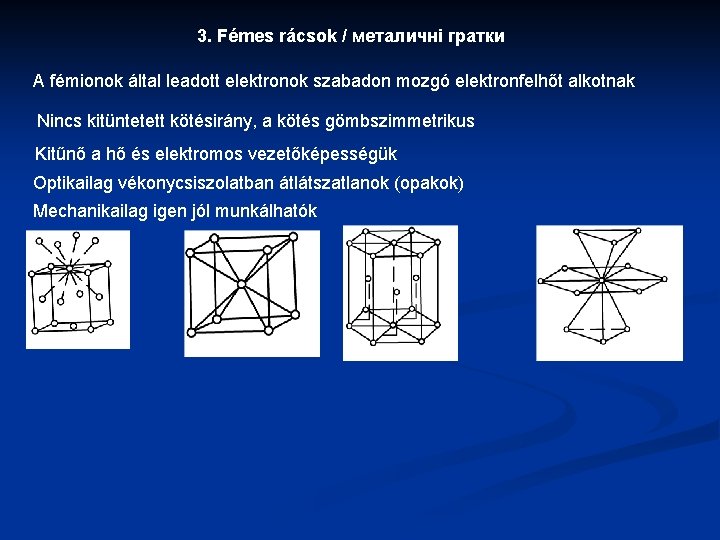
3. Fémes rácsok / металичні гратки A fémionok által leadott elektronok szabadon mozgó elektronfelhőt alkotnak Nincs kitüntetett kötésirány, a kötés gömbszimmetrikus Kitűnő a hő és elektromos vezetőképességük Optikailag vékonycsiszolatban átlátszatlanok (opakok) Mechanikailag igen jól munkálhatók

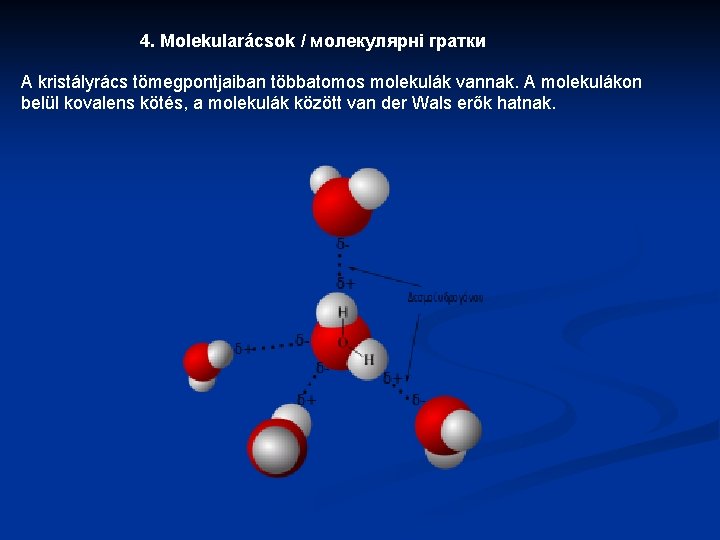
4. Molekularácsok / молекулярні гратки A kristályrács tömegpontjaiban többatomos molekulák vannak. A molekulákon belül kovalens kötés, a molekulák között van der Wals erők hatnak.



2. Izomorfia (egyenlő alakúság) Azok az ásványok izomorfok, amelyek kémiailag különböznek, de külsőleg azonosak vagy nagyon hasonlóak Pl. albit (Na. Al. Si 3 O 8) → anortit (Ca. Al 2 Si 2 O 8) Наприклад. альбіт (Na. Al. Si 3 O 8) → анортит (Ca. Al 2 Si 2 O 8) Pl. forsterit Mg 2[Si. O 4], fayalit Fe 2[Si. O 4] Наприклад. Форстерит Mg 2[Si. O 4], файалит Fe 2[Si. O 4]