3 Ionkristly lzerek A lzerkzeg fmoxid v fmhalogenid


















- Slides: 25

3. Ionkristály lézerek A lézerközeg: fémoxid v. fémhalogenid, amelyben a fémionok kis részét másik fémion („szennyező”) helyettesíti Egykristály: kis spektrális szélesség Üveg: széles sávban sugároz. Lézerátmenet: a szennyező ion energiaszintjei között történik.

Lézerspektroszkópia az interneten http: //web. fkt. bme. hu/lezersp/ Letöltés: jobb egérgombbal

A fémionok energiaszintjei (A többelektronos atomok szerkezete c. KASZ fejezet rövid ismétlése) Az energiaszintek három lépésben vezethetők le.

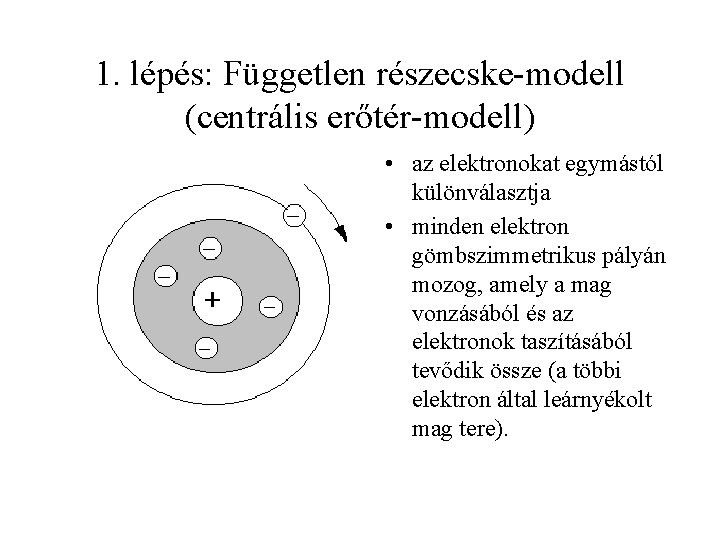
1. lépés: Független részecske-modell (centrális erőtér-modell) • az elektronokat egymástól különválasztja • minden elektron gömbszimmetrikus pályán mozog, amely a mag vonzásából és az elektronok taszításából tevődik össze (a többi elektron által leárnyékolt mag tere).

Az erőtér centrális, mint a hidrogénatomé. n, és m kvantumszámmal jellemzett atompályák vannak, amelyeken 0, 1, v. 2 elektron helyezkedik el. Ennek összesítése az elektronkonfiguráció. Az atom állapotát és az ahhoz tartozó energiát az elektronkonfiguráció egyértelműen meghatározza.

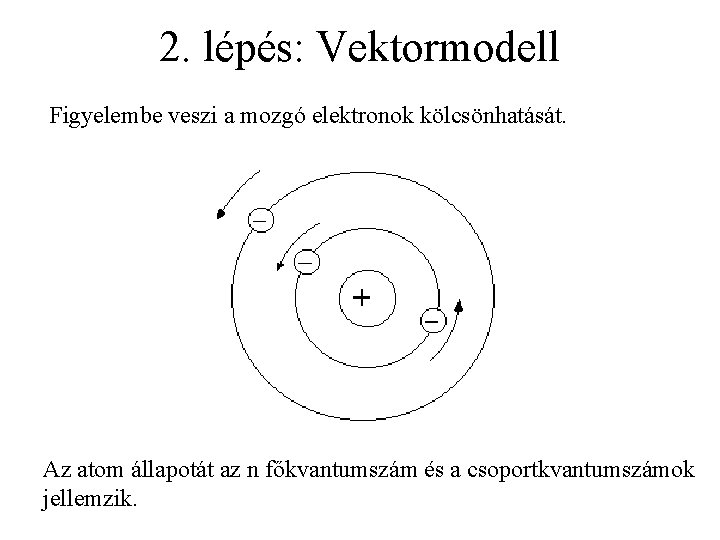
2. lépés: Vektormodell Figyelembe veszi a mozgó elektronok kölcsönhatását. Az atom állapotát az n főkvantumszám és a csoportkvantumszámok jellemzik.

L csoport-mellékkvantumszám Zárt héjakra : L = 0 Nyílt héjakra : 1 db elektron: 2 -nél több elektron: még bonyolultabb

S csoport-spinkvantumszám Zárt héjakra : S = 0 Nyílt héjakra : 1 db elektron: 2 db elektron: 0 vagy 1 2 -nél több elektron: még bonyolultabb

3. lépés: Spin-pálya csatolás Az energiaszintek finoman felhasadnak, a J csoportbelsőkvantumszám szerint, amely a L és S csoportkvantumszám kombinációjaként képezhető. Könnyű elemeknél: J = L+S, L+S-1 …, |L-S| Nehéz elemeknél: esetleg másképp.

Az atom (vagy egyatomos ion) állapotának jelölése

Kristályokban ezt 4. lépés követi: Kristálytér-felhasadás Ha az iont körülvevő tér nem gömbszimmetrikus, újabb felhasadás. Egyes kristályokban DE(spin-pálya)>DE(kristálytér) Más kristályokban DE(spin-pálya)<DE(kristálytér) Egyatomos ionok elektronszerkezetének szimmetriája: Izolált ionok: gömbszimmetrikus Kristálytérbeli ionok: pontcsoport-szimmetria (l. molekulák)

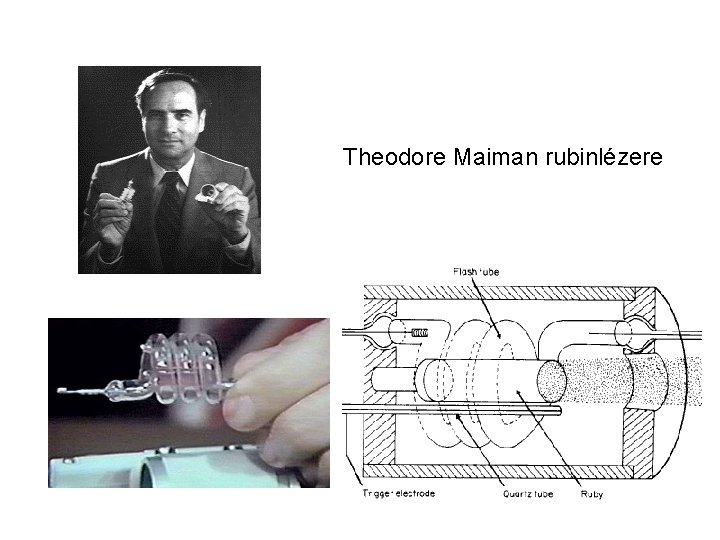
Theodore Maiman rubinlézere

Rubinlézer Rubin: Al 2 O 3 ~0, 05 m/m% Cr 3+ szennyezővel. Cr a 24. elem Cr atom konfigurációja: 1 s 22 p 63 s 23 p 63 d 54 s 1 Cr 3+ ion konfigurációja: 1 s 22 p 63 s 23 p 63 d 3



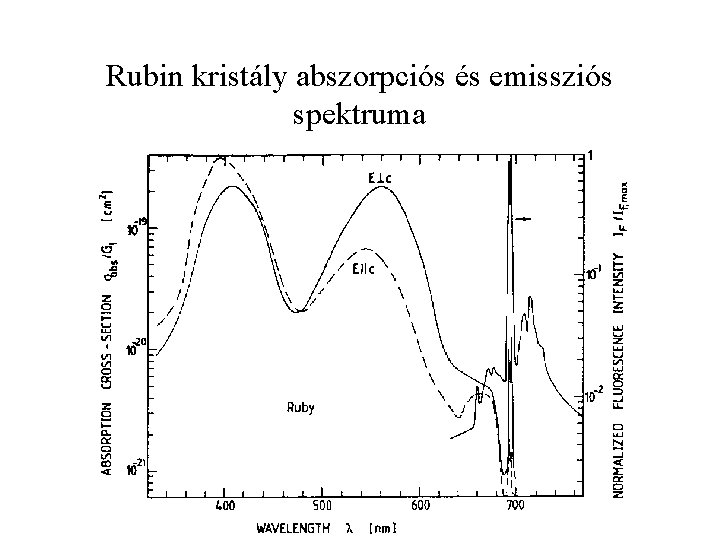
Rubin kristály abszorpciós és emissziós spektruma

Neodímium-YAG lézer Gazdarács: Y 3 Al 5 O 12 YAG = ittrium-alumínium gránit = yttrium aluminium garnet Szennyező ion: Nd 3+ (az Y 3+ ionok ~1%-a helyett)

A Nd a 60. elem. A Nd-atom konfigurációja: KLM 4 s 24 p 64 d 104 f 45 s 25 p 66 s 2 A Nd 3+-ion konfigurációja: KLM 4 s 24 p 64 d 104 f 35 s 25 p 6

Nd-YAG lézer energiaszint-diagramja

Nd-YAG kristály abszorpciós színképe

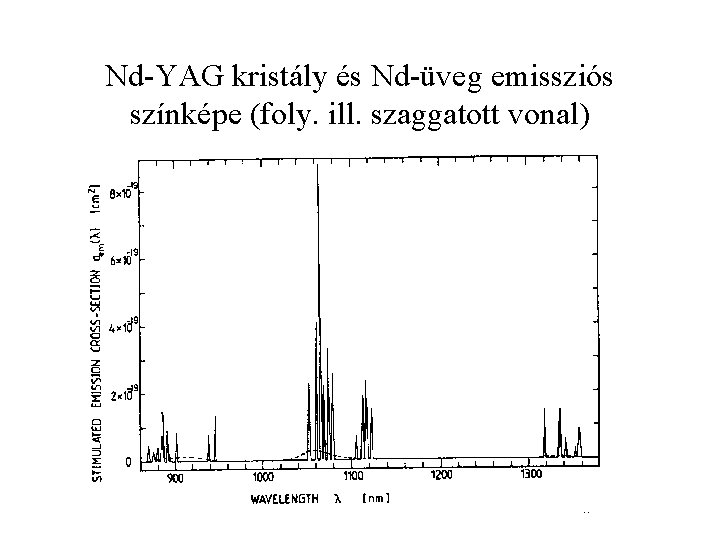
Nd-YAG kristály és Nd-üveg emissziós színképe (foly. ill. szaggatott vonal)

Titán-zafír lézer Lézerközeg: Ti 3+ ionokkal szennyezett Al 2 O 3 Ti a 22. elem Ti atom konfigurációja: 1 s 22 p 63 s 23 p 63 d 24 s 2 Ti 3+ ion konfigurációja: 1 s 22 p 63 s 23 p 63 d 1

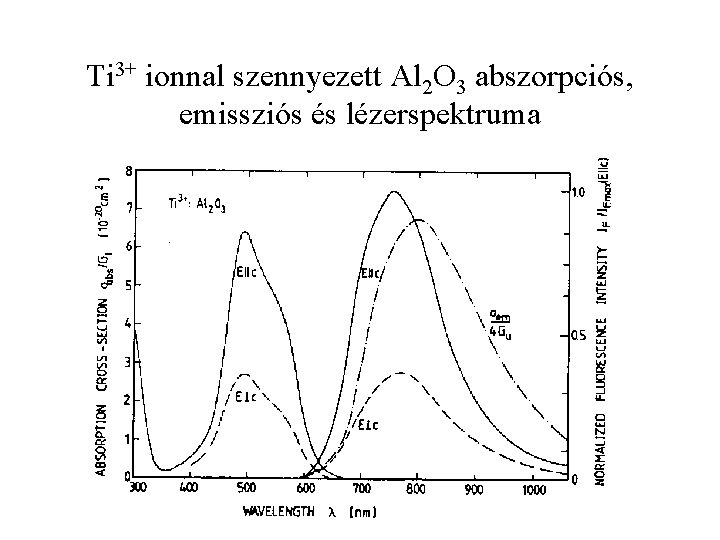
Ti 3+ ionnal szennyezett Al 2 O 3 abszorpciós, emissziós és lézerspektruma


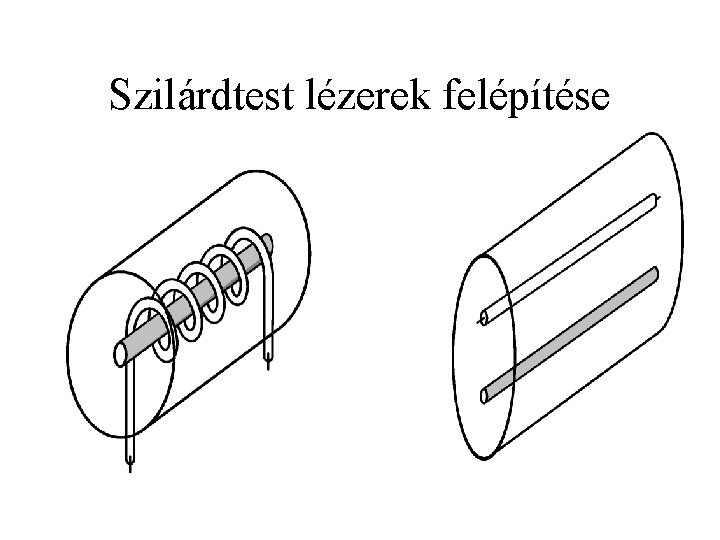
Szilárdtest lézerek felépítése






















