1 PERIODICK SSTAVA PRVKOV Seminr z CH 5

- Slides: 3

-1 - PERIODICKÁ SÚSTAVA PRVKOV Seminár z CH 5 (7. vyuč. hod. ) Periodická tabuľka prvkov PERIODICKÁ SÚSTAVA PRVKOV str. 54 - 63 Pojmy ako periodická tabuľka prvkov či periodický zákon sú vám iste známe. Vieme, že v usporiadaní chemických prvkov existuje systém a že prvky nie sú v tomto systéme usporiadané náhodne. Skúsme si však priblížiť vývoj tohto systému a formulovania jedného zo základných zákonov chémie. Niečo z histórie periodickej tabuľky prvkov Ľudia poznali základné chemické prvky, napríklad meď, striebro či zlato, už v období antiky. Grécky matematik a prírodovedec Aristoteles považoval za základné substancie živly – zem, vodu, vzduch a oheň. Prvý, kto svojou experimentálnou prácou objavil chemický prvok, bol nemecký alchymista Henning Brand, ktorý sa snažil objaviť Kameň mudrcov. Objavil biely fosfor, ktorého existenciu v roku 1680 potvrdil anglický prírodovedec Robert Boyle. Prvé snahy usporiadať prvky do určitého systému a objaviť nové uskutočnil koncom 18. storočia významný francúzsky chemik Antoine Laurent Lavoisier, zakladateľ vedeckej chémie a autor vedeckej chemickej terminológie. V jeho vedeckej práci „Traité Élémentaire de Chimie“ – Štúdia prvkov uviedol základný zoznam prvkov. Ten však obsahoval aj svetlo aj teplo, ktoré pokladal Lavoisier za hmotné. Prvky boli roztriedené len na kovy a nekovy. V roku 1817 usporiadal nemecký chemik Johann Wolfgang Döbereiner známe prvky triád. Kritériom zaradenia prvkov boli ich podobné vlastnosti. Systém všetkých vtedy známych chemických prvkov, založený na tzv. „atómových váhach“, predložil v roku 1862 francúzsky mineralóg a geológ Alexandre-Émile Béguyer de Chancourtois. Prvky zoradil podľa stúpajúcej atómovej hmotnosti do špirály, v ktorej prvky s podobnými vlastnosťami boli umiestnené pod sebou. Správne zaradených bolo len Antoine Laurent 23 prvkov. Ako prvý upozornil na periodicitu vlastností chemických prvkov a zaviedol Lavoisier pojem parióda. Pre históriu periodickej tabuľky chemických prvkov je významný rok 1864. V tomto roku sa o systematiku prvkov pokúsili dvaja Angličania. John Alexander Reina Newlands rozdelil prvky do tzv. oktáv. William Odling predložil dokonalé usporiadanie, uplatnil výnimku pri telúre a jóde, vynechal miesta pre neobjavené prvky. V tomto roku uverejnil svoje prvé triedenie chemických prvkov aj nemecký chemik Julius Lothar Meyer. Toto triedenie neobsahovalo všetky prvky. Jeho zdokonalená tabuľka z roku 1869 vyšla tlačou až v roku 1872. Periodický zákon Prelomový rok pre systematizáciu chemických prvkov bol rok 1869, v ktorom 6. marca ruský chemik Dmitrij Ivanovič Mendelejev prezentoval svoju periodickú tabuľku prvkov. Jeho tabuľka obsahovala 63 prvkov, zoradených podľa stúpajúcej relatívnej atómovej hmotnosti. Mendelejev s úžasnou predvídavosťou a precíznym určením vzťahu medzi hmotnosťou atómu prvku a jeho vlastnosťami vynechal vo svojej tabuľke voľné miesta pre prvky v tom čase ešte neobjavené. Plne tak pochopil význam vzťahu hmotnosti atómu a jeho vlastností a formuloval periodický zákon, často nazývaný aj ako prírodný zákon. Podľa dnešnej vedy periodický zákon znie takto: -2 - Dnes existujú a používajú sa rôzne formy periodickej tabuľky prvkov. Spoločným znakom všetkých periodických tabuliek je usporiadanie prvkov do 7 vodorovných radov – periód a 1 8 zvislých stĺpcov – skupín. Za najpoužívanejšiu môžeme považovať tzv. polodlhú formu (v učeb. obr. 4. 4 a s. 219), ktorá má 14 prvkov zo 6. periódy za lantánom La (Lantanoidy 58 Ce – 71 Lu) a 14 prvkov zo 7. periódy za aktíniom Ac (aktinoidy 90 Th – 103 Lr) umiestnených v spodnej časti pod tabuľkou. Ak sú tieto prvky vsunuté do tabuľky, hovoríme o tzv. dlhej forme. Periódy sú číslované arabskými číslicami 1 až 7 (zatiaľ) a obsahujú 2, 8, 8, 18, 32 prvkov. Niektorí autori označujú periódy písmenami K, L, M, N, O, P, Q tak, ako sú označované elektrónové vrstvy v atómovom obale. Prvky jednej periódy majú rovnaký počet čiastočne alebo úplne obsadených elektrónových vrstiev. Skupiny sú číslované arabskými číslicami 1 až 18. V skupinách sú umiestnené prvky s podobnou elektrónovou konfiguráciou valenčnej vrstvy. V niektorej literatúre nájdete aj tabuľku, ktorej skupiny sú označené rímskymi číslicami I. Až VIII. a rozdelené na dve podskupiny A a B. Skupiny A sa nazývajú hlavné, skupiny B vedľajšie skupiny. Takéto označovanie skupín pochádza zo staršej, tzv. krátkej formy periodickej tabuľky, ktorá má 8 skupín a každá sa člení na hlavnú a vedľajšiu podskupinu. VIII. B podskupina obsahuje tri stĺpce prvkov. Keďže na chemické a fyzikálne vlastnosti prvkov majú vplyv valenčné elektróny, prvky umiestnené v rovnakej skupine budú mať aj podobné vlastnosti. Počet valenčných elektrónov atómu je totožný s číslom hlavnej alebo vedľajšej skupiny, v ktorej je prvok umiestnený. Neplatí to v prípade prvkov 8. až 12. skupiny PTP. Cvičenie 1 Dmitrij Ivanovič Mendelejev Vlastnosti prvkov sú periodickou funkciou ich protónových čísel. To, že chemické prvky sú usporiadané do určitého systému práve na základe periodického zákona, ste sa učili v základnej škole. Usporiadanie prvkov podľa stúpajúceho protónového čísla do radov a stĺpcov nazývame periodická sústava prvkov. Dnes poznáme názvy 112 prvkov, ktoré určila Medzinárodná únia pre čistú a aplikovanú chémiu IUPC. Názvy prvkov 113 až 118 sú dočasne odvodené ako číslovka ich protónového čísla. Prvok s protónovým číslom 117 nie je dodnes objavený. Grafickým znázornením periodickej sústavy prvkov je periodická tabuľka. Určte protónové číslo a názov prvku, ktorý sa nachádza v 3. perióde a v VI. A skupine. Napíšte elektrónovú konfiguráciu a elektrónovú konfiguráciu valenčnej vrstvy atómu neznámeho prvku. Riešenie 1 V PTP je to prvok 16 S, názov je síra. Keďže je v VI. A skupine má 6 valenčných elektrónov. Elektrónová konfigurácia: 1 s 2 2 p 6 3 s 2 3 p 4 Elektrónová konfigurácia valenčnej vrstvy: 3 s 2 3 p 4

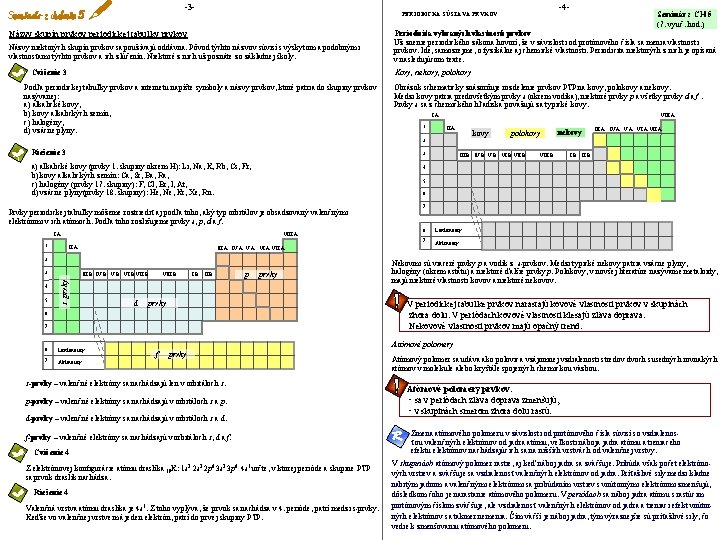
-3 Názvy skupín prvkov periodickej tabuľky prvkov Názvy niektorých skupín prvkov sa používajú oddávna. Pôvod týchto názvov súvisí s výskytom a podobnými vlastnosťami týchto prvkov a ich zlúčenín. Niektoré z nich už poznáte zo základnej školy. Podľa periodickej tabuľky prvkov a internetu napíšte symboly a názvy prvkov, ktoré patria do skupiny prvkov nazývanej: a) alkalické kovy, b) kovy alkalických zemín, c) halogény, d) vzácne plyny. Periodicita vybraných vlastností prvkov Už znenie periodického zákona hovorí, že v závislosti od protónového čísla sa menia vlastnosti prvkov. Ide, samozrejme, o fyzikálne aj chemické vlastnosti. Periodicita niektorých z nich je opísaná v nasledujúcom texte. Obrázok schematicky znázorňuje rozdelenie prvkov PTP na kovy, polokovy a nekovy. Medzi kovy patria predovšetkým prvky s (okrem vodíka), niektoré prvky p a všetky prvky d a f. Prvky s sa z chemického hľadiska považujú za typické kovy. I. A 1 VIII. A kovy 2 Riešenie 3 3 a) alkalické kovy (prvky 1. skupiny okrem H): Li, Na, K, Rb, Cs, Fr, b) kovy alkalických zemín: Ca, Sr, Ba, Ra, c) halogény (prvky 17. skupiny): F, Cl, Br, I, At, d) vzácne plyny(prvky 18. skupiny): He, Ne, Kr, Xe, Rn. VI. A VII. A 2 3 s prvky 5 III. B IV. B VII. B d VIII. B p prvky 7 Lantanoidy 7 Aktinoidy VIII. B 7 6 Lantanoidy 7 Aktinoidy Nekovmi sú viaceré prvky p a vodík z s-prvkov. Medzi typické nekovy patria vzácne plyny, halogény (okrem astátu) a niektoré ďalšie prvky p. Polokovy, v novšej literatúre nazývame metaloidy, majú niektoré vlastnosti kovov a niektoré nekovov. V periodickej tabuľke prvkov narastajú kovové vlastnosti prvkov v skupinách zhora dolu. V periódach kovové vlastnosti klesajú zľava doprava. Nekovové vlastnosti prvkov majú opačný trend. 6 6 VI. B VI. A VII. A 6 VIII. A IV. B IV. A 5 I. A III. B nekovy polokovy III. A 4 Prvky periodickej tabuľky môžeme roztriediť aj podľa toho, aký typ orbitálov je obsadzovaný valenčnými elektrónmi v ich atómoch. Podľa toho rozlišujeme prvky s, p, d a f. 4 Seminár z CH 5 (7. vyuč. hod. ) Kovy, nekovy, polokovy Cvičenie 3 1 -4 - PERIODICKÁ SÚSTAVA PRVKOV Atómové polomery f prvky s-prvky – valenčné elektróny sa nachádzajú len v orbitáloch s. p-prvky – valenčné elektróny sa nachádzajú v orbitáloch s a p. d-prvky – valenčné elektróny sa nachádzajú v orbitáloch s a d. f-prvky – valenčné elektróny sa nachádzajú v orbitáloch s, d a f. Cvičenie 4 Z elektrónovej konfigurácie atómu draslíka 19 K: 1 s 2 2 p 6 3 s 2 3 p 6 4 s 1 určte, v ktorej perióde a skupine PTP sa prvok draslík nachádza. Riešenie 4 Valenčná vrstva atómu draslíka je 4 s 1. Z toho vyplýva, že prvok sa nachádza v 4. perióde, patrí medzi s-prvky. Keďže vo valenčnej vrstve má jeden elektrón, patrí do prvej skupiny PTP. Atómový polomer sa udáva ako polovica vzájomnej vzdialenosti stredov dvoch susedných rovnakých atómov v molekule alebo kryštále spojených chemickou väzbou. Atómové polomery prvkov: • sa v periódach zľava doprava zmenšujú, • v skupinách smerom zhora dolu rastú. Zmena atómového polomeru v závislosti od protónového čísla súvisí so vzdialenosťou valenčných elektrónov od jadra atómu, veľkosti náboja jadra atómu a tieniaceho efektu elektrónov nachádzajúcich sa na nižších vrstvách od valenčnej vrstvy. V skupinách atómový polomer rastie, aj keď náboj jadra sa zväčšuje. Pribúda však počet elektrónových vrstiev a zväčšuje sa vzdialenosť valenčných elektrónov od jadra. Príťažlivé sily medzi kladne nabitým jadrom a valenčnými elektrónmi sa pribúdaním vrstiev s vnútornými elektrónmi zmenšujú, dôsledkom čoho je narastanie atómového polomeru. V periódach sa náboj jadra atómu s rastúcim protónovým číslom zväčšuje, ale vzdialenosť valenčných elektrónov od jadra a tieniaci efekt vnútorných elektrónov sa takmer nemenia. Čím väčší je náboj jadra, tým výraznejšie sú príťažlivé sily, čo vedie k zmenšovaniu atómového polomeru.

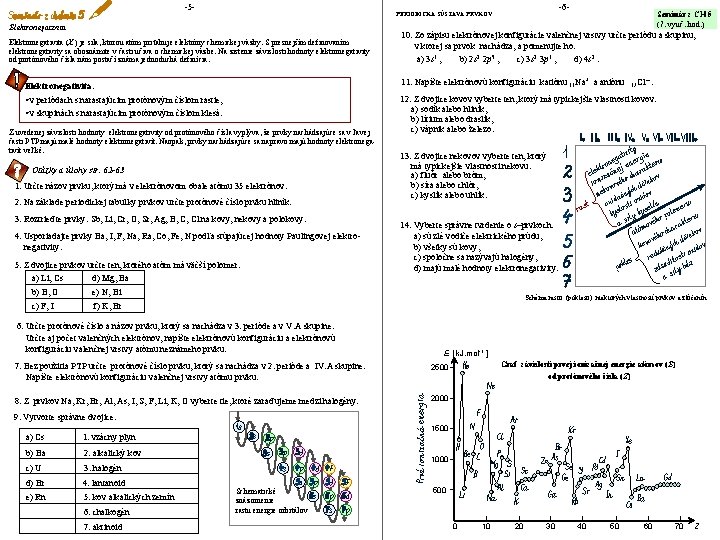
-5 - -6 - PERIODICKÁ SÚSTAVA PRVKOV Elektronegativita (X ) je sila, ktorou atóm priťahuje elektróny chemickej väzby. S presnejším definovaním elektronegativity sa oboznámite v časti učiva o chemickej väzbe. Na zistenie závislosti hodnoty elektronegativity od protónového čísla nám postačí známa jednoduchá definícia. Seminár z CH 5 (7. vyuč. hod. ) 10. Zo zápisu elektrónovej konfigurácie valenčnej vrstvy určte periódu a skupinu, v ktorej sa prvok nachádza, a pomenujte ho: a) 3 s 1 , b) 2 s 2 2 p 5 , c) 3 s 2 3 p 1 , d) 4 s 2. 11. Napíšte elektrónovú konfiguráciu katiónu 11 Na+ a aniónu • v periódach s narastajúcim protónovým číslom rastie, • v skupinách s narastajúcim protónovým číslom klesá. 12. Z dvojice kovov vyberte ten, ktorý má typickejšie vlastnosti kovov: a) sodík alebo hliník, b) lítium alebo draslík, c) vápnik alebo železo. Z uvedenej závislosti hodnoty elektronegativity od protónového čísla vyplýva, že prvky nachádzajúce sa v ľavej časti PTP majú malé hodnoty elektronegativít. Naopak, prvky nachádzajúce sa napravo majú hodnoty elektronegativít veľké. Otázky a úlohy str. 62 -63 1. Určte názov prvku, ktorý má v elektrónovom obale atómu 35 elektrónov. 2. Na základe periodickej tabuľky prvkov určte protónové číslo prvku hliník. 3. Roztrieďte prvky: Sb, Li, Cr, O, Sr, Ag, B, C, Cl na kovy, nekovy a polokovy. 4. Usporiadajte prvky Ba, I, F, Na, Ra, Co, Fe, N podľa stúpajúcej hodnoty Paulingovej elektronegativity. 5. Z dvojice prvkov určte ten, ktorého atóm má väčší polomer: a) Li, Cs d) Mg, Ba b) B, O e) N, Bi c) F, I f) K, Br 17 Cl – Elektronegativita: . 13. Z dvojice nekovov vyberte ten, ktorý má typickejšie vlastnosti nekovu: a) fluór alebo bróm, b) síra alebo chlór, c) kyslík alebo uhlík. 14. Vyberte správne tvrdenie o s–prvkoch: a) sú zlé vodiče elektrického prúdu, b) všetky sú kovy, c) spoločne sa nazývajú halogény, d) majú malé hodnoty elektronegativity. Schéma rastu (poklesu) niektorých vlastností prvkov a zlúčenín 6. Určte protónové číslo a názov prvku, ktorý sa nachádza v 3. perióde a v V. A skupine. Určte aj počet valenčných elektrónov, napíšte elektrónovú konfiguráciu a elektrónovú konfiguráciu valenčnej vrstvy atómu neznámeho prvku. E [ k. J. mol-1 ] 7. Bez použitia PTP určte protónové číslo prvku, ktorý sa nachádza v 2. perióde a IV. A skupine. Napíšte elektrónovú konfiguráciu valenčnej vrstvy atómu prvku. 2500 8. Z prvkov Na, Kr, Br, Al, As, I, S, F, Li, K, O vyberte tie, ktoré zaraďujeme medzi halogény. 2000 Graf závislosti prvej ionizačnej energie atómov (E) od protónového čísla (Z) 9. Vytvorte správne dvojice: a) Cs 1. vzácny plyn b) Ba 2. alkalický kov c) U 3. halogén d) Br 4. lantanoid e) Rn 5. kov alkalických zemín 6. chalkogén 7. aktinoid 1500 1000 Schematické znázornenie rastu energie orbitálov 500 0 10 20 30 40 50 60 70 Z