1 LTKOV MNOSTV 2 MOLRN HMOTNOST 3 VPOTY














- Slides: 15

1. LÁTKOVÉ MNOŽSTVÍ 2. MOLÁRNÍ HMOTNOST 3. VÝPOČTY Z ROVNIC 4. KONEC

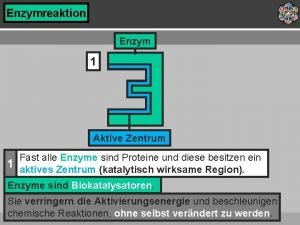
1. LÁTKOVÉ MNOŽSTVÍ K vyjádření množství částic : - atomů - iontů (kationtů, aniontů) - molekul

Jednotka látkového množství: mol 1 mol = 6, 023 · 1023 částic = 602 300 000 000 000 částic

Rov Rovnici: 2 H 2 + O 2 2 H 2 O Čteme: : Čteme: Ze 2 molů vodíku a 1 molu kyslíku vzniknou 2 moly vody

2. MOLÁRNÍ HMOTNOST = hmotnost 1 molu látky Hmotnost částic téměř neměřitelná: 1 proton + 1 elektron = 1, 67 10 -27 kg Nutno vztáhnout k určitému množství částic: 1 mol (prvku zadáno v tabulkách)

Molární hmotnost atomu vodíku: M(H) = 1 g / mol (viz tabulky) Molární hmotnost molekuly vodíku (H 2): M (H 2) = 2 g / mol Tj. 2 1 = 2

Molární hmotnost sloučeniny: (viz tabulky): M(H) = 1 g / mol M (Cl) = 35 g / mol M(HCl) = M(H) + M (Cl) M(HCl) = 1 + 35 M(HCl) = 36 (g / mol)

Molární hmotnost sloučeniny: (viz tabulky): M(H) = 1 g / mol M (O) = 16 g / mol M(H 2 O) = 2 · M(H) + M (O) M(H 2 O) = 2 · 1 + 16 = 2 + 16 M(H 2 O) = 18 (g / mol)

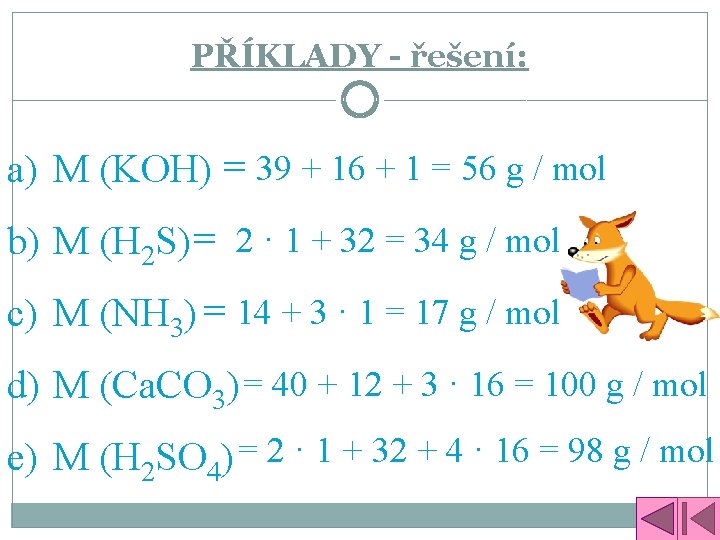
PŘÍKLADY: Vypočítej molární hmotnost: a) M (KOH) b) M (H 2 S) c) M (NH 3) d) M (Ca. CO 3) e) M (H 2 SO 4)

PŘÍKLADY - řešení: a) M (KOH) = 39 + 16 + 1 = 56 g / mol b) M (H 2 S) = 2 · 1 + 32 = 34 g / mol c) M (NH 3) = 14 + 3 · 1 = 17 g / mol d) M (Ca. CO 3) = 40 + 12 + 3 · 16 = 100 g / mol e) M (H 2 SO 4) = 2 · 1 + 32 + 4 · 16 = 98 g / mol

3. VÝPOČTY Z ROVNIC a) Kolik gramů vody vznikne z 10 g vodíku? Postup: 1. Sestavit rovnici: H 2 + O 2 H 2 O 2. Dopočíst rovnici: 2 H 2 + O 2 2 H 2 O

3. Vypočíst molární hmotnosti sloučenin důležitých pro výpočet: M (H 2) = 2 g / mol M (H 2 O) = 18 g / mol 4. Dosadit do rovnice a vypočíst trojčlenku: 2 H 2 + O 2 2· 2 g 10 g 2 H 2 O 2 · 18 x x = (10 · 36) : 4 x = 90 (g)

a) Kolik gramů vodíku potřebujeme k reakci s 16 g síry, aby vznikla kyselina sirovodíková? Postup: 1. Sestavit rovnici: H 2 + S H 2 S 2. Dopočíst rovnici: 1 H 2 + 1 S 1 H 2 S

3. Vypočíst molární hmotnosti sloučenin důležitých pro výpočet: M (H 2) = 2 g / mol M (S) = 32 g / mol 4. Dosadit do rovnice a vypočíst trojčlenku: 1 H 2 + 1 S 1 · 2 g + 1 · 32 x + 16 g x = (2 · 16) : 32 x = 1 (g) 1 H 2 S

PŘÍKLADY: A) Kolik gramů kyslíku je třeba přidat k 5 g vodíku (vznikne voda)? 40 g 2 H 2 + O 2 2 H 2 O B) Kolik gramů chloru je třeba přidat, aby vzniklo 36 g chlorovodíku (reakce s vodíkem)? 35 g Cl 2 + H 2 2 HCl C) Kolik gramů hydroxidu sodného vznikne, jestliže reaguje 69 g sodíku (reaguje s vodou)? 120 g 2 H 2 O + 2 Na. OH + H 2