UDA CHIMICA PIOGGE ACIDE La deposizione acida umida







- Slides: 8

UDA CHIMICA

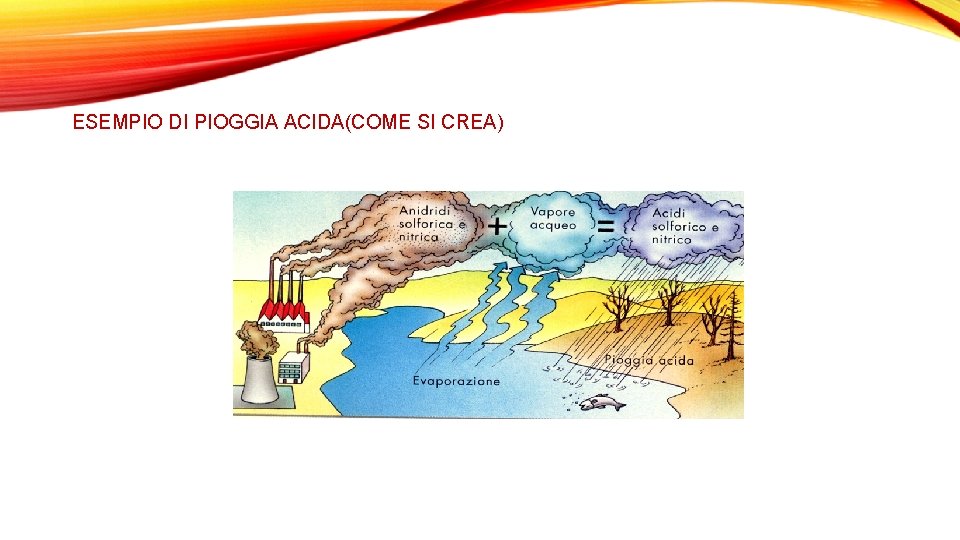
PIOGGE ACIDE: La deposizione acida umida, meglio nota come pioggia acida, in meteorologia consiste nella ricaduta dall'atmosfera sul suolo di particelle acide, molecole acide diffuse nell'atmosfera che vengono catturate e deposte al suolo da precipitazioni quali: piogge, neve, grandine, nebbie, rugiade, etc. Tale processo si distingue dal fenomeno della deposizione acida secca nella quale la ricaduta dall'atmosfera di particelle acide non è veicolata dalle precipitazioni ed avviene per effetto della forza di gravità. In questo caso si parla quindi di depositi secchi. Una pioggia viene definita acida quando il suo p. H è minore di 5. • Effetti: La pioggia acida provoca l’acidificazione di laghi e corsi d’acqua e contribuisce a danneggiare alberi ad elevate altitudini e molti suoli forestali sensibili. Inoltre, le piogge acide accelerano il decadimento dei materiali da costruzione e delle vernici, compresi palazzi storici, statue e sculture che fanno parte del patrimonio culturale delle nazioni. Prima di cadere a terra, l’anidride solforosa (SO 2) e gli ossidi di azoto (NOx) e le loro particelle, solfati e nitrati, contribuiscono al degrado della visibilità e sono un pericolo per la salute pubblica. La pioggia acida di solito non uccide gli alberi direttamente. E’ più probabile che li indebolisca danneggiandone le foglie, limitando le sostanze nutritive a loro disposizione, o ancora esponendoli alle sostanze tossiche rilasciate lentamente dal terreno. Molto spesso, le lesioni o la morte degli alberi sono il risultato degli effetti delle piogge acide in combinazione con altri tipi di minacce. • Aree geografiche più colpite Le aree geografiche nelle quali è stato accertato un impatto ecologico significativo dovuto al fenomeno dell'acidificazione includono: a) la maggior parte dell'Europa nord-orientale, in particolare le aree corrispondenti all'attuale Polonia fino alla Scandinavia; b) i territori orientali degli Stati Uniti e del sud-est del Canada.

ESEMPIO DI PIOGGIA ACIDA(COME SI CREA)

LA DUREZZA DELL’ACQUA • Per durezza dell'acqua si intende un valore che esprime il contenuto totale di ioni di calcio e magnesio oltre che di eventuali metalli pesanti presenti nell'acqua. Generalmente con questo termine si intende riferirsi alla durezza totale; la durezza totale è somma della durezza permanente, che esprime la quantità di cationi rimasti in soluzione dopo ebollizione prolungata, e della durezza temporanea, che per differenza tra le precedenti durezze, esprime sostanzialmente il quantitativo di idrogenocarbonati (o bicarbonati) presenti nell'acqua prima dell'ebollizione. • I sali della durezza sono solitamente presenti nell'acqua come solfati, cloruri, nitrati, carbonati o idrogeno-carbonati, che generalmente sono solubili ma per riscaldamento o per evaporazione precipitano formando incrostazioni di calcare o di altro genere. • La durezza di un'acqua può venire abbassata facendola passare attraverso l'addolcitore (manuale o automatico) su una resina a scambio ionico, che consiste di un polimero recante ioni sodio (Na+) che vengono scambiati al passaggio con gli ioni calcio e magnesio dell'acqua.

• Durezza temporanea, permanente, totale: A temperature maggiori di 80 °C tale equilibrio è spostato verso destra, per cui si considera come "temporaneo" il contributo degli idrogenocarbonati alla durezza totale, visto che a seguito dell'ebollizione tale contributo svanisce per la formazione di un precipitato solido di carbonati di calcio e magnesio. È la durezza che persiste dopo l'ebollizione dell'acqua. È dovuta, soprattutto, alla presenza di cloruri, solfati e nitrati di calcio e magnesio. Generalmente gli ioni bicarbonato, in seguito a riscaldamento, perdono un idrogeno trasformandosi in ione carbonato che si vanno a sommare a quelli già presenti nell'acqua.

ANALISI DELLE ACQUE Le acque potabili sono destinate al consumo umano o utilizzate in un'impresa alimentare per la fabbricazione, il trattamento, la conservazione l'immissione sul mercato di prodotti o sostanze destinate al consumo umano che possono avere conseguenze sulla salubrità del prodotto alimentare finale. Può essere destinata al consumo umano ogni acqua, qualunque sia l'origine, sia allo stato in cui si trova, sia dopo trattamento. Non sono comprese nelle acque potabili a acque medicinali. L'acqua destinata al consumo umano non solo deve essere esente da sostanze chimiche e da microrganismi nocivi alla salute, ma deve anche avere un contenuto salino tale da poter svolgere efficacemente la funzione equilibratrice del sistema osmotico dell'organismo. Infine, e indispensabile che essa sia fresca, limpida, incolore, inodore. Per valutare la qualità dell'acqua da utilizzare a scopo potabile si ricorre a esami chimici e chimico fisici atti a rilevarne le caratteristiche organolettiche, chimico-fisiche e chimiche, e a evidenziarne la presenza di sostanze indesiderabili o di sostanze tossiche. Impianti di captazione e di distribuzione. Per distribuire acqua potabile alle collettività umane si ricorre alla costruzione di acquedotti, costituiti, secondo la normativa italiana, da impianto di attingimento. Comprende le opere occorrenti per la raccolta, la regolazione, la derivazione delle Analisi delle acque valore guida acqua al consumo 12°C Valore limite 25 C Colore: può essere dato da ferro e manganese, sostanze organiche e microrganismi. Assente nelle acque potabili. Si confronta con standard contenenti una quantità crescenti di silice colloidale. Odore: dovuta a fenomeni putrefattivi superficiali. alla presenza di sali di calcio e magnesio che possono formare in presenza di ioni carbonato depositi incrostanti di calcare. Si divide in: Permanente rimane anche dopo ebollizione. Temporanea: scompare con l'ebollizione per la precipitazione dei carbonati di calcio e magnesio presenti.

EUTROFIZZAZIONE Il termine eutrofizzazione, derivante dal greco eutrophia, indica una condizione di ricchezza di sostanze nutritive in un dato ambiente, in particolare una sovrabbondanza di nitrati e fosfati in un ambiente acquatico. L’eutrofizzazione è un processo degenerativo dell’ecosistema acquatico dovuto all’eccessivo arricchimento in nutrienti (in questo caso fattori limitanti - sali di fosforo e azoto) dell’ecosistema stesso tale da provocarne un’alterazione dell’equilibrio. Una delle prime definizioni di eutrofizzazione coniate risale agli anni ’ 70 ad opera dell’OCSE (Organizzazione per la Cooperazione e lo Sviluppo Economico): "l’eutrofizzazione è un arricchimento delle acque dei sali nutritivi che provoca cambiamenti tipici quali l’incremento della produzione di alghe e piante acquatiche, l’impoverimento delle risorse ittiche, la generale degradazione della qualità dell’acqua ed altri effetti che ne riducono e precludono l’uso". Il fenomeno, che negli ultimi decenni ha assunto dimensioni rilevanti anche in Italia, interessa gran parte dei nostri laghi, alcuni corsi d’acqua e le acque marine e costiere. Le fonti di generazione dei nutrienti possono essere suddivise in "diffuse" e in "localizzate":

• L’aumento di sali nutritivi nell’ecosistema acquatico genera un aumento della biomassa algale (consumatori primari) che a sua volta provoca un aumento ai livelli successivi della catena alimentare. • Quando la crescita algale non è più controllata dalla riduzione di nutrienti o da altri fattori, si forma una biomassa sempre più consistente destinata al degrado (catena del detrito). Se in acqua è disponibile una quantità sufficiente di ossigeno disciolto (necessario alla respirazione degli organismi operanti in aerobiosi), la catena del detrito è mantenuta attiva da funghi e batteri, procedendo senza problemi alla mineralizzazione della sostanza organica. Se la demolizione della biomassa avviene con un consumo eccessivo di ossigeno e con una velocità maggiore di quella di rigenerazione dell’ossigeno stesso, si instaura una condizione anaerobica o anossica che vede subentrare agli organismi aerobi gli organismi degradatori anaerobi, che compiono i processi di demolizione della biomassa liberando composti per lo più tossici (tra i quali l’ammoniaca e l’idrogeno solforato). • Gli effetti che si verificano sono: peggioramento della qualità delle acque, fenomeni di intorbidimento del fondo; perdita di trasparenza generale e di colorazioni delle acque (dal rosso al verde); produzione di cattivi odori; morie di pesci e della fauna bentonica; estrema semplificazione delle comunità; impossibilità di utilizzo dell’acqua per uso potabile; danni alle attività economiche, soprattutto turistiche (limitazioni alla balneazione).















