Solanum verrucosum Protoplasty 1971 1 normln rostlina z







- Slides: 13

Solanum verrucosum Protoplasty 1971 - 1. normální rostlina z protoplastu - tabák 1972 - fúze protoplastů N. glauca X N. langsdorfii Greplová, Habásko, 2008 Význam: teoretický – regenerace rostlin; interakce vzdálených genomů praktický – zlepšení vlastností kulturních rostlin Výchozí materiál pro fúzi: protoplastové kultury velké množství rostlinných druhů protoplast rostlina (i hospodářsky významné – brambor, rajče, tabák, vojtěška … i obilniny a dřeviny) Rozhoduje: v genotyp v typ pletiva, vývojová fáze rostliny výchozí materiál - výhodné in vitro rostoucí, mladé rostliny, mladá pletiva, kořenové špičky, dělohy, vzrostné vrcholy) v suspenzní kultury - exponenciální fáze

Protoplasty Izolace protoplastů v mechanicky – hypertonický roztok, narušení buněčné stěny (1892) v chemicky – působením enzymů (1960) buněčná stěna – polysacharidy, celulóza, pektiny celulázy, hemicelulázy, pektinázy !! Rozdíly ve stavbě b. stěny jedno- a dvouděložných rostlin – dvouděložné hodně pektinových látek Enzymatické působení: dvoukrokové, jednokrokové Podmínky – teplota 25 -30°C, p. H 6, tma, mírné třepání, 30 mi. . 20 h Osmotikum – glukóza, sacharóza, manitol, sorbitol (10 -20% roztoky) Př. : Okurka listy, hypokotyl: kalus: 1 % celulasa (Onozuka R 10) 2% celulasa (Onozuka R 10) 0, 25 % pektináza (macerozym R 10) 1% pektináza (macerozym R 10)

Čištění – odstranění enzymů, odstranění zbytků buněk, buněčných stěn, … filtrace, centrifugace, promývání …. Kultivace q inkubační médium nahrazeno kultivačním médiem (ne NH 4+, Fe, Zn, Ca) q citlivý proces – různé způsoby uspořádání (společná kultivace s rychle rostoucími protoplasty), tma, medium s auxiny a cytokininy na agaru, agaróze, agarových bločcích v tekutém médiu, v kapkách tekutého média, imobilizace v alginátu, „nurse cultures“

Protoplasty Regenerace protoplastů Spontánní proces -- různá schopnost regenerace u protoplastů z různých pletiv - dobrou regenerační schopnost vykazují protoplasty z mezofylových nebo hypokotylových buněk v regenerace buněčné stěny (2 -3 dny) v 1. buněčné dělení (2 -7 dní) v vytvoření kalusu (tkáňové kultury 3 týdny) Optimální podmínky se liší pro různé genotypy světlo - nevyžadováno, někdy citlivost ke světlu, později stálé světlo --1000 luxů, teplota 25 -30°C, V průběhu regenerace postupně snižovat obsah osmotika v Organogeneze -přenesení na medium s růstovými regulátory.

Protoplastová fúze- somatická hybridizace Protoplastová fúze Metoda kombinace genomů, která obchází sexuální inkompatibilitu Neexistence barier pro fúzi protoplastů Kombinace genomů i cytoplazmy (cybridi) Fúze protoplastů fúze jader regenerace buněčné stěny buněčné dělení tkáňová kultura regenerace rostliny cestou organogeneze nebo somatické embryogeneze Využití pro křížení sexuálně inkompatibilních druhů, sterilních nebo subfertilních druhů, druhů s přirozeně dlouhým životním cyklem Mezirodové a mezidruhové křížení, kombinace jak jaderného, tak mimojaderného materiálu

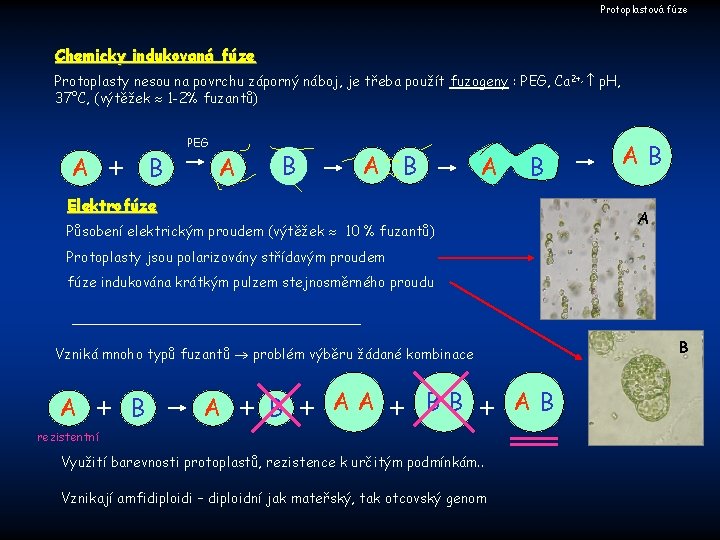
Protoplastová fúze Chemicky indukovaná fúze Protoplasty nesou na povrchu záporný náboj, je třeba použít fuzogeny : PEG, Ca 2+, p. H, 37°C, (výtěžek 1 -2% fuzantů) A + B PEG A B A B Elektrofúze Působení elektrickým proudem (výtěžek 10 % fuzantů) AB A Protoplasty jsou polarizovány střídavým proudem fúze indukována krátkým pulzem stejnosměrného proudu Vzniká mnoho typů fuzantů problém výběru žádané kombinace A + B + AA + BB + AB rezistentní Využití barevnosti protoplastů, rezistence k určitým podmínkám. . Vznikají amfidiploidi – diploidní jak mateřský, tak otcovský genom B

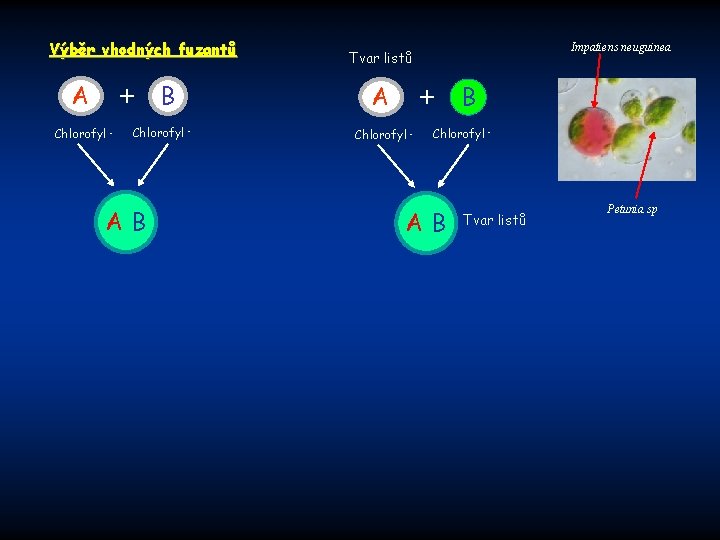
Výběr vhodných fuzantů A + Chlorofyl - B Chlorofyl - AB Impatiens neuguinea Tvar listů A + Chlorofyl - B Chlorofyl - AB Tvar listů Petunia sp

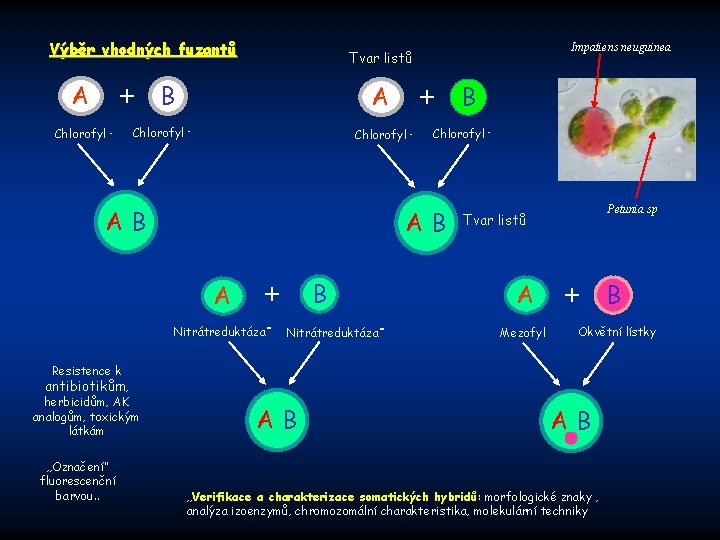
Výběr vhodných fuzantů A + Chlorofyl - Impatiens neuguinea Tvar listů B A Chlorofyl - + Chlorofyl - AB A B + Nitrátreduktáza- B Petunia sp Tvar listů A Mezofyl + Okvětní lístky Resistence k antibiotikům, herbicidům, AK analogům, toxickým látkám „Označení“ fluorescenční barvou. . AB B AB „Verifikace a charakterizace somatických hybridů: morfologické znaky , analýza izoenzymů, chromozomální charakteristika, molekulární techniky

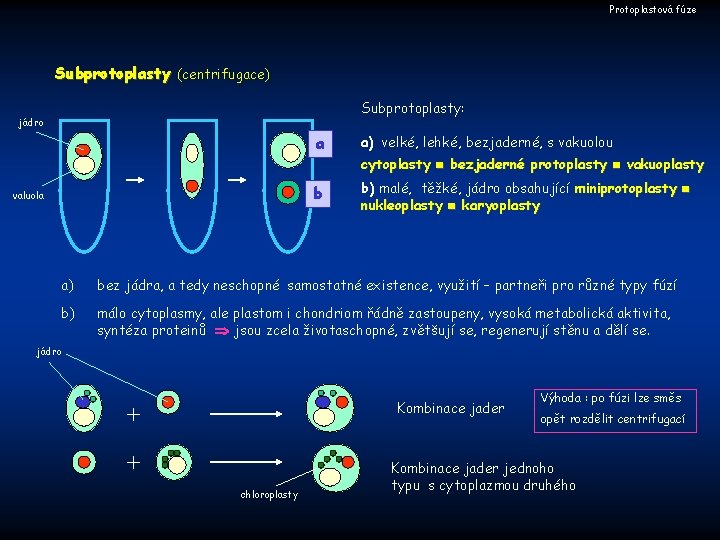
Protoplastová fúze Subprotoplasty (centrifugace) Subprotoplasty: jádro valuola a a) velké, lehké, bezjaderné, s vakuolou b b) malé, těžké, jádro obsahující miniprotoplasty nukleoplasty karyoplasty cytoplasty bezjaderné protoplasty vakuoplasty a) bez jádra, a tedy neschopné samostatné existence, využití – partneři pro různé typy fúzí b) málo cytoplasmy, ale plastom i chondriom řádně zastoupeny, vysoká metabolická aktivita, syntéza proteinů jsou zcela životaschopné, zvětšují se, regenerují stěnu a dělí se. jádro Kombinace jader + + chloroplasty Výhoda : po fúzi lze směs opět rozdělit centrifugací Kombinace jader jednoho typu s cytoplazmou druhého

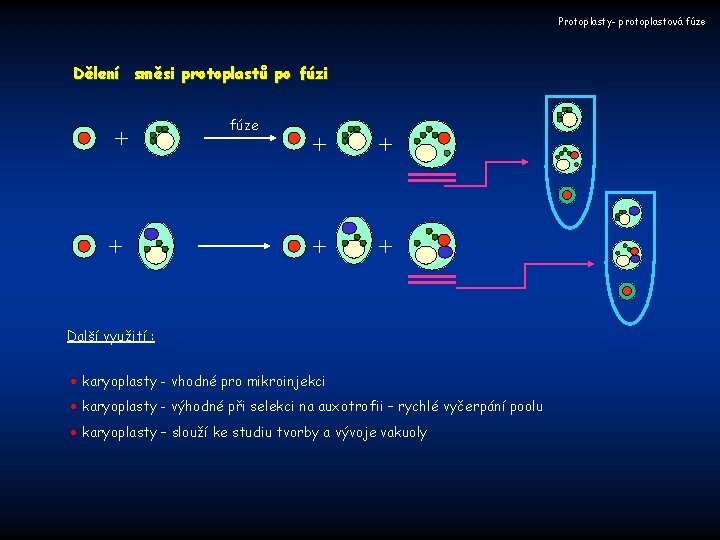
Protoplasty- protoplastová fúze Dělení směsi protoplastů po fúzi + + fúze + + Další využití : karyoplasty - vhodné pro mikroinjekci karyoplasty - výhodné při selekci na auxotrofii – rychlé vyčerpání poolu karyoplasty – slouží ke studiu tvorby a vývoje vakuoly

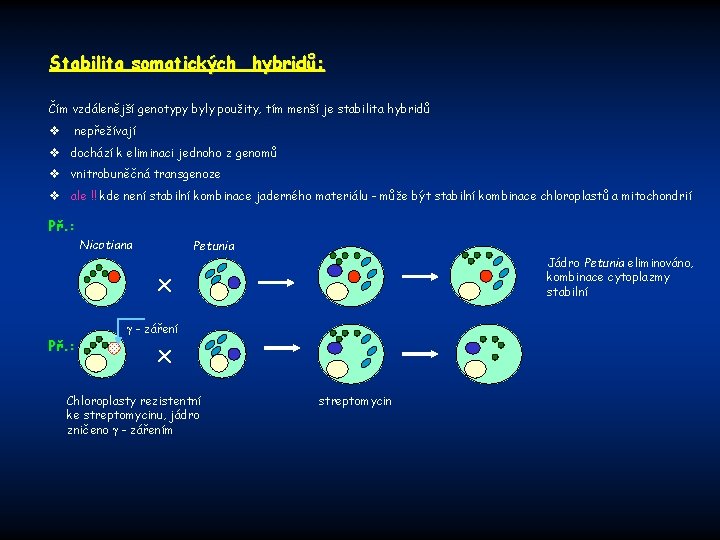
Stabilita somatických hybridů: Čím vzdálenější genotypy byly použity, tím menší je stabilita hybridů v nepřežívají v dochází k eliminaci jednoho z genomů v vnitrobuněčná transgenoze v ale !! kde není stabilní kombinace jaderného materiálu - může být stabilní kombinace chloroplastů a mitochondrií Př. : Nicotiana Petunia Jádro Petunia eliminováno, kombinace cytoplazmy stabilní x Př. : - záření x Chloroplasty rezistentní ke streptomycinu, jádro zničeno - zářením streptomycin

Potenciál somatické hybridizace v Produkce mezidruhových a mezirodových kříženců (kulturní odrůdy rýže x s divokými druhy; rajče X brambor) v Hybridizace s cílem získání určitého znaku Rezistence k chorobám (Brassicaceae, Solanaceae; brambor rezistence – Phytophtora) Rezistence k abiotickým stresům (Fabaceae, Brassicaceceae, Poaceae, Solanaceae, odolnost k nízkým teplotám) Kvalita plodiny (Brassica napus X Eruca sativa , kys eruková)) Přenos cytoplasmatických znaků (samčí sterility, rezistence k herbicidům a antibitikům) v Produkce autotetraploidů v Produkce fertilních diploidů/ polyploidů ze sterilních haploidů, triploidů nebo aneuploidů v Hybridizace rostlin v juvenilní fázi

Limitace somatické hybridizace v nezvládnutá regenerace rostlin z protoplastů v nedostatek vhodné selekční metody pro výběr fuzantů v regenerovaný rostlinný materiál není životaschopný v vývoj chimérických kalusů…(díky výskytu nefúzovaných jader) … pak ztráta chimérického charakteru při organogenezi v mezirodoví hybridi jsou sterilní v regenerované produkty jsou variabilní díky somaklonální variabilitě
























