Lattato deidrogenasi La lattato deidrogenasi LDH o latticodeidrogenasi

- Slides: 7

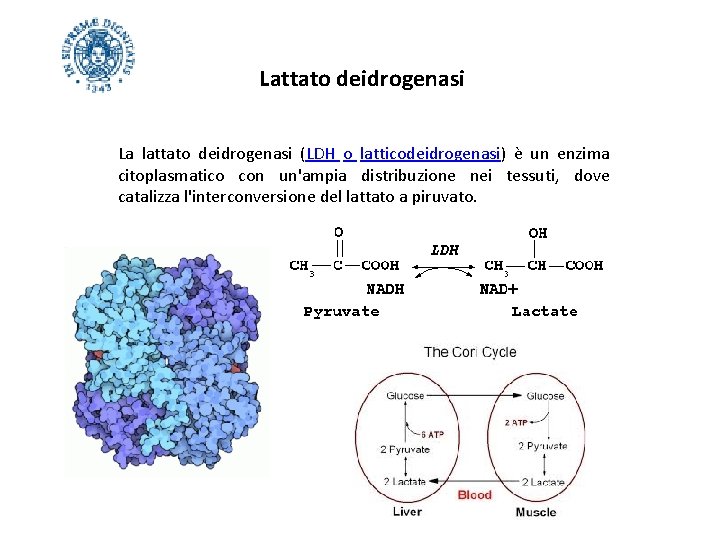
Lattato deidrogenasi La lattato deidrogenasi (LDH o latticodeidrogenasi) è un enzima citoplasmatico con un'ampia distribuzione nei tessuti, dove catalizza l'interconversione del lattato a piruvato.

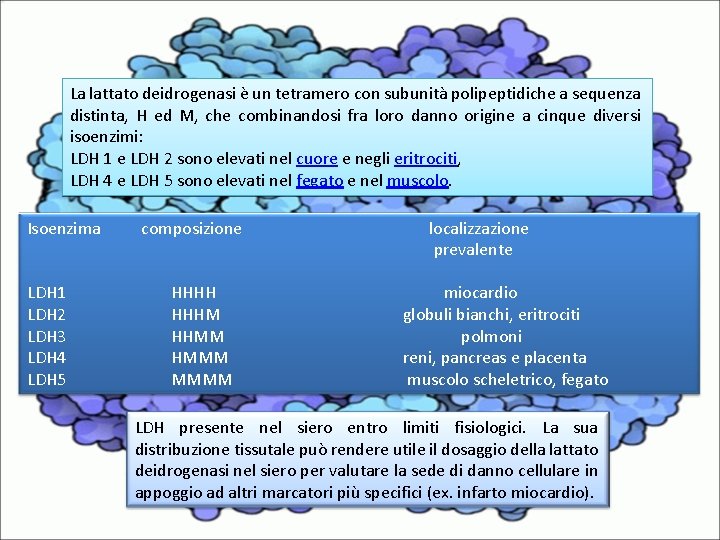
La lattato deidrogenasi è un tetramero con subunità polipeptidiche a sequenza distinta, H ed M, che combinandosi fra loro danno origine a cinque diversi isoenzimi: LDH 1 e LDH 2 sono elevati nel cuore e negli eritrociti, LDH 4 e LDH 5 sono elevati nel fegato e nel muscolo. Isoenzima LDH 1 LDH 2 LDH 3 LDH 4 LDH 5 composizione HHHH HHHM HHMM HMMM MMMM localizzazione prevalente miocardio globuli bianchi, eritrociti polmoni reni, pancreas e placenta muscolo scheletrico, fegato LDH presente nel siero entro limiti fisiologici. La sua distribuzione tissutale può rendere utile il dosaggio della lattato deidrogenasi nel siero per valutare la sede di danno cellulare in appoggio ad altri marcatori più specifici (ex. infarto miocardio).

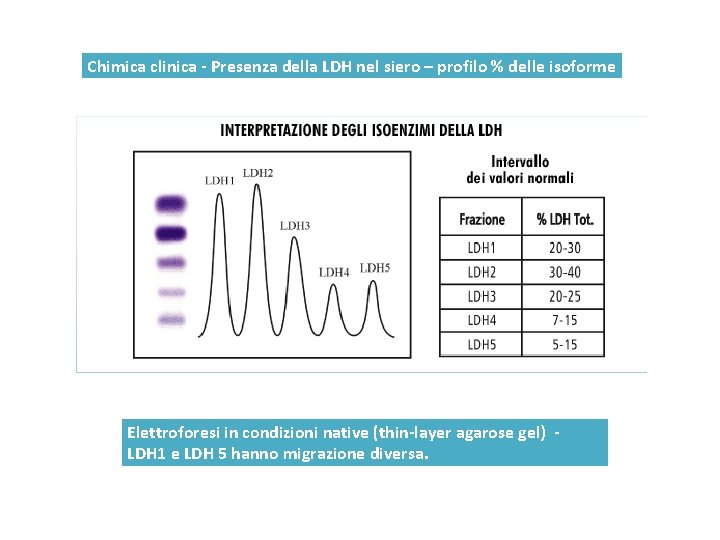
Chimica clinica - Presenza della LDH nel siero – profilo % delle isoforme Elettroforesi in condizioni native (thin-layer agarose gel) LDH 1 e LDH 5 hanno migrazione diversa.

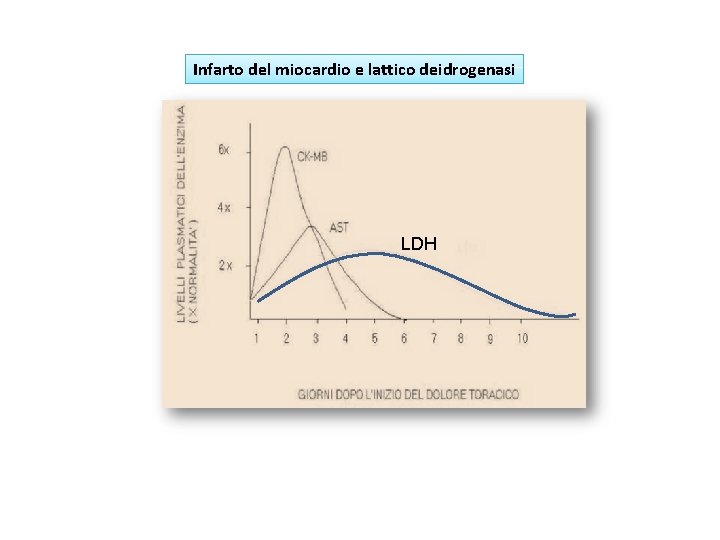
Infarto del miocardio e lattico deidrogenasi LDH

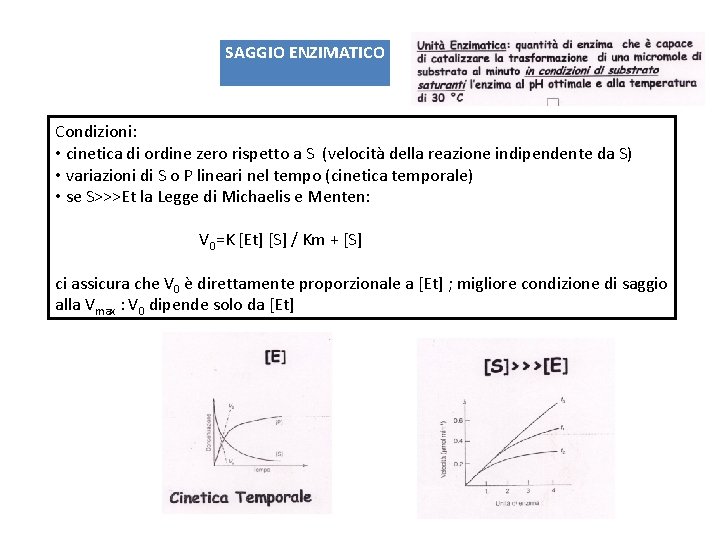
SAGGIO ENZIMATICO Condizioni: • cinetica di ordine zero rispetto a S (velocità della reazione indipendente da S) • variazioni di S o P lineari nel tempo (cinetica temporale) • se S>>>Et la Legge di Michaelis e Menten: V 0=K [Et] [S] / Km + [S] ci assicura che V 0 è direttamente proporzionale a [Et] ; migliore condizione di saggio alla Vmax : V 0 dipende solo da [Et]

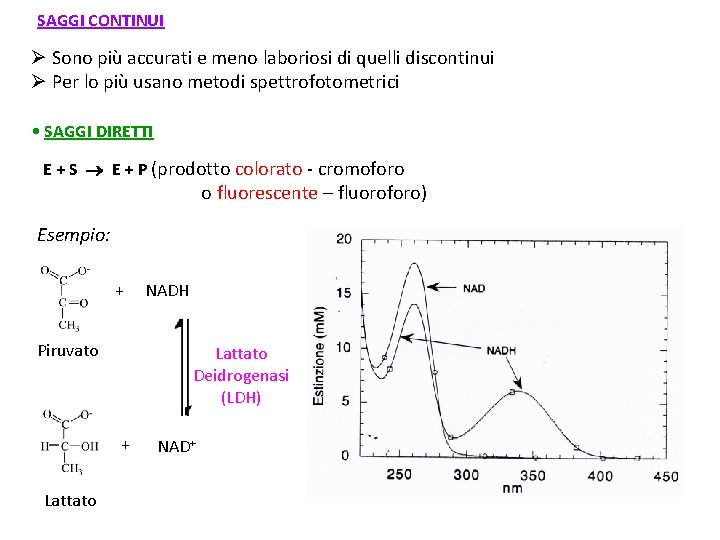
SAGGI CONTINUI Ø Sono più accurati e meno laboriosi di quelli discontinui Ø Per lo più usano metodi spettrofotometrici • SAGGI DIRETTI E + S E + P (prodotto colorato - cromoforo o fluorescente – fluoroforo) Esempio: + Piruvato Lattato Deidrogenasi (LDH) + Lattato NADH NAD+

Per rivelare e quantificare l’attività di un enzima in un campione biologico Ci si avvale delle proprietà degli enzimi: • della specificità di azione • della proporzionalità tra Vel. di reazione catalizzata e concentrazione dell’E nel miscuglio di reazione (in condizioni di S saturante, vel ordine zero). Si segue la reazione nel tempo e si registra l’Assorbanza nella zona di variazione costante (tratto lineare) prendendo un intervallo di tempo Δt e si rileva ΔA. ΔA/ Δt= è una misura della velocità della reazione enzimatica espressa come variazione di assorbanza al minuto da cui si ricava l’attività enzimatica espressa come U/ml Si devono calcolare le µmol di S trasformate in P al minuto = Unità di attività enzimatica Applico la legge di Lambert & Beer : ΔA= ε ΔC l ε = coefficiente di estinzione molare l=1 ΔC = ΔA/ ε Micromoli di S trasformate al minuto (per litro di miscuglio di incubazione) = Unità di attività enzimatica