ESPECTROS ATMICOS LAURA CASTRILLO DELGADO 1 ESPECTROSCOPA Newton




- Slides: 5

ESPECTROS ATÓMICOS LAURA CASTRILLO DELGADO

1. ESPECTROSCOPÍA Newton hizo pasar un rayo de luz solar a través de un prisma de vidrio y observó como se descomponía en una gama de colores continua, denominada espectro solar. Debido a este resultado se pensaba que la luz solar consistía en un espectro continuo. La espectroscopía es la ciencia que estudia la radiación electromagnética emitida o absorbida por las sustancias. • Estudio de las llamas coloreadas Cuando se introduce una sustancia dentro de una llama, cada átomo de ella interacciona con la radiación electromagnética. Dadas las temperaturas tan altas que se alcanzan en la llama, la sustancia pasará a estado gaseoso. Sólo existen átomos “aislados” y los espectros que se obtienen son atómicos y discontinuos. • Espectros atómicos Un espectro es el resultado del análisis de las distintas frecuencias que integran una radiación electromagnética compleja. La energía está cuantizada. La estructura electrónica de un átomo describe las energías y la disposición de los electrones alrededor de un átomo. Los espectros se obtienen con un espectroscopio o espectrógrafo.

2. TIPOS DE ESPECTROS DOS CRITERIOS DE CLASIFICACIÓN: • ORIGEN DE LA LUZ A ESTUDIAR - Espectro de emisión: se analiza la radiación emitida por una muestra gaseosa previamente excitada. - Espectro de absorción: se analiza la radiación restante después de pasar la luz blanca por la muestra.

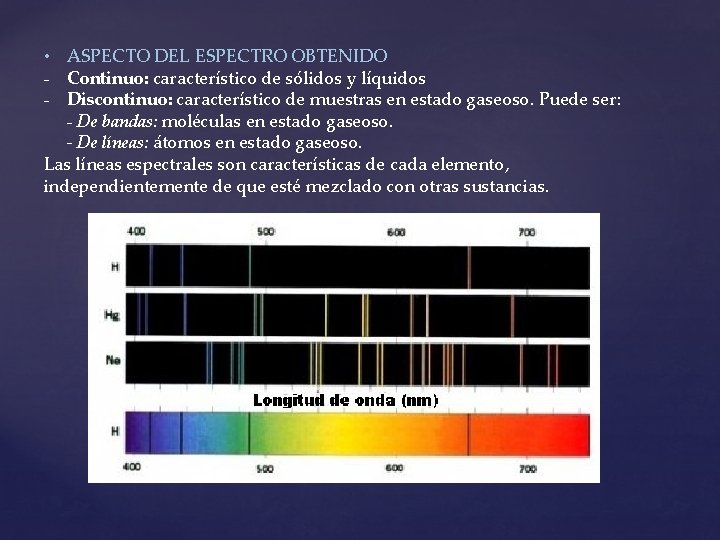
• ASPECTO DEL ESPECTRO OBTENIDO - Continuo: característico de sólidos y líquidos - Discontinuo: característico de muestras en estado gaseoso. Puede ser: - De bandas: moléculas en estado gaseoso. - De líneas: átomos en estado gaseoso. Las líneas espectrales son características de cada elemento, independientemente de que esté mezclado con otras sustancias.

3. ESPECTRO ATÓMICO DEL HIDRÓGENO Es el más sencillo de todos. J. J. Balmer halló una relación para las longitudes de onda de las cuatro líneas brillantes del espectro visible de emisión del hidrógeno. 1/l= RH[(1/2²)-(1/n²)] Posteriormente se descubrieron nuevas regiones del espectro atómico del hidrógeno, observándose que las líneas espectrales aparecían en grupos denominados series y cuyas longitudes de onda λ podían describirse por una fórmula general dada por J. R. Rydberg: 1/λ= RH[(1/n₁²)-(1/n₂²)] Bohr