Donnes actualises de la survie sans progression Survie
- Slides: 6

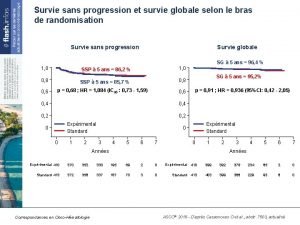
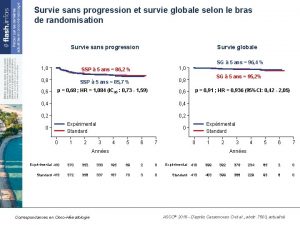
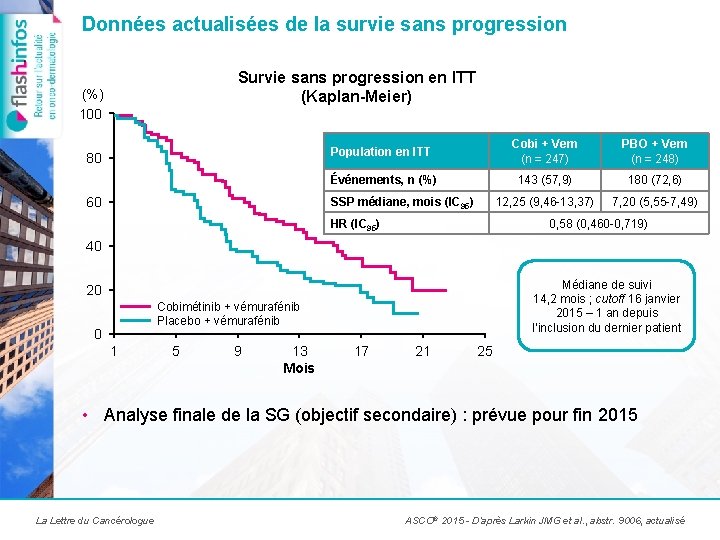
Données actualisées de la survie sans progression Survie sans progression en ITT (Kaplan-Meier) (%) 100 80 60 Population en ITT Cobi + Vem (n = 247) PBO + Vem (n = 248) Événements, n (%) 143 (57, 9) 180 (72, 6) 12, 25 (9, 46 -13, 37) 7, 20 (5, 55 -7, 49) SSP médiane, mois (IC 95) HR (IC 95) 0, 58 (0, 460 -0, 719) 40 Médiane de suivi 14, 2 mois ; cutoff 16 janvier 2015 – 1 an depuis l’inclusion du dernier patient 20 Cobimétinib + vémurafénib Placebo + vémurafénib 0 1 5 9 13 Mois 17 21 25 • Analyse finale de la SG (objectif secondaire) : prévue pour fin 2015 La Lettre du Cancérologue ASCO® 2015 - D’après Larkin JMG et al. , abstr. 9006, actualisé

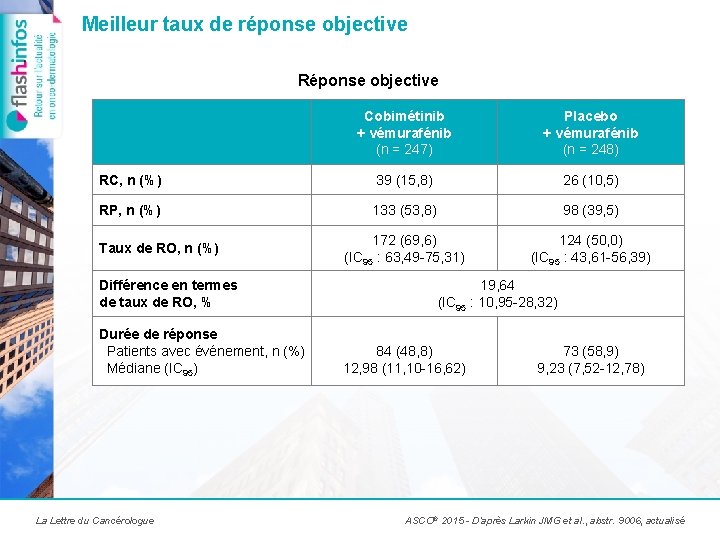
Meilleur taux de réponse objective Réponse objective Cobimétinib + vémurafénib (n = 247) Placebo + vémurafénib (n = 248) RC, n (%) 39 (15, 8) 26 (10, 5) RP, n (%) 133 (53, 8) 98 (39, 5) 172 (69, 6) (IC 95 : 63, 49 -75, 31) 124 (50, 0) (IC 95 : 43, 61 -56, 39) Taux de RO, n (%) Différence en termes de taux de RO, % Durée de réponse Patients avec événement, n (%) Médiane (IC 95) La Lettre du Cancérologue 19, 64 (IC 95 : 10, 95 -28, 32) 84 (48, 8) 12, 98 (11, 10 -16, 62) 73 (58, 9) 9, 23 (7, 52 -12, 78) ASCO® 2015 - D’après Larkin JMG et al. , abstr. 9006, actualisé

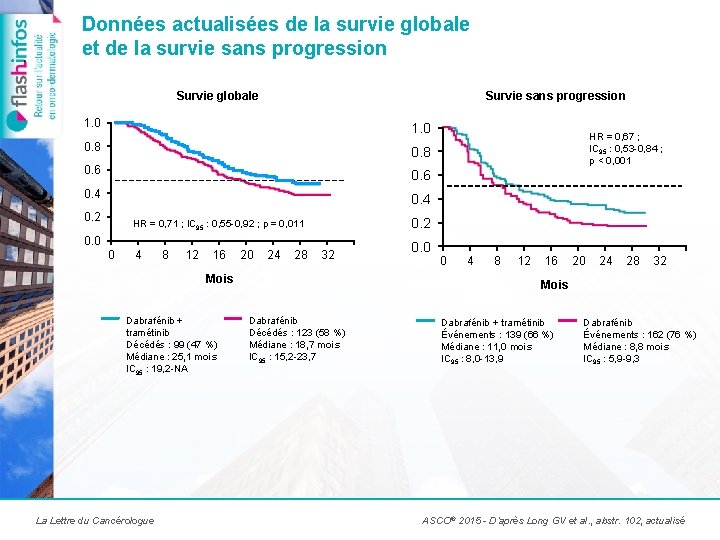
Données actualisées de la survie globale et de la survie sans progression Survie globale Survie sans progression 1. 0 0. 8 0. 6 0. 4 0. 2 HR = 0, 71 ; IC 95 : 0, 55 -0, 92 ; p = 0, 011 0. 0 0 4 8 12 16 20 24 28 32 Mois Dabrafénib + tramétinib Décédés : 99 (47 %) Médiane : 25, 1 mois IC 95 : 19, 2 -NA La Lettre du Cancérologue HR = 0, 67 ; IC 95 : 0, 53 -0, 84 ; p < 0, 001 0. 0 0 4 8 12 16 20 24 28 32 Mois Dabrafénib Décédés : 123 (58 %) Médiane : 18, 7 mois IC 95 : 15, 2 -23, 7 Dabrafénib + tramétinib Événements : 139 (66 %) Médiane : 11, 0 mois IC 95 : 8, 0 -13, 9 Dabrafénib Événements : 162 (76 %) Médiane : 8, 8 mois IC 95 : 5, 9 -9, 3 ASCO® 2015 - D’après Long GV et al. , abstr. 102, actualisé

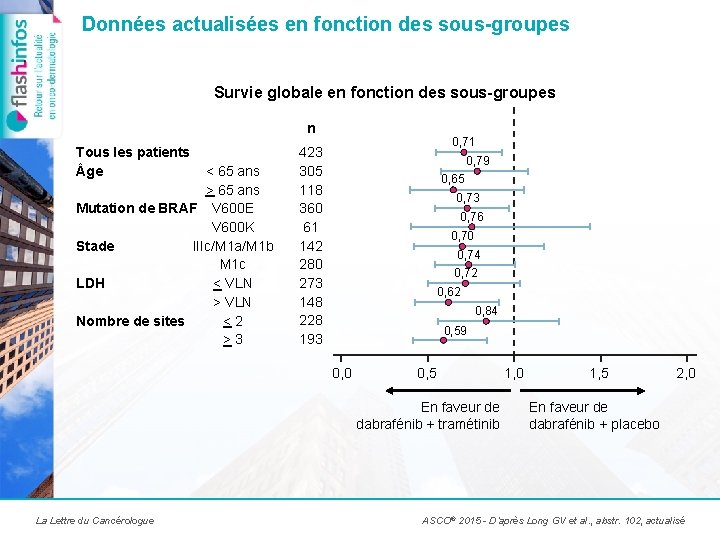
Données actualisées en fonction des sous-groupes Survie globale en fonction des sous-groupes n Tous les patients ge < 65 ans > 65 ans Mutation de BRAF V 600 E V 600 K Stade IIIc/M 1 a/M 1 b M 1 c LDH < VLN > VLN Nombre de sites <2 >3 0, 71 423 305 118 360 61 142 280 273 148 228 193 0, 79 0, 65 0, 73 0, 76 0, 70 0, 74 0, 72 0, 62 0, 84 0, 59 0, 0 0, 5 En faveur de dabrafénib + tramétinib La Lettre du Cancérologue 1, 0 1, 5 2, 0 En faveur de dabrafénib + placebo ASCO® 2015 - D’après Long GV et al. , abstr. 102, actualisé

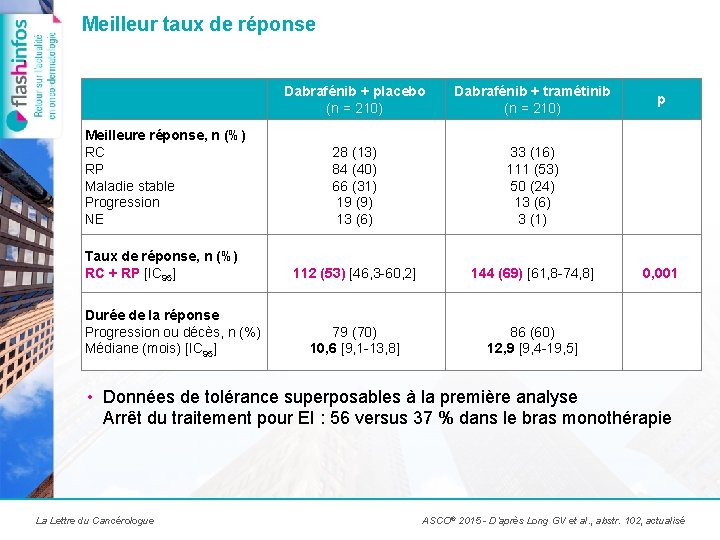
Meilleur taux de réponse Dabrafénib + placebo (n = 210) Dabrafénib + tramétinib (n = 210) Meilleure réponse, n (%) RC RP Maladie stable Progression NE 28 (13) 84 (40) 66 (31) 19 (9) 13 (6) 33 (16) 111 (53) 50 (24) 13 (6) 3 (1) Taux de réponse, n (%) RC + RP [IC 95] 112 (53) [46, 3 -60, 2] 144 (69) [61, 8 -74, 8] 79 (70) 10, 6 [9, 1 -13, 8] 86 (60) 12, 9 [9, 4 -19, 5] Durée de la réponse Progression ou décès, n (%) Médiane (mois) [IC 95] p 0, 001 • Données de tolérance superposables à la première analyse Arrêt du traitement pour EI : 56 versus 37 % dans le bras monothérapie La Lettre du Cancérologue ASCO® 2015 - D’après Long GV et al. , abstr. 102, actualisé

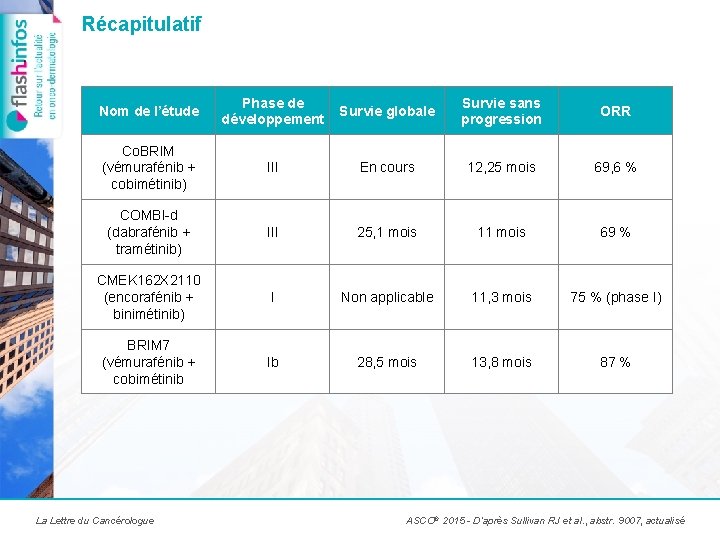
Récapitulatif Nom de l’étude Phase de développement Survie globale Survie sans progression ORR Co. BRIM (vémurafénib + cobimétinib) III En cours 12, 25 mois 69, 6 % COMBI-d (dabrafénib + tramétinib) III 25, 1 mois 11 mois 69 % CMEK 162 X 2110 (encorafénib + binimétinib) I Non applicable 11, 3 mois 75 % (phase I) BRIM 7 (vémurafénib + cobimétinib Ib 28, 5 mois 13, 8 mois 87 % La Lettre du Cancérologue ASCO® 2015 - D’après Sullivan RJ et al. , abstr. 9007, actualisé