Di che cosa si occupa la chimica La









- Slides: 13

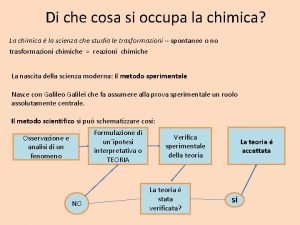
Di che cosa si occupa la chimica? La chimica é la scienza che studia le trasformazioni – spontanee o no trasformazioni chimiche = reazioni chimiche La nascita della scienza moderna: il metodo sperimentale Nasce con Galileo Galilei che fa assumere alla prova sperimentale un ruolo assolutamente centrale. Il metodo scientifico si puó schematizzare cosí: Formulazione di un´ipotesi interpretativa o TEORIA Osservazione e analisi di un fenomeno NO Verifica sperimentale della teoria La teoria é stata verificata? La teoria é accettata SÍ

La materia attorno a noi Gli oggetti che abbiamo intorno sono costituiti da materia. • Materia = tutto ció che possiede una certa massa e un certo volume Gli stati di aggregazione della materia sono fondamentalmente tre: • stato solido • stato liquido • stato aeriforme

• Stato solido I corpi solidi sono caraterizzati da una forma e da un volume definiti. Le particelle che costituisconono i corpi nello stato solido sono molto vicine, hanno una posizione reciproca fissa e non possono spostarsi, tuttavia non sono immobili, dato che vibrano continuamente • Stato liquido I corpi liquidi hanno volume definito ma assumono la forma del recipiente che li contiene Le particelle che costituiscono i corpi nello stato liquido sono molto vicine tra loro e sono libere di scorrere le une sulle altre, la distanza media tra le particelle , per´e sempre la stessa • Stato aeriforme I corpi aeriforme (gas e vapori) occupano tutto lo spazio a disposizione e quindi hanno la forma e volume del contenitore. Le particelle che costituiscono i corpi nello stato aeriforme hanno grande liberta di movimento e la distanza media tra esse é enormente piú grande delle dimensioni di ogni singola particella.

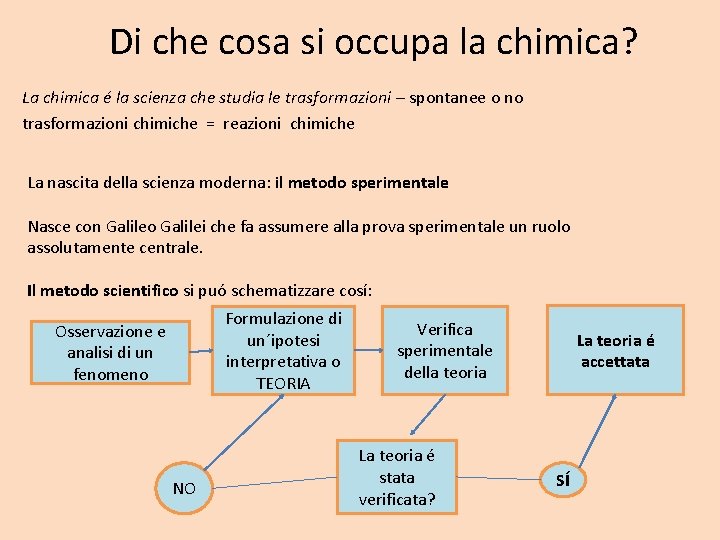
Lo schema riporta i nomi di tuttii passaggi da uno stato di aggregazione all´altro. Normalmente i passaggi di stato avvengono in seguito a una variazione della temperatura. Le trasformazioni che cambiano lo stato di aggregazione di un corpo si chiamano passaggi di stato / cambiamenti di stato


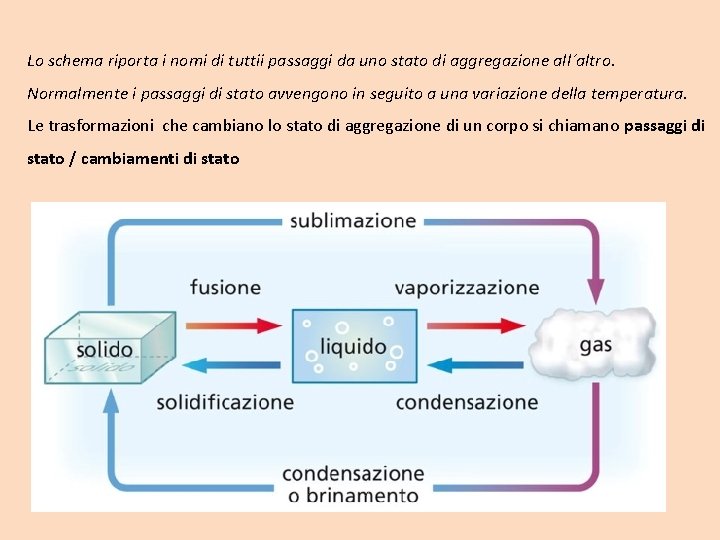
Il sistema e l´ambiente Per osservare con metodo scientifico: • Il sistema puó essere costituito da un singolo corpo o da un insieme di corpi. É quella porzione di materia che viene studiata. • L´ambiente indica tutta la materia che non costituisce il sistema. Il sistema puó integrare con l´ambiente secondo modalita diverse: • Sistema aperto: il sistema puo scambiare materia ed energia con l´ambiente • Sistema chiuso: il sistema puó scambiare solo energia ma non materia • Sistema isolato: il sistema non puó scambiare né materia né energia

Sistema aperto puó scambiare materia e energia ambiente Sistema chiuso puó scambiare solo energia ambiente Sistema isolato non puó scambiare né materia né energia ambiente

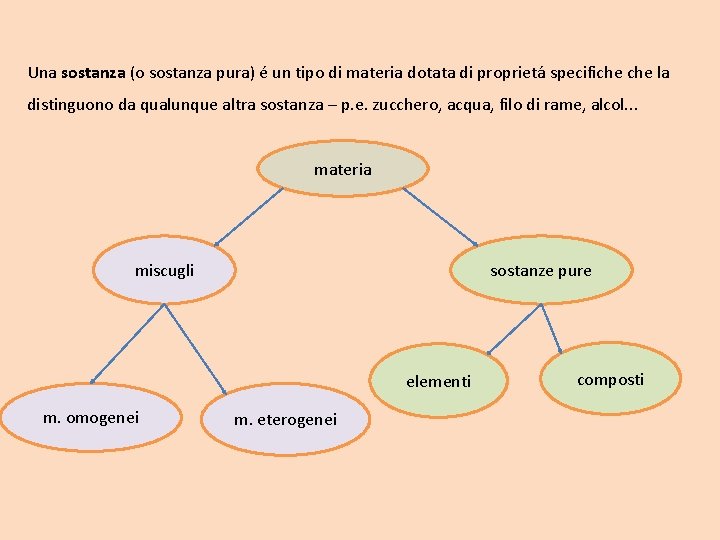
Una sostanza (o sostanza pura) é un tipo di materia dotata di proprietá specifiche la distinguono da qualunque altra sostanza – p. e. zucchero, acqua, filo di rame, alcol. . . materia miscugli sostanze pure elementi m. omogenei m. eterogenei composti

Le sostanze chimiche ü l´acqua potabile – una soluzione costituita da piú componenti ü l´acqua deminerilzzata ( deionizzatori) – presenta ancora tracce di altri componenti ü l´acqua distillata – é un materiale puro, identificato dalla formula chimica H 2 O Ogni sistema che puó considerato come un materiale puro é un individuo chimico – presenta caratteristiche lo rendono unico e inconfondibile = sostanza bicarbonato di sodio, acido solforico e alluminio sono nomi di sostanze e non possono essere mai declinati al plurale. I nomi dei miscugli, invece, si possono usare anche al plurale: infatti esistono diversi tipi di farine, cosí come esistono piú oli, piú benzine. . .

I miscugli sono sistemi costituiti da due o piú materiali mescolati in modo eterogeneo o omogeneo. Miscugli omogenei Miscugli eterogenei I componeneti si mescolano cosí bene da non Ogni componente mantiene le proprie essere piú distinguibili neppure con il caratteristiche e cio permette di individuarlo microscopio. a occhio nudo o con il microscopio. La proprietá sono le stesse in qualunque La proprietá non sono uguali in tutti i punto del miscuglio. Non sempre i componenti possono essere I componenti possono essere sempre mescolati in qualunque quantita e mescolati in qualsiasi quantita e proporzione. la benzina, l´acqua potabile, le leghe di metalli. . . il fumo, le nuvole, il latte

Consideriamo ora molti miscugli che sono attorno a noi: • le leghe – miscugli omogenei formati da due o piú componenti, dei quali quello presente in percentuale maggiore é sempre un metallo – l´acciaio (stagno + rame), il bronzo. Tutte le leghe si trovano allo stato solido, eccetto alcune conteneti mercurio, chiamate amalgami, che possono essere anche liquide. • le sospensioni – miscugli eterogenei in cui piccolissimi granuli di un solido sono dispersi in un liquido – il sangue, succhi di frutta • le emulsioni – miscugli eterogenei tra liquidi, un liquido é disperso sotto forma di gocioline minutissime in un altro liquido in cui non é miscibile – la maionese, latte • gli aerosol – misculi eterogenei formati da un solido o da un liquido dispersi in un gas – i fumi (solido – gas), la nebbia, le nuvole (liquido – gas) • le soluzioni – miscugli omogenei liquidi – un liquido nel quale vengono sciolti uno o piú materiali che possono essere solidi, liquidi o aeriformi – l´acqua potabile

I metodi di separazione dei miscugli – lo stesso principio – tutte sfruttano una proprietá specifica del componente che si intende separare • SETACCIATURA Si puó applicare ai miscugli eterogenei solido-solido in cui un materiale é formato da granuli di dimensioni diverse da quelle degli altri componenti. • FILTRAZIONE La separazione dei miscugli eterogenei solido-liquido e solido-aeriforme. Il miscuglio viene fatto passare attraverso un filtro costituito da maglie con piccoli pori, i granuli del materiale solido venagano trattenuti. • ESTRAZIONE CON SOLVENTE Viene utilizzata per miscugli sia omogenei sia eterogenei. Il miscuglie viene mescolato con un liquido (solvente)che é in grado di scogliere soltanto il componente che si vuole separare.

• DECANTAZIONE Utilizzato sopratutto per la separazione dei miscugli eterogenei solido-liquido (liquido), lasciare a riposo il sistema in modo che i granuli del solido(ha maggior peso specifico) si depositano spontaneamente sul fondo. • CENTRIFUGAZIONE Separazione dei miscugli eterogenei solido-liquido e liquido-liquido. Il miscuglio é introdotto in un recipiente che viene fatto ruotare molto velocemente. Le parti del miscuglio con peso specifico maggiore si raccolgono rapidamente sul fondo e sulle pareti del recipiente. (separare l´olio extravergine d´oliva, ottenere la panna dal latte) • CROMATOGRAFIA Separare miscugli costituiti da molti componenti e sfrutta la diversa velocitadi migrazione dei componenti su opportuni supporti. • DISTILLAZIONE Separare i componenti dei miscugli omogenei solido-liquido e liquido-liquido. Il miscuglio liquido viene fatto bollire e i vapori che si liberano sono poi fatti condensare.
 Fusi orari che cosa sono
Fusi orari che cosa sono Codice ascii esteso
Codice ascii esteso 5 frasi con proposizione oggettiva
5 frasi con proposizione oggettiva Il chimico cosa studia
Il chimico cosa studia Cosa sono le scienze umane e cosa studiano
Cosa sono le scienze umane e cosa studiano Didascalia testo teatrale
Didascalia testo teatrale Che cosa sono gli artropodi
Che cosa sono gli artropodi Cosa significa geometria
Cosa significa geometria Parafrasi cos'è
Parafrasi cos'è Numeri divisibili per 7 tabella
Numeri divisibili per 7 tabella Che cosa sono i numeri relativi
Che cosa sono i numeri relativi Cosa sono i centrioli
Cosa sono i centrioli Esempi di macchine semplici
Esempi di macchine semplici Principi di raggruppamento percettivo
Principi di raggruppamento percettivo