CHAPITRE VI CHROMATOGRAPHIE IONIQUE I INTRODUCTION La Chromatographie






- Slides: 8

CHAPITRE VI CHROMATOGRAPHIE IONIQUE

I – INTRODUCTION La Chromatographie ionique (CI) est une technique qui s’apparente à la CLHP. La phase mobile est constituée par un milieu aqueux ionique et la phase stationnaire par un solide qui joue le rôle d’échangeur d’ions. On utilise comme détecteur un conductimètre avec cellule à circulation, ce qui constitue une méthode de détection sensible et très générale pour toutes les espèces ionisées.

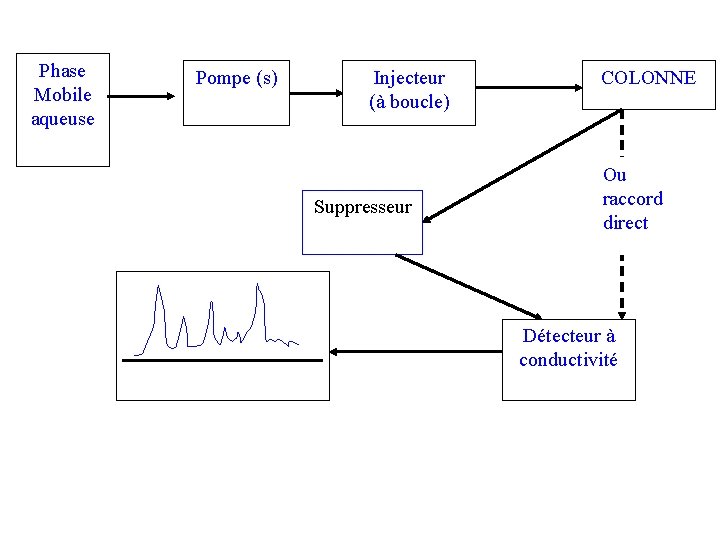
II – PRINCIPE DE LA CHROMATOGRAPHIE IONIQUE La séparation des ions ou composés polaires présents dans l’échantillon et entraînés par la phase mobile, résulte de leurs interactions avec les sites ioniques de la phase stationnaire. La détection des composés ioniques de l’échantillon est rendue difficile par suite de leur faible concentration au sein de la phase aqueuse chargée d’une grande quantité d’ions. La méthode utilisée constitue à abaisser au maximum la conductivité de l’effluent de la colonne de séparation avant son passage dans le détecteur en plaçant entre les deux un « suppresseur » qui a pour but d’éliminer les ions de l’éluant par réaction de type acido-basique.

Phase Mobile aqueuse Pompe (s) Injecteur (à boucle) Suppresseur COLONNE Ou raccord direct Détecteur à conductivité

III – PHASE IONIQUE ♣ La phase mobile est une solution aqueuse contenant des électrolytes. ♣ Dans ce milieu les solutés ainsi que les groupements fonctionnels de la phase stationnaire sont ionisés, ce qui conduit à un mécanisme d’élution par déplacement des équilibres chimiques. ♣ Pour séparer les espèces cationiques (type M+), on utilise une colonne cationique. La phase mobile sera acide. La présence de l’espèce M+ dans l’éluant modifiera l’équilibre au niveau des échangeables de la colonne. (Eluant)M+ + [ Résine-SO 3 -]H+ (éluant)H+ + [Résine-SO 3 -]M+ ♣ Par contre pour séparer des anions, on choisira une colonne anionique. Dans ces conditions, un électrolyte A-, présent dans l’éluant donnera lieu à l’équilibre suivant : (Eluant)A+ + [ Résine-NR 3](CO 3 H-) (éluant)(CO 3 H-) + [Résine-NR 3] + A-

Phases stationnaires Il existe 3 principaux types de matrice : a/ Résines échangeuses d’ions La matrice est constituée par un réseau macromoléculaire tridimensionnel, le plus souvent un copolymère styrène-divinylbenzène sur lequel sont greffés à caractère acide ou basique. Exemple : - Résine échangeuse de cations à groupements sulfurate : SO H

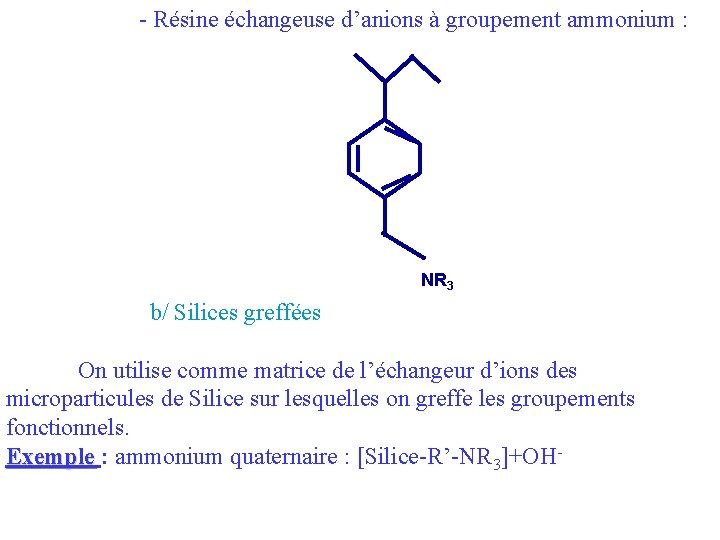
- Résine échangeuse d’anions à groupement ammonium : NR 3 b/ Silices greffées On utilise comme matrice de l’échangeur d’ions des microparticules de Silice sur lesquelles on greffe les groupements fonctionnels. Exemple : ammonium quaternaire : [Silice-R’-NR 3]+OH-

c/ Résines pelliculaires On dépose sur un support imperméable à la phase liquide (des billes de verre par exemple) une fine couche superficielle d’une résine échangeuse d’ions. Principe de méthode















